Myf5在不同生长阶段小鼠心肌中的定位与表达
李经纬,薛霖莉,2,曹 靖,冀云燕,李艺雷,任华伟,罗小毛,于秀菊,赫晓燕,王海东
(1.山西农业大学动物科技学院,山西 太谷 030801;2.山西农业大学信息学院,山西 太谷 030800;3.北京农业职业学院畜牧兽医系,北京 102442)
近年来,有关心血管疾病的患病率呈现逐年升高的趋势,并且心血管疾病给患者的身心健康和生活质量带来了严重的不良影响[1]。例如,心功能不全、心肌钙化、心肌肥厚、先天性心脏病、冠状动脉粥样硬化性心脏病的发生均与心脏相关转录因子的突变和功能失调有着十分紧密的关系[2]。研究调控心脏相关转录因子的表达机制是细胞分子生物学研究中的热点,有利于对心血管疾病的发生、发展及预后有更加精确的判断。
调节因子 MRFs(Myogenic Regulatory Factors)家族可编码多种不同的转录因子,包括MyoD(Myf3),Myogenin(MyoG),Myf5 和 Myf6(MRF4),它们是控制肌细胞增殖和分化的关键调节因子,跟肌纤维的数量、大小有着密切的关系[3]。在结构上,调节因子MRFs 家族均含有一段大小为80 个氨基酸的高度保守的中央蛋白基序(motif)形成的碱性螺旋-环-螺旋(bHLH)的结构域,该结构包含的Basic 结构和HLH 螺旋结构分别是与DNA 相互作用的区域和与其他因子相互作用的位点也是调控的重要功能结构区域[4]。调节因子MRFs 家族成员能够通过对不同E-Box 识别和结合,从而选择性的对肌肉特异性基因进行选择性的表达调控[5]。在动物体发育的不同阶段,MRFs 中的相关转录因子在肌肉发育过程中相互协同作用,对肌组织发育发挥着不同的表达调控作用,NAIDU 等[6]研究表明,Myf5在上游能够调控肌细胞开始向成肌纤维分化。
目前,通过建立斑马鱼模型已经发现一些与心脏的特化与分化、心脏祖细胞的迁移、心血管的形成以及心脏功能的一些基本的调节因子和调控机制[7]。YANG 等[8]通过敲除斑马鱼 Myf5,结果发现,斑马鱼的斜纹肌、外直肌、胸骨肌、舌骨肌和所有咽喉部的相关肌肉的发育受到了明显的抑制。随着特定基因敲除技术的提高和组织诱导表达工具盒的广泛运用,在已有的模式组织中用已经了解存在的基础科研知识筛选心脏发育疾病的候选基因相当热门。RUDNICKI 等[9]研究发现,将小鼠的Myf5 和MyoD 基因都敲除后,缺失Myf5 和MyoD 的小鼠肌纤维和成肌细胞生成受到了显著抑制。敲除MyoD的小鼠在胚胎发育过程中基本上和正常小鼠一致[10],但是Myf5 的表达量在祖细胞中大幅提高,并且试验组小鼠四肢的发育显著延迟[11]。RUDNICKI 等[12]在试验中通过敲除小鼠Myf5 发现,虽然小鼠四肢发育正常,但是小鼠的MyoD 的表达明显延迟,而且小鼠的肌节发育也明显变缓。
有关Myf5 的研究主要集中在骨骼肌发育方面的表达调控,但对Myf5 在心肌发育过程中表达调控作用的研究甚少。
本试验通过对幼年、性成熟、体成熟和老年4 个不同发育阶段的小鼠心肌组织采用HE 染色法、免疫组织化学法和实时荧光定量PCR 技术,对Myf5 在小鼠心肌表达情况进行定性和定量分析,初步探讨Myf5 在正常小鼠心肌不同发育阶段的表达情况,为进一步揭示Myf5 在心脏发育的病理状况差异性和调控机制提供理论依据。
1 材料和方法
1.1 材料
1.1.1 试验动物 随机选取健康的幼年(1 周龄)、性成熟(3-4 周龄)、体成熟(8 周龄)和老年(12 周龄)发育阶段的小鼠各4 只,试验小鼠均由山西农业大学动物医学国家级实验室教学示范中心提供。
1.1.2 试剂 Trizol、反转录试剂盒、qRT-PCR 试剂盒,均购自TaKaRa 公司;免疫组化试剂盒,购自北京康为世纪生物科技有限公司;Myf5 兔多克隆抗体,购自武汉三鹰公司;Myf5 上下游引物,购自北京六合华大基因科技有限公司。
1.2 石蜡切片制作
选取健康的幼年、性成熟、体成熟和老年发育阶段的小鼠各4 只,采用断颈法处死小鼠,取其心肌组织,之后将心肌组织进行横切,并用Bouins 固定液固定。之后经过脱水、透明、浸蜡、包埋4 步处理后使用切片机切成6 μm 厚的切片。
1.3 HE和免疫组织化学染色
1.3.1 小鼠心肌组织HE 染色 将心肌组织切片经二甲苯和不同梯度浓度酒精脱蜡、复水后,依次用苏木精和伊红染色,之后进行脱水、透明、中性树胶封片,并于显微镜下观察。
1.3.2 小鼠心肌组织免疫组织化学 切片脱蜡、复水后,用PBS 缓冲液进行冲洗,擦净,枸橼酸盐微波抗原修复30 min,冷却后滴加内源性过氧化物酶封闭液(solution A),之后室温孵育10 min,并用PBS缓冲液冲洗后滴加羊血清工作液(solution B),室温孵育20 min 并滴加一抗(1∶30 稀释),阴性对照滴加PBS 代替一抗,将切片置于4 ℃冰箱过夜;次日,室温孵育30 min 后用PBS 缓冲液冲洗并滴加生物素标记羊抗兔二抗工作液(solution C),之后37 ℃孵育30 min 并用PBS 缓冲液冲洗;然后滴加HRP 标记的链霉亲和素(solution D)后在37 ℃孵育30 min,依次在切片组织上滴加30 μL 的DAB 显色剂并用PBS 缓冲溶液进行冲洗,经苏木精复染、脱水、透明,最后用中性树胶进行封片、显微镜下观察。
1.4 引物设计
根据NCBI 检索小鼠的Myf5 基因序列,使用Premier 5.0 软件设计荧光定量PCR 扩增引物,并对引物的特异性进行初步检测,引物由北京华大公司合成。引物序列和产物长度列于表1。

表1 引物序列和产物长度
1.5 RNA提取和qRT-PCR
Trizol 法提取幼年、性成熟、体成熟、老年4 个年龄阶段小鼠的心肌组织总RNA 并测定浓度,之后反转录并使用荧光定量试剂盒进行荧光定量PCR,反应条件为:95 ℃预变性 10 min;95 ℃变性30 s,60 ℃退火 30 s,72 ℃延伸 10 s,30~35 个循环。内参条件同上进行扩增,每个样本至少3 个重复,反应完成后,运用 2-ΔΔCT法计算 Myf5 在幼年、性成熟、体成熟、老年4 个年龄阶段小鼠心肌组织的相对表达水平。
2 结果与分析
2.1 不同发育阶段小鼠心肌形态学特征分析
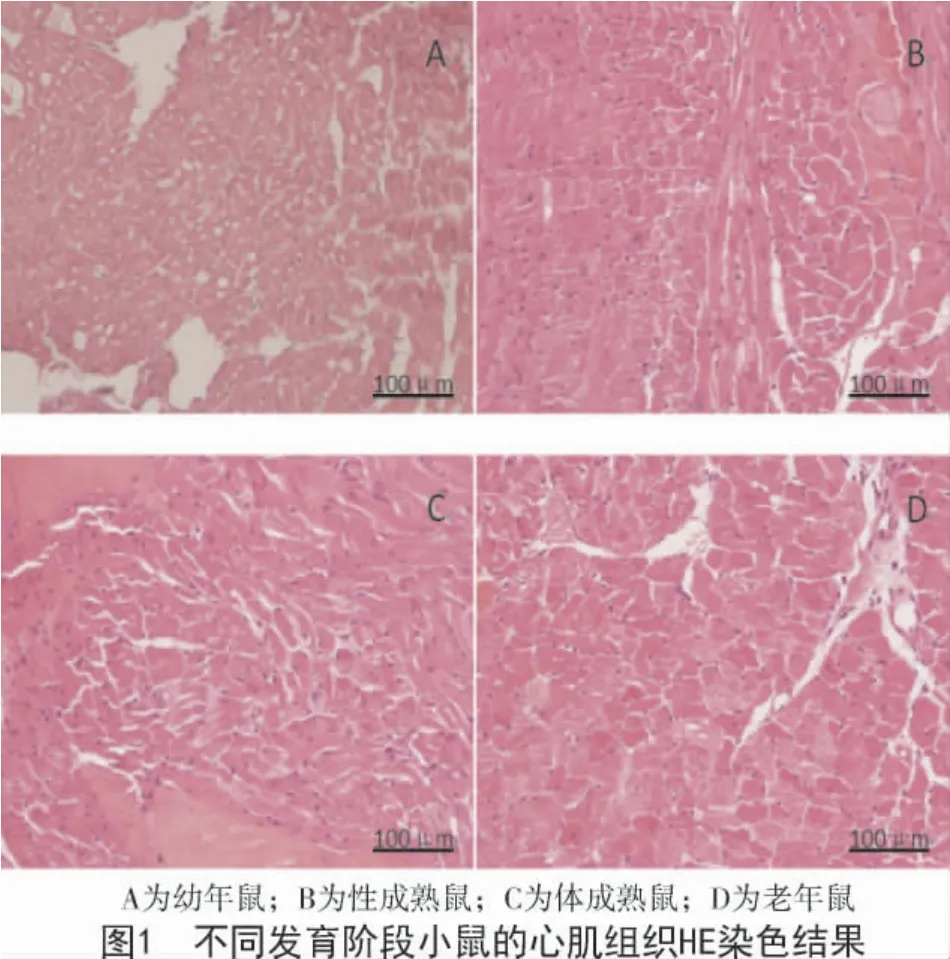
不同发育阶段的小鼠心肌组织HE 染色结果显示,随着小鼠的发育成熟,肌纤维的横切面逐渐增大,细胞核逐渐变大,中心化现象减少。细胞核和肌纤维面积的比值也呈现渐变性的缩小,发育到老年阶段比值达到最小。同时,组织间隙也越来越变宽,特别是在体成熟阶段组织之间的间隙明显增多,到达老年阶段组织间隙达到最大(图1)。
2.2 不同发育阶段小鼠心肌Myf5蛋白表达情况分析
不同发育阶段小鼠心肌组织的免疫组化结果显示,Myf5 在4 个不同发育阶段的小鼠心肌组织细胞中均有表达,表达部位为细胞核。而且在幼年阶段小鼠心肌组织胞核着色程度最深,其次是老年的小鼠心肌组织,在性成熟和体成熟小鼠心肌组织中表达最低,说明Myf5 在幼年阶段小鼠心肌组织的表达量最高,其他发育阶段的表达量较低(图2)。

2.3 Myf5基因PCR扩增结果分析
经过PCR 筛选发现,条带3 没有出现非特异性的条带和拖尾现象,而且产量高,片段大小符合设计,得出最适合的退火温度为60 ℃(图3)。
2.4 不同发育阶段小鼠心肌Myf5 mRNA表达差异分析
根据 Myf5 扩增曲线(图4)可以发现,Myf5 基因扩增曲线和内参扩增曲线均呈现“S”型曲线,有平稳的平台期。将实时荧光定量PCR 检测出的Myf5 在不同发育阶段小鼠心肌组织表达量的数据进行处理,得出Myf5 基因在不同发育阶段小鼠心肌组织的相对表达量有显著性差异(图5),即随着小鼠的发育成熟,Myf5 在不同发育阶段心肌组织中的表达呈现先降低后升高趋势,与性成熟、体成熟阶段相比,幼年心肌组织的表达量呈现差异极显著(P<0.01),与老年阶段差异不显著(P>0.05)。Myf5 从幼年开始到老年、体成熟、性成熟阶段表达依次降低,性成熟阶段达到最低。



3 讨论
Myf5 是调节因子MRFs 家族的重要成员,在不同的时空通过对肌细胞的增殖和分化进行调控,并与成肌纤维的数量以及肌卫星细胞修复再生有着紧密的联系。CASES 等[13]在研究中发现,Myf5 是调节因子MRFs 家族中最早开始被诱导表达,即在小鼠的胚胎发育过程就已经开始了表达。调节因子MRFs 家族的各个成员之间在表达调控上有着紧密的相互联系,因此,Myf5 对MRFs 家族其他成员的表达起到了关键性的诱导作用。LUDOLPH 等[14]在对Myf5 在非洲爪蟾的胚胎发育过程中作用的研究时发现,Myf5 过表达会激活非肌细胞系,从而使得生肌节代偿性增大。并且RUDNICKI 等[12]在试验中通过敲除小鼠Myf5 发现,虽然小鼠四肢发育正常,但是小鼠的MyoD 的表达明显延迟,而且小鼠的肌节发育也明显变缓。敲除MyoD 的小鼠在胚胎发育过程中基本上和正常小鼠一致[10],但是Myf5 的表达量在祖细胞中大幅提高,并且MyoD 敲除组小鼠四肢的发育显著延迟[11]。RUDNICKI 等[9]通过试验研究发现,将小鼠的Myf5 和MyoD 基因都敲除后,缺失Myf5 和MyoD 的小鼠肌纤维和成肌细胞生成受到了显著抑制。这些试验都说明,Myf5 在肌组织的表达起着重要调控作用,并且KNOLL 等[15]证实了Myf5 在小鼠的成肌细胞和肌卫星细胞的增殖与分化的过程中均起着重要调控作用。本试验发现,随着小鼠的发育成熟,Myf5 在心肌组织的表达呈现出一定关联性。MONTARRAS 等[16]研究表明,Myf5 主要与成肌细胞的特化与增殖有关,而Myf5 对肌细胞的分化具有更重要作用。Myf5 在功能上与成肌细胞数目有着紧密的联系,并且在小鼠出生时心脏组织基本发育完全。随着小鼠的发育成熟,Myf5 在心肌组织的表达会呈现降低的趋势,这与本试验的结果基本吻合。
吴琼彪等[17]通过对乌珠穆沁羊生长不同发育阶段中骨骼肌MRFs 家族基因在组织的特异性表达的研究发现,MRFs 家族基因相对表达量为6月龄>12月龄>18月龄,6月龄的基因表达量最高,与其他月龄之间相比有显著差异,与本研究结果一致。黎威等[18]研究发现,马身猪和大白猪背最长肌中Myf5 mRNA 相对表达量均为初生时最高,30日龄次之,之后逐渐降低。陈禧等[19-20]对Myf5 基因在第10,14,18,22,27 天的鸭胚和出生后 1 周雏鸭的小肠平滑肌的相对表达量研究发现,Myf5 基因在不同的发育阶段中表达呈现先增高后降低的变化趋势,第10 天表达量最高。综上所述,从出生后随着动物的发育成熟,Myf5 无论在平滑肌组织、骨骼肌组织还是心肌组织中的表达均呈现降低的变化趋势。
SANTERRE 等[21]通过基因转染的方法成功的将小鼠Myf5 基因转染进牛的基因组后,发现被转染的牛能够表达小鼠的Myf5 基因并且产生了异位性的肌肉。而且LINDON 等[22]对Myf5 在成肌细胞表达调控的研究发现,Myf5 在不同的时空中有着不同的表达模式。总之,Myf5 基因表达与心肌正常发育调控有着明显的相关性,但是在患有心脏疾病的病理情况下,Myf5 表达变化的研究还不够充分,依然需要对Myf5 在心脏发育的病理状况差异性表达和调控机制做进一步的研究。
4 结论
本研究结果表明,在小鼠心肌组织发育的不同阶段中,Myf5 表达在幼年鼠最高,性成熟鼠最低,其呈现先降低后缓慢上升的趋势,并且幼年阶段与其他的不同发育阶段呈现极显著性差异,表明Myf5 表达与小鼠心肌组织发育具有相关性。

