温度对铜绿假单胞菌生长的影响及其预测研究
朱蕾,张爱静,王鹏杰,李琳琼,高瑀珑
(南京财经大学 食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
假单胞菌是一种能在低温下生长的食品腐败菌,极易污染肉制品、乳制品和蔬菜等食品并引起腐败变质。因此,该菌是引起食品腐败变质的重要微生物[1]。铜绿假单胞菌(Pseudomonas aeruginosa)是假单胞菌中最常见的一个种,又称绿脓杆菌,广泛分布于水、空气、土壤以及人体的呼吸道、皮肤和肠道等处,尤其在潮湿的自然环境中更易生长繁殖,所以其传播途径广泛[2],该菌是一种条件性致病菌,可引起人类急性肠道炎、皮肤炎、败血病和脑膜炎等疾病,其产生的内、外毒素具有致病性,内毒素能引起系统炎症反应综合征(systemic inflammatory responsible syndrome,SIRS),对于老人、小孩等抵抗力较弱的群体危害较大,其外毒素侵入敏感细胞后,引起哺乳动物蛋白合成受阻,临床上常引起继发性感染[3-4]。2014年之前,在食品卫生监测工作中对其监控较少,与食物中毒相关的报道较少,但由于其对抗生素等化学治疗剂有较强的抵抗性[5],分布广,在食品中污染机会较多,有报道建议将铜绿假单胞菌列入食物中毒致病菌的目录中[6]。2003年黄美子等[7]报道了食用新鲜猪肉后出现腹痛、腹泻、呕吐等症状的案例,经卫生防疫鉴定是由铜绿假单胞菌引起的。2010年沈瑛等[8]也报道出铜绿假单胞菌引起食物中毒的事件。2014年我国对瓶装饮用水等卫生检测进行了修订,增加对铜绿假单胞菌的监测检验,将其确认为食源性和水源性致病菌。随着人们对食品安全的重视,食品微生物安全预测是人们目前关注的热点[9]。食品微生物预测学是一门基于微生物学、应用计算机学、工程数学及统计学等的综合学科。微生物预测模型的建立有利于食品在贮藏、运输和销售等期间内微生物变化的监测,了解其存活信息[10],为食品的微生物安全控制提供科学理论依据[11]。微生物生长预测模型主要有一级模型、二级模型。一级模型是描述微生物数量对时间的函数,常见的一级模型有Linear模型、Logistic[12]模型和Gompertz[13]模型等。Linear模型的操作简便,但预测的精确度不高;Logistic模型在数学上是用于描述一个普通笛卡尔平面上的S形曲线,有人将其用于研究细菌生长曲线,但其不能完整显示S形曲线,是一个无迟滞期的S形曲线[12],而Gompertz模型克服了这些缺点,目前应用较多[9]。Gompertz模型能够较好地用于研究单细胞微生物的生长曲线,在研究细菌生长的迟滞期、指数期和稳定期时,分别用迟滞时间(λ)、最大比生长速率(μmax)、最大菌落数(b)来描述这3个阶段的特征。在食品储藏期间,λ可用于分析食品货架期的参数,表示食品安全储存时间的长短;μmax是微生物生长动力学参数,表示食品腐败变质的速率;b表示在腐败变质的食品中,微生物的最大生长量。目前国内外对一些食品基质中微生物生长模型的建立已有一些报道,但是对于铜绿假单胞菌预测模型的研究鲜有报道。邹宇等[14]运用Gompertz模型、Logistic模型建立了在低温下李斯特氏菌的生长模型,发现Gompertz模型为李斯特氏菌在牛奶中生长的最适模型;Møller等[15]在新鲜牛肉中建立了沙门氏菌的生长模型;Yong[13]等用Gompertz和Logistic模型拟合了生猪肉中李斯特氏菌的生长曲线。目前用来研究微生物生长常用的二级模型有Ratkowsky[16]模型、Square Root[17]平方根模型、二次多项数学模型[18]、Arrhenius模型[9,19]。Square Root模型没有生物学基础,是基于观察,认为微生物最大比生长速率的平方根与生长温度成线性关系;二次多项数学模型是研究多种因素对微生物的生长的影响,其中的参数也没有明确的物理意义;Arrhenius模型最初是用来表征化学反应中反应速率与温度之间的关系,有人也曾用此模型来预测微生物的生长,因误差较大,目前应用较少。研究温度对微生物生长速率的影响,常采用Ratkowsky模型。目前对于新增的食源致病性铜绿假单胞菌安全预测的研究国内外鲜见报道。本研究旨在以食源致病性铜绿假单胞菌为研究对象,为预测其安全性,本研究基于Gompertz模型、Ratkowsky模型、Hyperbola[20]模型研究铜绿假单胞菌从6℃到48℃的生长;研究生长温度对铜绿假单胞菌最大比生长速率μmax与迟滞时间λ的影响;将μmax与λ的乘积定义为菌体细胞的生理状态参数h0,研究生长温度对菌体h0的影响。建立铜绿假单胞菌生长的预测一级模型;建立生长温度对最大比生长速率μmax、迟滞时间λ影响的预测二级模型,为其在食品中的安全控制奠定理论依据。
1 材料与方法
1.1 材料及处理
铜绿假单胞菌(Pseudomonas aeruginosa)ATCC27853:北京微生物研究所,采用胰蛋白胨大豆肉汤(tryptic soy broth,TSB)培养基培养。供试菌经活化后,接入TSB液体培养基,于37℃、140 r/min振荡培养48 h,备用。
1.2 主要仪器与试剂
胰蛋白胨大豆肉汤培养基(TSB)、胰蛋白胨大豆琼脂培养基(tryptic soy agar,TSA):南京丁贝生物科技有限公司。
BSC-1300ⅡA2型生物安全柜:上海博讯实业有限公司医疗设备厂;Scan1200型自动影像分析菌落计数仪:法国Intersicence公司;ZQTY-70S型大容量低温摇床:上海知楚仪器有限公司;HZQ-F160全温震荡培养箱:太仓市实验设备厂;101-3AS电热鼓风干燥箱:上海苏进仪器设备厂;GNP-9160型隔水式恒温培养箱:上海三发科学仪器有限公司;SX-500高压灭菌锅:日本TOMY公司;Sartorious精密电子天平:北京塞多斯天平有限公司;BCD-196T型冰箱:青岛海尔股份有限公司;微生物试验常规仪器。
1.3 试验方法
1.3.1 铜绿假单胞菌ATCC27853在不同温度的生长及平板菌落计数
将1.1节制备的ATCC27853菌悬液接种于TSB培养基中,然后分别置于6、10、16、22、28、36、42、45、48、50℃下,140 r/min振荡培养,每个温度在不同时间点进行取样并菌落计数,不同的培养温度选取不同的时间间隔取样并在TSA平板上进行菌落计数。按文献[21]方法进行菌落记数。ATCC27853的生长量的表达:计算每毫升培养基中活菌的数量(CFU/mL),然后用以10为底的对数来表示lg(CFU/mL)。
1.3.2 铜绿假单胞菌ATCC27853在不同温度下生长的一级Gompertz模型的建立
本研究利用Gompertz模型来拟合ATCC27853在6、10、16、22、28、36、42、45、48℃的温度下的生长曲线,建立ATCC27853在不同温度下生长的一级模型,Gompertz模型见(1)式
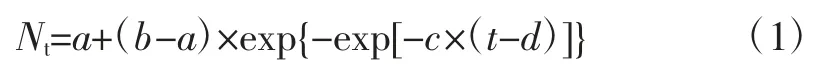
式中:Nt为在某时间t,ATCC27853菌数的对数,lg(CFU/mL);a为(时间t=0时)ATCC27853初始菌数的对数,lg(CFU/mL);b为ATCC27853最大菌数的对数,lg(CFU/mL);c为ATCC27853在d时刻的最大生长速率,h-1;d为达到最大生长速率时所用的时间,即生长曲线的拐点,h。
细菌的最大比生长速率μmax和迟滞时间λ是用来描述其生长的两个关键参数。ATCC27853的μmax、λ与Gompertz模型的相关参数之间的关系[22]分别见(2)和(3)式

式中:μmax为ATCC27853的最大比生长速率,h-1;a为(时间t=0时)ATCC27853初始菌数的对数,lg(CFU/mL);b为ATCC27853最大菌数的对数,lg(CFU/mL);c为ATCC27853在d时刻的最大生长速率,h-1;e为自然常数,等于2.718 28。
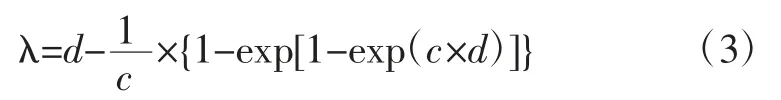
式中:λ为ATCC27853的迟滞时间,h;c为在d时刻的最大生长速率,h-1;d表示达到最大生长速率时所用的时间,即生长曲线的拐点,h。
将(2)、(3)式代入(1)式中,则Gompertz模型可转化为(4)式
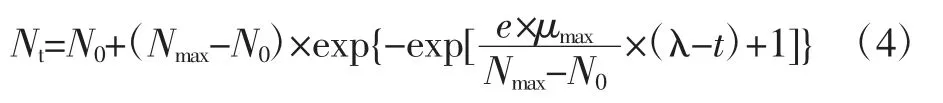
式中:Nt表示某时间t,ATCC27853每毫升菌悬液中菌数的对数,lg(CFU/mL);N0为时间t为0时,ATCC 27853每毫升菌悬液中初始菌数的对数,lg(CFU/mL);Nmax为ATCC27853最大菌数的对数,lg(CFU/mL);λ 为ATCC27853的迟滞时间,h;μmax为最大比生长速率,h-1;e为自然常数,等于2.718 28。
微生物生长的迟滞期是指微生物接种到新鲜培养液后,因代谢系统适应新环境的需要,RNA含量增加,核糖体、酶类和ATP等内含物的合成加速,新的细胞成分被合成,细胞形态和体积变大,但这一阶段细胞数目没有增加。本研究中,我们将这一阶段的这种生理、代谢状态称之为细胞的生理状态,用参数h0来表示[13],用来描述细胞适应新环境的能力,h0与迟滞时间λ和最大比生长速率μmax的关系[23]见(5)式

式中:h0为细胞生理状态参数;μmax为最大比生长速率,h-1;λ 为ATCC27853 的迟滞时间,h。
1.3.3 铜绿假单胞菌ATCC27853在不同温度下生长的二级Ratkowsky 和Hyperbola 模型的建立
在一级模型的基础上建立的二级模型,研究生长温度对一级模型参数的影响。利用Ratkowsky 模型,研究最大比生长速率与温度的关系,见(6)式
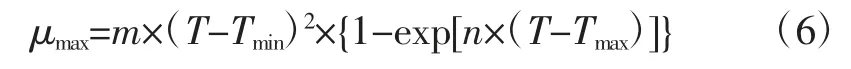
式中:μmax为在温度T 下的最大比生长速率,h-1;Tmin为ATCC27853 生长代谢活力为零时的最低温度,℃;Tmax为ATCC27853 生长代谢活力为零时的最高温度,℃;m、n 为常数,单位分别为℃-1h-0.5和℃-1。
基于Hyperbola 模型,将ATCC27853 迟滞时间λ取自然对数转化成ln(λ),研究迟滞时间和温度之间的关系,见(7)式

式中:λ 为ATCC27853 生长的迟滞时间,h;q 为微生物的最低生长温度,℃;p 为当生长温度大于最低生长温度时,迟滞时间减少所对应的温度的升高量,℃。
1.3.4 模型的评价及其验证
采用MATLAB 2016b 软件对试验数据分别进行Gompertz、Ratkowsky 和Hyperbola 模型的建立。模型的评价采用决定系数R2、均方根误差(root mean square error,RMSE)、准确因子Af和偏差因子Bf。其中,R2和RMSE 表示模型的精确度、可靠性,R2越接近于1,RMSE 越小,模型拟合度越高;Af用于衡量预测值与观测值之间的接近程度[24-25],Af越接近于1 模型的拟合越好,Af值越小,表明模型预测值与实测值越接近,模型越精确;Bf〉1 表示模型预测值比实测值高,当Bf〈1表示模型预测值比实测值低,Bf越接近1,模型拟合度也越高[26]。
模型的验证采用决定系数R2、准确因子Af和偏差因子Bf。一级模型的验证,在6、10、16、22、28、36、42、45、48℃的温度下生长,每个生长温度取不同于模型建立的时间点进行取样验证。二级模型的验证,设置不同的生长温度12、19、25、39、44℃进行取样验证,每次试验重复3 次;相关计算见(8)、(9)和(10)式
式中:n 表示测定值的个数。
2 结果和分析
2.1 铜绿假单胞菌ATCC27853在不同温度下生长的一级Gompertz模型的建立
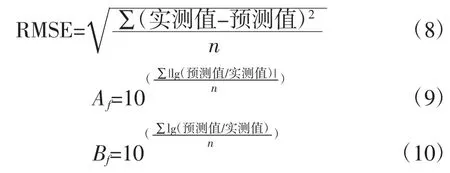
ATCC27853 在6、10、16、22、28、36、42、45、48℃下生长的Gompertz 模型曲线和50℃的失活情况见图1。
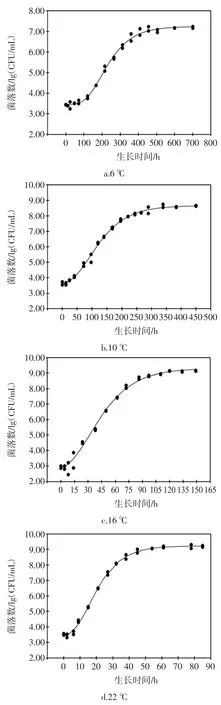
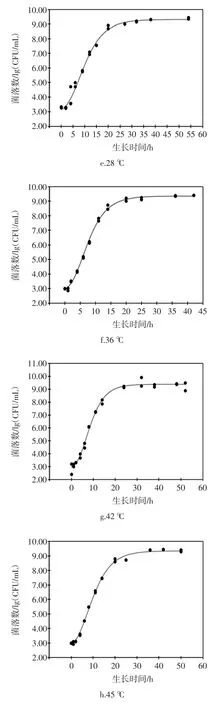
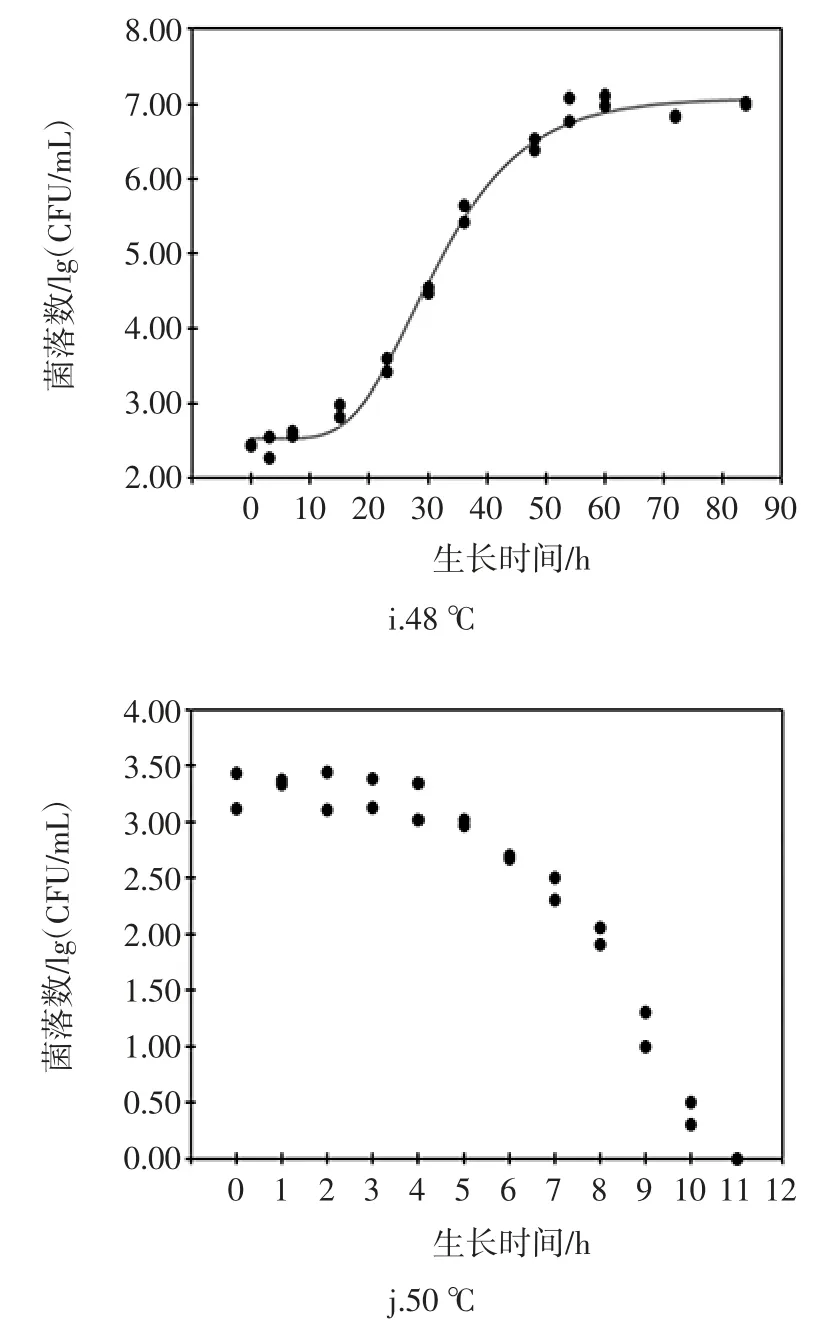
图1 铜绿假单胞菌ATCC27853 在6、10、16、22、28、36、42、45、48℃下生长的Gompertz 一级模型曲线以及50℃的失活情况Fig.1 Growth curves of Gompertz primary model for P.aeruginosa ATCC27853 under the temperatures of 6,10,16,22,28,36,42,45,48℃and inactivation at 50℃
由图1可以看出,除50℃外,其余温度的实测值皆比较均匀地分布于预测生长曲线的两侧,说明利用Gompertz 模型能较好地拟合ATCC27853 从6℃~48℃的生长曲线,从低到高这9个温度下ATCC27853 的生长曲线基本均呈现“S”型,有迟滞期、对数期、稳定期三部分。对于迟滞期,在低温度下,迟滞期较为明显,如,在10℃下,迟滞时间约为30 h,当生长温度超过28℃后,迟滞期就变得很短,如,在28、36、42℃下仅用2个多小时就能进入对数生长期,菌体能很快适应新的环境;进入对数期后,不同生长温度的对数期差异显著(P〈0.05),如6℃的对数期约400 h,而36℃的只需约10 h,表明ATCC27853 在不同温度下的生长速度不同;进入稳定期后,在10℃~42℃下,菌体最大生长量为9.22 lg(CFU/mL)~9.39 lg(CFU/mL),差异不显著(P 〉0.05);在6、45、48℃下的菌体最大生长量显著降低(P〈0.05)。ATCC27853 在50℃随着时间的延长,菌数在降低,11 h 后,检测不到菌体数,说明ATCC27853在50℃下不生长,已经失活。综上看来,生长温度是ATCC27853 生长繁殖的关键因素。
ATCC27853 从6℃到48℃下9个生长温度的Gompertz 模型的初始浓度(initial bacteria counts,IBC)a、最大菌落数(maximum bacteria counts,MBC)b、最大生长速率(maximum growth rate,MGR)c、拐点(turning point,TP)d、最大比生长速率(maximum specific growth rate,MSGR)μmax、迟滞时间(lag phase duration,LPD)λ和生理状态参数(physiological state parameter,PSP)h0等参数的估计值见表1。
由表1可以看出,9个温度下,菌体初始浓度a 在2.53 lg(CFU/mL)~3.53 lg(CFU/mL)之间,彼此相差小于1个lg(CFU/mL)。在16℃~45℃下生长,ATCC27853菌体生长最大浓度均可达到109(CFU/mL),表明在16℃~45℃,ATCC27853 生长所能达到最大浓度并不随温度的变化而变化。当温度为6、10、48℃时,ATCC27853 生长最大浓度分别为7.24、8.68、7.09 lg(CFU/mL),与16℃~45℃相比,差异显著(P〈0.05),菌体的生长受到明显的抑制。从6℃到48℃,最大生长速率c 随温度的增大先增大后减小,36℃时c 值最大;拐点d 随温度的增大呈先下降再上升的趋势,从197.57 h 减小到5.95 h 再增大到27.42 h,36℃时d 值最小。
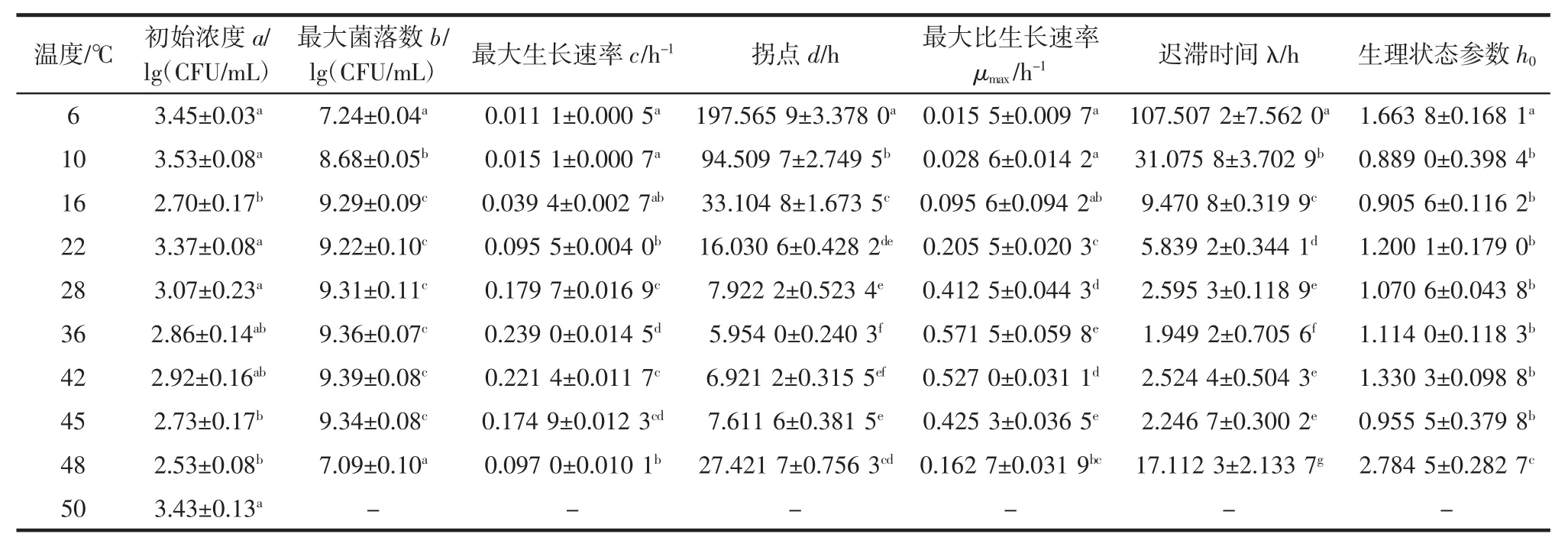
表1 铜绿假单胞菌ATCC27853在不同温度下生长的Gompertz 一级模型参数值Table 1 The estimated vales for parameters in the growth curves of Gompertz primary model for P.aeruginosa ATCC27853 under the different temperatures
在6℃~36℃的生长温度范围内,μmax由0.015 5增长到0.571 5,因为随着温度的升高,ATCC27853 的代谢反应及生长速率在加快,最适生长温度36℃也是该菌生长速率最高的温度;当生长温度为48℃时,生长速率显著降低到0.162 7(P 〈 0.05),生长温度上升到50℃时,可能是因为ATCC27853 体内的核酸、蛋白质、细胞膜等热敏感性大分子物质在高温下发生变性,细胞的生理代谢功能急剧下降,菌体死亡;对应的迟滞期也发生相应的变化,从107.51 h 降到1.95 h,之后又升到17.11 h,ATCC27853 在最适生长温度36℃时,迟滞期最短。在食品储藏期间,一旦由微生物引起腐败变质,微生物的迟滞期与其货架期有关,迟滞期越长货架期越长,在较低温和较高温的情况下,迟滞期较长,会延长食品的货价期。h0代表ATCC27853 细胞的生理状态参数,描述细胞适应新环境的能力,生理状态参数h0越高,细胞适应环境的能力越弱,由表1可以看出温度为6℃和48℃时的生理状态参数h0比较高,10℃~45℃时,生理状态参数基本保持不变,差异不显著(P〉0.05)。此外,50℃与6℃~48℃菌体的初始浓度基本相同,50℃下,随着培养时间的延长,ATCC27853 菌体细胞不能忍受此高温,其数量呈下降趋势,并于11 h 后检测不到菌体数,表明ATCC27853菌体死亡。
2.2 铜绿假单胞菌ATCC27853在不同温度下一级Gompertz生长模型的评价
ATCC27853 在不同温度下生长的一级Gompertz拟合模型的评价结果见表2。
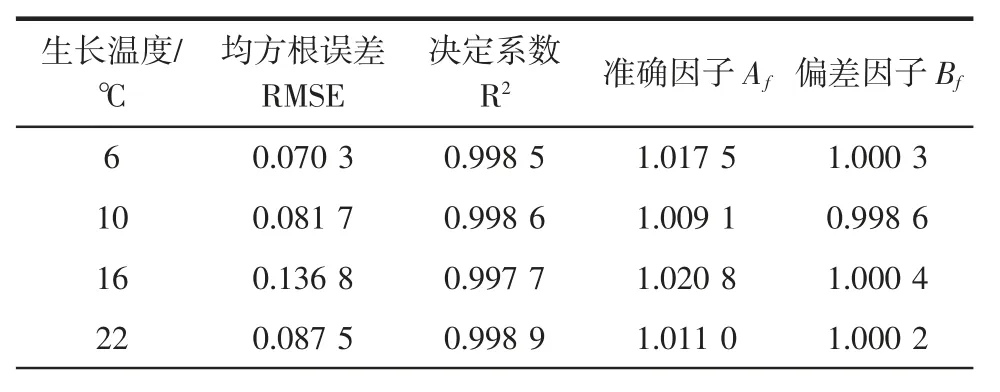
表2 铜绿假单胞菌ATCC27853 不同温度下生长的Gompertz 拟合模型的评价结果Table 2 Fitting evaluation of Gompertz model for P.aeruginosa ATCC27853 growth under different temperatures
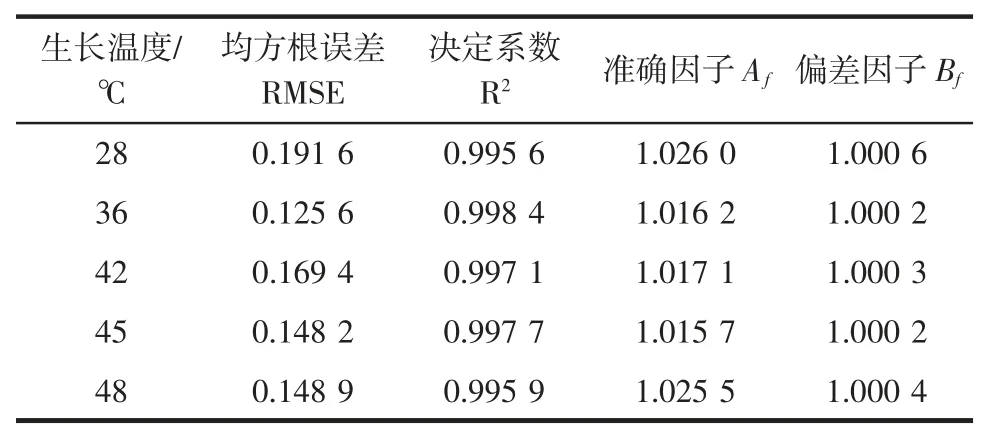
续表2 铜绿假单胞菌ATCC27853 不同温度下生长的Gompertz拟合模型的评价结果Continue table 2 Fitting evaluation of Gompertz model for P.aeruginosa ATCC27853 growth under different temperatures
由表2可知,在6℃~48℃,模型的RMSE≤0.191 6,R2≥0.9956,说明模型拟合效果较好。本研究中Af和Bf皆比较接近于1,也表明该模型的拟合度好,ATCC27853 的一级Gompertz 生长模型的预测值与实测值之间偏差很小,没有系统偏差,不会产生“failsafe”的情况。Ross 等[27]研究认为,Bf在0.90~1.05 的范围内,模型拟合好;Bf在0.70~0.90 与1.06~1.15 之间模型拟合效果可以接受;Bf〈0.70 或Bf〉1.15,存在系统偏差,模型拟合不可接受。综上分析,本研究建立的一级Gompertz 模型能很好的预测ATCC27853 从6℃到48℃温度下的生长,拟合效果好,且有效、可靠。
2.3 铜绿假单胞菌ATCC27853一级Gompertz生长模型的验证
ATCC27853 在不同温度下生长的一级Gompertz拟合模型的验证结果见表3。
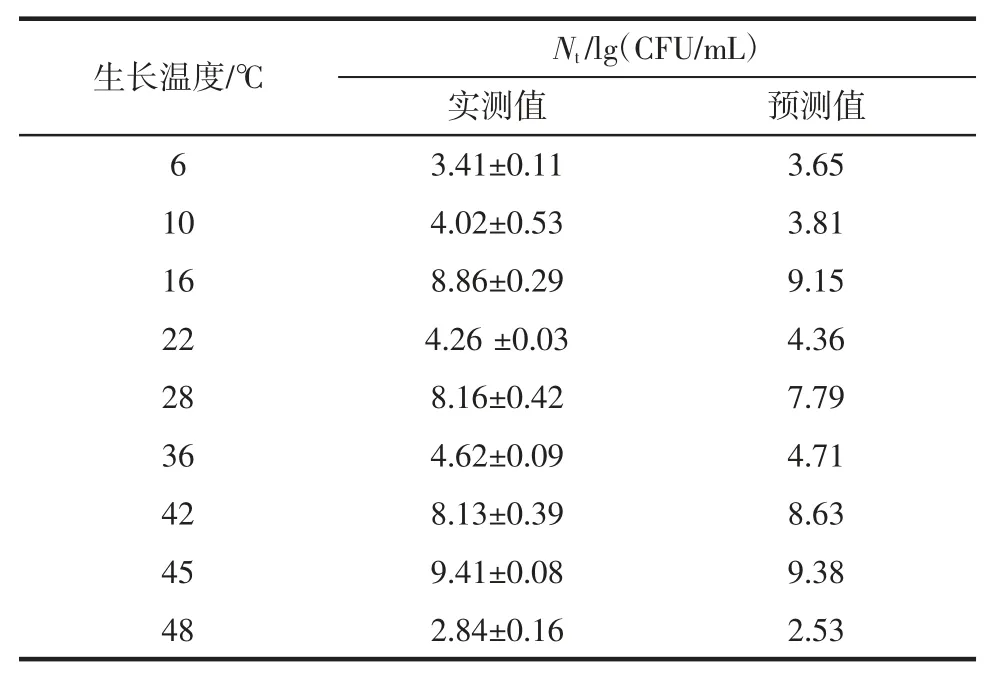
表3 铜绿假单胞菌ATCC27853Gompertz 模型的验证Table 3 Validation of the Gompertz model for P.aeruginosa ATCC27853
利用Matlab 软件对表3中实测值及一级模型的预测值进行相关性分析,决定系数R2=0.989 0,Af=1.047 9,Bf=0.998 2,也表明Gompertz 模型的合适性及有效性,可以利用Gompertz 模型对ATCC27853 生长进行预测。
2.4 铜绿假单胞菌ATCC27853二级模型的建立
为了进一步了解温度对ATCC27853 生长速率的影响,基于2.1 节建立的一级Gompertz 模型,利用Ratkowsky 模型来研究生长温度对最大比生长速率μmax的影响,见图2。
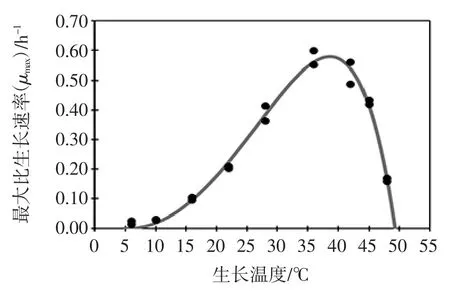
图2 铜绿假单胞菌ATCC27853 生长温度对最大比生长速率的影响Fig.2 The effect of the growth temperatures on maximum specific growth rate for P.aeruginosa ATCC27853
由图2可知,随着温度的升高,ATCC27853 的μmax逐渐增加,直至最适生长温度36℃,当温度超过36℃后,μmax开始下降,直至为零。微生物生长的迟滞期是指微生物接种到新鲜培养液后,要适应新环境,一时还缺乏分解或催化有关底物的酶或者足够的中间代谢物,其细胞数目不会发生变化,不过在不同的生长温度下这个适应期是不相同的。本研究中,ATCC27853的迟滞时间为λ,λ 的自然对数ln(λ)与温度之间的关系见图3。
由图3可知,ATCC27853 随生长温度的升高,迟滞期λ 逐渐减小,ln(λ)降低,说明随着生长温度的升高,ATCC27853 细胞的代谢系统适应温度变化的时间在变短。但是,当温度升到48℃后,迟滞期显著增大(P〈0.05),Hyperbola 模型不再适宜拟合生长温度与ln(λ)的关系。
ATCC27853 二级模型的参数的估计值见表4。
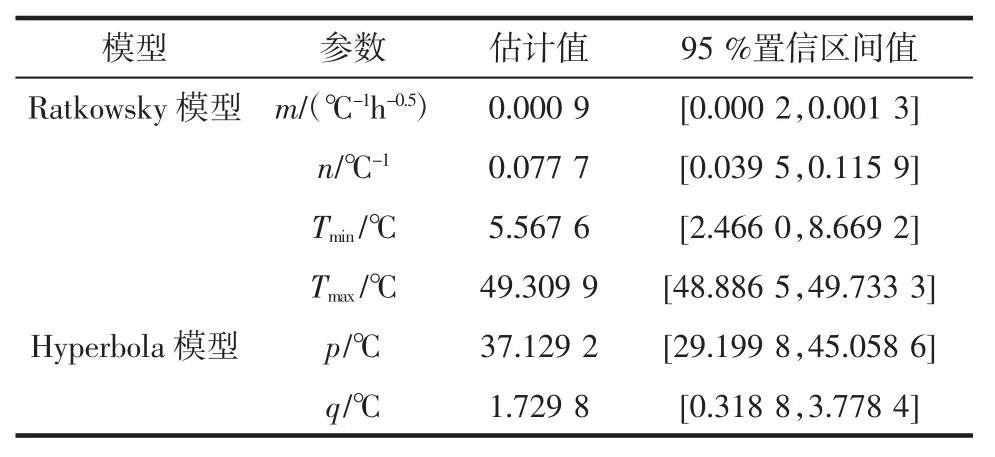
表4 二级模型参数的估计值和95%置信区间值Table 4 Estimates and 95%confidence level of parameters for the secondary models
ATCC27853 最大比生长速率Ratkowsky 模型的参数表明,理论上其最低生长温度Tmin为5.6℃;最高生长温度Tmax为49.3℃,本研究所建立的具有最低生长温度和最高生长温度的ATCC27853 的生长速率模型,为其在食品中的安全控制提供理论依据。ATCC27853迟滞期的Hyperbola 模型中,q 为1.7℃,是ATCC27853生长最低温度;参数Tmin和q 皆表示理论最低生长温度,试验表明ATCC27853 在4℃下基本不生长(试验数据未显示),Ratkowsky 模型中最低温度的理论值与实际值更接近,同时利用Hyperbola 模型能够快速地预测食品的安全储存时间,确定其货架期。
2.5 铜绿假单胞菌ATCC27853二级模型的评价
ATCC27853 在不同温度下生长的Ratkowsky 和Hyperbola 二级模型的评价结果见表5。
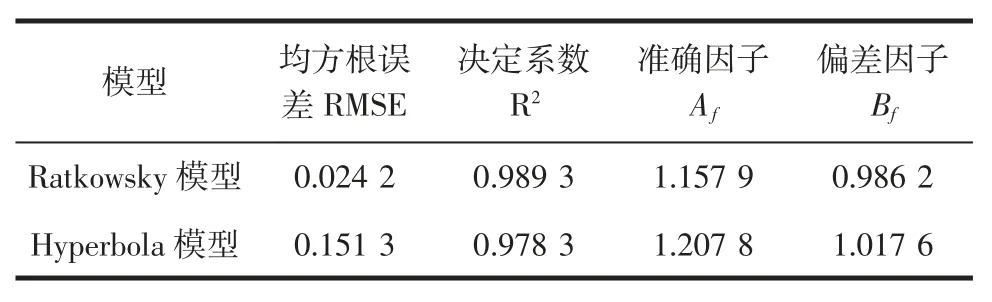
表5 二级模型拟合结果的评价Table 5 Fitting evaluation of the secondary models
由表5可知,RMSE≤0.151 3,R2≥0.978 3,1.157 9≤Af≤1.207 8,0.986 2 ≤Bf≤1.017 6,R2、Af和Bf皆接近于1,可以说明二级模型拟合度较好。
2.6 铜绿假单胞菌ATCC27853二级模型的验证
ATCC27853 在不同温度下生长的二级模型的验证结果见表6。
利用Matlab 软件将试验所得最大比生长速率的实测值与Ratkowsky 模型的预测值进行相关性分析,决定系数R2=0.995 2,Af=1.090 4,Bf=0.966 4;迟滞时间自然对数的实测值与Hyperbola 模型预测值的相关性分析,R2=0.975 9,Af=1.077 7,Bf=0.997 0。表明本研究所建立的Ratkowsky 和Hyperbola 二级模型是有效和可靠的。
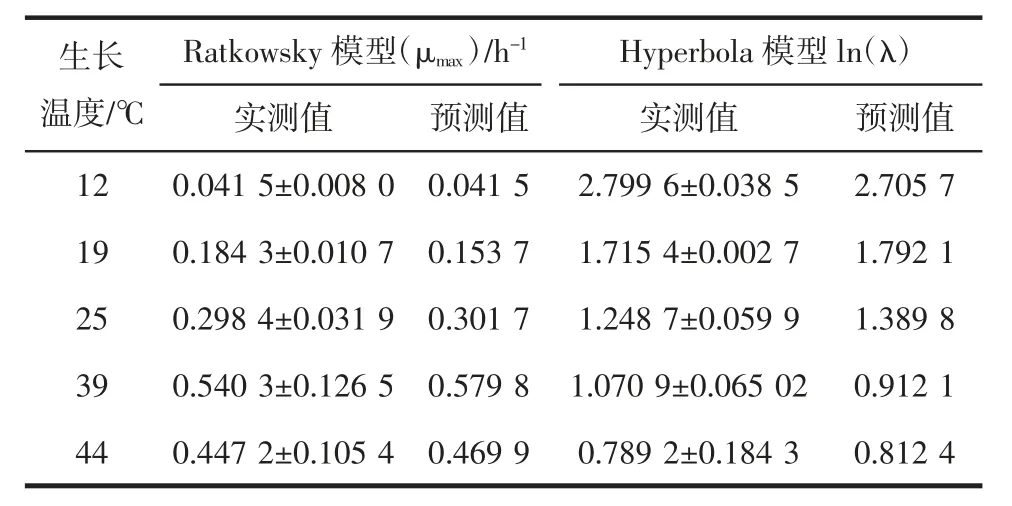
表6 铜绿假单胞菌ATCC27853二级模型的验证结果Table 6 Validation of the secondary models for P.aeruginosa ATCC27853
3 讨论
铜绿假单胞菌ATCC27853 是一种条件性致病菌,极易污染食品。本研究建立了从6℃到48℃下ATCC27853 生长的一级和二级模型,发现ATCC27853能在6℃低温下生长,最高生长温度为48℃;研究了温度对ATCC27853 生长的影响及其预测,为其在食品中的安全控制奠定理论依据。
本研究首先利用 Gompertz 模型建立了ATCC27853 的一级生长模型,基于一级生长模型的参数,再结合Ratkowsky 与Hyperbola 模型分别建立了ATCC27853 的最大比生长速率μmax、迟滞时间λ 与生长温度之间的二级模型。本研究发现Ratkowsky 与Hyperbola 模型能分别较好地建立ATCC27853 生长温度与最大比生长速率、生长温度与迟滞时间的关系。
由参数h0可以确定ATCC27853 的生理状态[25]。Baranyi 和Roberts 等[28]、Gospavic 等[23]和Velugoti 等[29]研究认为不同温度下菌体细胞的生理状态参数基本保持恒定。Mellefont 等[30]在研究生长温度对大肠杆菌和克雷伯氏菌的影响时,发现生理状态参数h0不是恒定不变的,温度的变化还会影响迟滞期;Delignette-Muller 等[31]研究发现,单增李斯特氏菌接种前的培养温度与接种后的生长温度的变化幅度与h0有一定的相关性;Xanthiakos 等[25]研究了1.5℃~16℃下单增李斯特菌的生长,发现在1.5℃~8℃下生理状态参数h0明显高于在8℃~16℃生长的h0。
在ATCC27853 的初始菌浓度基本相同的情况下,本研究发现在10℃~45℃的范围内,生理状态参数h0基本保持恒定,随温度变化,h0变化不显著(P〉0.05),这与Gospavic 等[23]的研究结果相一致;但在6℃时,h0明显高于10℃~45℃的h0,此结果与Xanthiakos[25]的研究结果相一致,原因可能是低温6℃限制了菌体细胞内核酸、蛋白质和细胞膜等大分子物质的合成。
Baranyi 和Roberts[28]的研究认为h0=μmax× λ,α0=exp(-h0)。当ATCC27853 的生长温度10℃时,h0=0.889 0,则 α0=41.1%,表明在此温度下,ATCC27853菌体细胞的生长速率为最大比生长速率的41.1%;在10℃~45℃时 α0的平均值约为34.8%,6、48℃时 α0分别为18.9%和6.2%,可以看出6、48℃的α0明显低于10℃~45℃,生长温度为6℃和48℃比生长速率明显较低,推测可能是ATCC27853 接种前的培养温度(36℃)与接种后的生长温度(6、48℃)之间存在较大的差异导致生理状态较大的改变,生长温度对生理状态的影响为预测微生物生长研究提供重要的理论依据。
4 结论
本研究采用Gompertz 模型建立了6℃~48℃下铜绿假单胞菌ATCC27853 的一级生长模型,结合Ratkowsky 与Hyperbola 模型分别建立了ATCC27853的生长温度对其μmax和λ 影响的二级模型;用决定系数R2、均方根误差RMSE、准确因子Af和偏差因子Bf评价模型拟合优度并验证了模型的有效性和可靠性,结果表明用Gompertz、Ratkowsky 与Hyperbola 模型建立的一级生长模型和二级模型拟合度高;ATCC27853的生长温度对生理状态参数h0的影响表明接种前的培养温度(36℃)与被接种后的生长温度(6℃及48℃)之间存在较大的差异会导致生理状态参数发生较大的改变。ATCC27853 的生长温度对 μmax、λ 和h0影响的预测模型的建立,为其在食品中的安全控制提供理论依据。

