单核细胞增生李斯特菌新型转录调控因子Lmo2672分子特征及其系统进化分析
李 杰,孟庆玲,乔 军,张星星,王晓婷,李 妍,张国武,蔡扩军,才学鹏
(1. 石河子大学动物科技学院,石河子 832003; 2. 新疆农垦科学院 绵羊遗传改良与健康养殖省部共建国家重点实验室,石河子 832000;3. 乌鲁木齐市动物疾病控制与诊断中心,乌鲁木齐 830063;4. 中国农业科学院兰州兽医研究所,兰州 730046)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种重要的食源性人兽共患病原菌,该菌可在高盐、低温、酸碱等多种复杂环境下生长繁殖,有较强的环境适应性[1]。LM可通过消化道进入体内,入侵宿主机体后可在吞噬细胞和非吞噬细胞内存活并大量增殖,并能穿越肠道屏障、血胎屏障、血脑屏障能引起肠胃炎、脑膜炎和流产等[2-3]。新生儿、孕妇、老年人以及免疫功能缺陷者易通过动物源性食品感染LM,致死率高达20%~30%[4-6],因此世界卫生组织(world health organization,WHO)将LM列为仅次于大肠杆菌O157、沙门氏菌、志贺氏菌之后的第四大食源性致病菌,也是必检的食源性致病菌之一[7-8]。
作为一种兼性胞内寄生的革兰氏阳性菌,LM可以依赖其特有的表面蛋白侵入宿主非吞噬细胞,进而突破宿主肠道屏障、血胎屏障和血脑屏障,其感染的过程受多种因素的调控[7]。有研究发现,AraC家族转录调节蛋白在不同病原微生物中均发挥着十分重要的作用,与细菌的多重耐药性、代谢反应、致病力等密切相关[9-13]。目前,李斯特菌AraC家族转录调节蛋白的功能尚不清楚。
Chatterjee等[14]通过李斯特菌强毒株和弱毒株的基因组DNA文库的比较鉴定显示,lmo2672属于一个新的致病基因;Toledo等[15]进一步研究表明,lmo2672基因属于AraC家族的转录调节因子,可调控LM多个基因的表达。然而,lmo2672具体的生物学功能尚不清楚。为了探究lmo2672基因的功能,本研究对单增李斯特菌绵羊分离株LM-SB5lmo2672基因进行克隆、编码蛋白分子特征和系统进化分析,为下一步探讨lmo2672基因在LM毒力和环境应激中的调控作用奠定了理论基础。
1 材料与方法
1.1 菌株、培养基及试剂 LM新疆野毒株SB5由本实验室从发病绵羊体内分离,鉴定后保存;大肠杆菌E. coliDH5α由本实验室保存。脑心浸液培养基(BHI)购自青岛高科技园海博生物技术有限公司;DL2000 DNA Marker、pMD19-T(simple)载体购自TaKaRa公司;细菌基因组DNA提取试剂盒、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒购自诺维森生物公司。
1.2 引物设计与合成 根据GenBank登录的lmo2672基因序列(登录号:CP019616.1)设计扩增lmo2672基因引物,由北京华大基因公司合成。上游引物lmo2672F:5'-GGAATTCATGGCTAAGCTA GAAAC-3'(下划线碱基为EcoRⅠ酶切位点),下游引物lmo2672R:5'-CCTCGAGTCATTGTAT ATTTGCGACA-3'(下划线碱基为XhoⅠ酶切位点)。
1.3 LMlmo2672基因的克隆及测序 挑取LM野毒株SB5单菌落于BHI培养基中,置于37℃温箱培养15 h,按照细菌基因组DNA提取试剂盒的说明书提取LM分离株SB5基因组DNA。PCR的反应体系:ddH2O 9 μL,PCR Mix 8 μL,上下游引物各0.5 μL,DNA模板2 μL。反应条件:95℃预变性5 min;94℃变性40 s,57℃退火1 min,72℃延伸50 s,30个循环;72℃延伸10 min,4℃保存。将目的片段用琼脂糖凝胶DNA回收试剂盒纯化回收,纯化后的PCR产物与pMD19-T(simple)载体过夜连接,然后转化DH5α感受态细胞,通过菌液PCR进一步筛选,将阳性克隆送至华大基因生物公司测序。
1.4lmo2672基因编码蛋白质的生物信息学分析利用ProtParam在线软件(http://web.expasy.org/protparam/)计算蛋白质的理论分子质量、理论等电点;通过Protscale(http://web.expasy.org/protscale/)分析蛋白质的亲水性与疏水性;利用PrositeScan(https://prosite.expasy.org/prosite.html)分析蛋白的结构域;通过SignalP(http://www.cbs.dtu.dk/services/SignalP/)进行蛋白质的信号肽预测;利用DNAStar软件预测Lmo2672蛋白的二级结构,应用SWISS-MODEL(http://www.swissmodel.expasy.org/)预测蛋白质的三级结构。
1.5lmo2672基因核苷酸序列系统进化分析 将LM野毒株SB5lmo2672基因与GenBank已知的LM不同菌株及其他种属细菌的AraC家族转录调节基因核苷酸序列进行对比,应用MEGA5.0软件对lmo2672基因核苷酸序列进行遗传进化分析,并采用邻接法(Neighbor-Joining,NJ)构建系统进化树。
2 结果
2.1lmo2672基因的扩增、克隆及测序 用lmo2672F/lmo2672R引物扩增lmo2672基因,产物经1%琼脂糖凝胶电泳检测得到约807 bp的目的条带(图1A)。PCR产物与pMD19-T(simple)载体连接,转化至DH5α后通过菌液PCR筛选阳性克隆pMD19-T-lmo2672(图1B),对阳性克隆进行测序分析,结果显示,该基因与GenBank中预期的LMlmo2672基因片段大小一致。
2.2lmo2672基因核苷酸及编码氨基酸序列分析 测序结果显示,LM野毒株SB5lmo2672基因全长807 bp,编码268 aa;通过Motif Scan (https://myhits.isb-sib.ch/cgi-bin/motif_scan)在线软件分析发现含1个cAMP和cGMP依赖性蛋白激酶磷酸化位点(246~249 aa),5个酪蛋白激酶II磷酸化位点(83~86 aa,87~90 aa,139~142 aa,146~149 aa,252~255 aa),1个N端酰基化位点(226 aa~231 aa)和3个蛋白激酶C磷酸化位点(13~15 aa,186~188 aa,205~207 aa);1个DNA结合域(185~259 aa),2个由螺旋-转角-螺旋构成的HTH结构域(184~198 aa,226~249 aa)(图2)。
2.3lmo2672基因的理化特性分析 利用ExPASY在线软件中ProtParam工具分析LM野毒株SB5的lmo2672基因编码蛋白的理化性质,该蛋白分子式为C1396H2151N357O396S11,理论分子量为30.62 kDa,理论等电点为5.47,原子总数:4311。不稳定指数为30.79,所以该蛋白为稳定蛋白。带负电荷的残基总数为33个,带正电荷的残基总数为27个;脂溶指数为87.72,总疏水性平均数为-0.133。ProtScale 在线工具进一步预测表明,Lmo2672氨基酸序列中疏水最大值为2.244,最小值为-2.589,大部分氨基酸属于亲水性氨基酸,可见该蛋白属于亲水性蛋白,易溶于水。
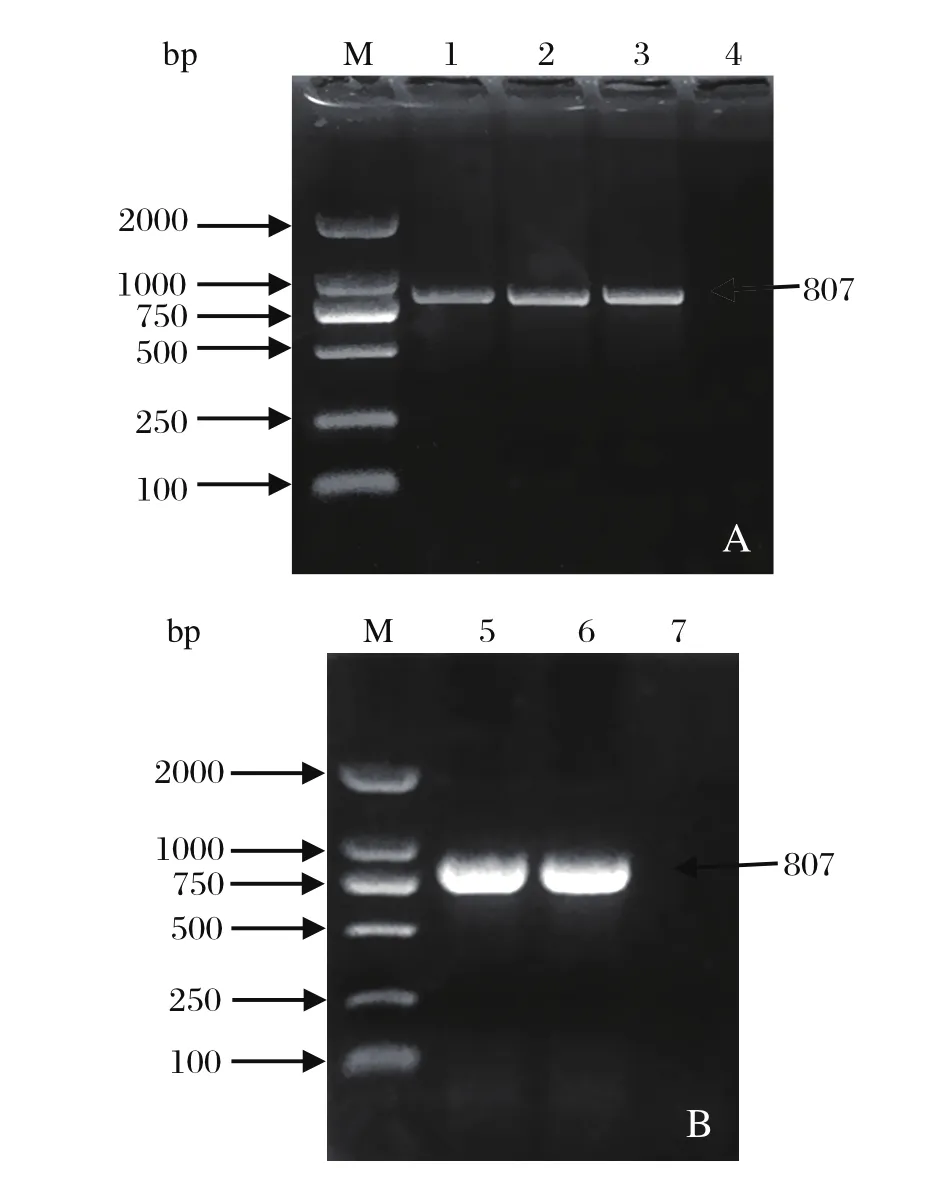
图1 lmo2672基因的PCR扩增结果(A)及pMD19-T-lmo2672菌液PCR验证(B)Fig.1 lmo2672 gene amplified by PCR(A) and pMD19-T-lmo2672 identificated by bacterial PCR(B)
2.4 Lmo2672蛋白分子结构特征分析 DNAStar软件分析发现,该蛋白由5个α-螺旋、6个β-折叠、4个β-转角和无规则卷曲组成。TMHMM 2.0 Server分析显示,Lmo2672蛋白不存在跨膜结构。SignalP 4.1 Server分析发现,该蛋白无信号肽序列,属于非分泌性蛋白;SWISS-MODEL分析平台预测该蛋白的三级结构(图3),用NCBI预测了Lmo2672蛋白的螺旋-转角-螺旋(helix-turn helix)结构域(图4)。与肺炎克雷伯菌和肠球菌AraC家族转录调控因子相比,三者在其C端均具有2个H-T-H超二级结构域,LM Lmo2672在N端还具有一个HTH-11结构域(图5),提示不同的细菌AraC家族转录调节蛋白存在一定的差异。

图2 lmo2672基因核苷酸序列及其编码氨基酸序列Fig. 2 Nucleotide sequences and amino acid sequences of lmo2672

图3 Lmo2672蛋白的三级结构Fig.3 Predicted the 3D structure of Lmo2672
图4 Lmo2672蛋白的螺旋-转角-螺旋结构域Fig.4 Predicted the Helix-turn-helix domain of Lmo2672
2.5lmo2672基因序列的系统进化分析 将克隆测序所得LM野毒株SB5lmo2672核苷酸序列与GenBank上公布的不同来源的lmo2672核苷酸序列以及同为AraC家族的不同基因的菌株进行同源性比对。结果显示:LM野毒株SB5的lmo2672核苷酸序列(下划线)与李斯特谱系II型菌株亲缘性关系较近,其中与NTSN株(4b型,绵羊脑,中国扬州)的同源性为99.63%,与SLCC2378株(4e型,德国)、CIIMS L2株(印度,血液)、81-0592株(4b型,加拿大,胎血)、02-1792株(4b型,加拿大,奶酪)、F2365株(4b型,奶酪,美国)的同源性均为99.75%,与J1-220株(4b型,临床)、H34株(1/2b型,乌拉圭,血液)、LI0521株(美国,临床)同源性均为99.26%。而与谱系I型菌株国际标准株EGD-e株(1/2a型,美国)、10-5024株(1/2a型,加拿大,食物)、10-5025株(1/2c型,加拿大,培根片)亲缘性关系较远,其核苷酸同源性为97.52%~97.77%。肺炎克雷伯菌RarA基因和肠球菌ECBG-00297基因均为AraC家族转录调节基因,两者位于同一分支,亲缘关系较近,但与LM转录调节基因lmo2672的亲缘关系较远(图6)。

图5 LM Lmo2672的H-T-H结构域模式图Fig.5 H-T-H domains pattern of Lmo2672 protein of LM
3 讨论
LM是一种重要的食源性人兽共患菌,可进入宿主细胞并通过破坏液泡膜进入宿主细胞胞质的胞内寄生菌之一[12]。目前有研究发现,AraC家族转录调节蛋白在不同病原微生物中发挥着十分重要的作用,AraC家族转录调节蛋白的特征是其结构中都含有序列保守的AraC DNA结合结构域,位于该蛋白的C端,一般由99个氨基酸组成[16-17]。不同的AraC家族转录调节蛋白DNA结合结构域以外的可变结构域序列差异比较大,提示不同的AraC家族转录调节蛋白功能可能存在差异。在肺炎克雷伯菌中,AraC家族转录调节蛋白RarA可通过调节主动外排泵的表达而导致肺炎克雷伯菌产生多重耐药性[9]。在枯草芽孢杆菌中,AraC家族转录调节蛋白Prkc通过磷酸化代谢途径中的蛋白来调节枯草芽孢杆菌的代谢[10]。在霍乱弧菌中,AraC家族转录调节蛋白ToxT通过激活霍乱毒素和毒素协同调节菌毛的表达而增强霍乱弧菌的致病力[11],在肠球菌中,AraC家族转录影响蛋白生物膜的形成来调节毒力[18]。
Lmo2672是LM基因组中发现的一种AraC家族转录调节因子编码基因[12]。有研究发现,lmo2672在不同的培养基和不同培养环境中表达量差异显著[15],然而其生物学功能尚不清楚。本试验采用PCR方法从LM野毒株SB5克隆lmo2672基因,经测序和序列比对后获得lmo2672全长序列807 bp,共编码268个氨基酸,氨基酸序列总疏水性平均数为-0.133,可见该蛋白属于亲水性蛋白。在蛋白结构预测中发现,无信号肽序列及跨膜结构,说明属于非分泌性蛋白。该蛋白以α-螺旋为主(占55.02%),含有螺旋-转角-螺旋结构域,由两个α螺旋间隔以一定角度的转角构成的结构域,其中一个α螺旋可插入DNA大沟中与专一DNA序列结合,发挥调控作用[19]。
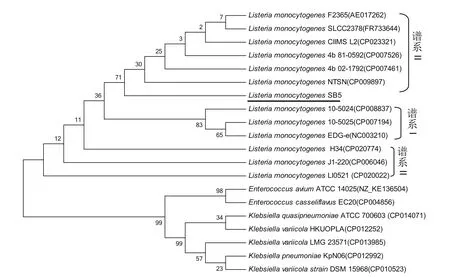
图6 lmo2672基因核苷酸序列系统进化关系Fig.6 Phylogenetic tree of based on LM lmo2672 gene
同源性分析显示,lmo2672核苷酸序列与国际标准株EGD-e株(1/2a 型,美国)同源性为97.77%,与中国扬州绵羊源4b型LM NTSN株同源性99.63%,提示新疆绵羊源LM野毒株SB5与中国扬州绵羊源NTSN株亲缘关系较近。系统进化树显示,LM野毒株SB5的lmo2672核苷酸序列与李斯特谱系II型菌株亲缘性关系较近;而与谱系I型菌株(EGD-e株)形成另外一分支,亲缘性关系较远,提示lmo2672基因可能在不同谱系李斯特菌中有一定差异;同时,与其他菌株的AraC家族转录调节蛋白亲缘性较远,提示不同菌株的AraC家族转录调节蛋白功能可能存在较大差异。
本研究首次克隆了绵羊源LM野毒株SB5转录调控因子lmo2672基因,并利用生物学软件对其分子结构特征进行分析,证实Lmo2672蛋白含有螺旋-转角-螺旋结构域,推测其可与LM某些基因的顺式作用元件DNA序列结合,从而发挥基因表达调控作用,为进一步研究该蛋白在LM中的调控作用及其机制提供了理论基础。

