家兔肠炎沙门氏菌病流行病学调查及防控
郭 帅,范志宇,王 芳,朱伟峰,仇汝龙,魏后军,胡 波,宋艳华,陈萌萌,徐为中
(江苏省农业科学院兽医研究所 农业部动物疫病诊断与免疫重点开放实验室 国家兽用生物制品工程技术研究中心,南京 210014)
沙门氏菌病是由不同种沙门氏菌引起不同宿主疾病的总称,可以诱发动物的伤寒、副伤寒、腹泻、流产等疾病以及人的腹泻、伤寒、败血症、食物中毒、副伤寒等[1]。沙门氏菌属于肠道杆菌,在人畜公共卫生方面具有十分重要的意义[2-3]。根据调查显示,全世界范围内的食物中毒病例中以沙门氏菌为诱因的占据前而位[4-6]。在我国由于加工食品携带沙门氏菌而引起食物中毒的病例占首位[7-10]。沙门氏菌病被发现至今,主要依靠抗生素类药物治疗和预防,尤其是20世纪中期,抗生素被大量滥用,耐药菌株不断出现,已经成为全世界亟待解决的公共卫生问题之一。目前,针对禽源和人源沙门氏菌的研究较多,对于家兔沙门氏菌病的研究与报道相对较少。我国是兔肉生产与出口的第一大国,家兔沙门氏菌病的发生和流行,不仅会带来严重的公共卫生安全问题,也会给家兔产业带来巨大的经济损失。
2016年2~5月,山东某兔场发生肠炎沙门氏菌病[11]。2017年2月份开始,该兔场又出现母兔发生流产、死亡,新生仔兔、幼兔死亡的临床现象,剖检以脾脏肿大为特征病变,使用多种药物都未起到明显效果。基于此疫情,我们对该兔场和周边兔场进行了流行病学调查并制备了疫苗进行预防接种。结果显示:通过对大量样本检测,我们筛选出一套快速、准确的兔肠炎沙门氏菌检测法;分离菌株为ST.11序列型,存在较强的耐药性;疫苗免疫可以较好地防控肠炎沙门氏菌病再次发生。本研究为肠炎沙门氏菌病的临床诊断和流行病学调查提供了有效方法,为肠炎沙门氏菌病的防控提供了实用性方案。
1 材料与方法
1.1 样本 山东某兔场(甲兔场)繁殖母兔的新鲜粪便和乳汁、流产死胎、兔舍环境样本、饲料、水源;分兔场(乙兔场)繁殖母兔的新鲜粪便、流产死胎;山东省其他兔场(丙兔场)繁殖母兔的新鲜粪便。
1.2 培养基与主要试剂 改良马丁肉汤培养基、0.1%无菌蛋白胨水溶液(BPW)、胆硫乳琼脂(DHL)、三糖铁琼脂、四硫磺酸盐煌绿增菌液基础(TTB)、亚硫酸铋琼脂(BS)、氯化镁孔雀绿肉汤(MM)和亚硒酸盐胱氨酸增菌液(SC)均购自青岛高科园海博生物科技有限公司,抗菌药物药敏纸片、细菌微量生化反应管购自杭州微生物试剂有限公司,Taq酶购自TaKaRa公司,细菌基因组DNA提取试剂盒购自TIANGEN公司,其余试剂均为国产分析纯。
1.3 引物 引物均由南京擎科生物科技有限公司合成。
1.3.1 肠炎沙门氏菌特异性引物 Usef A-F:5'-ATG CGTAAATCAGCATCTG-3';Lsef A-R:5'-TTAGT TTTGATACTGCTGAAC-3'。
1.3.2 MLST分型反应引物[12]针对肠炎沙门氏菌的分型有7对特异性引物,包括hisD、aroC、hemD、sucA、dnaN、purE、thrA(表1)。

表1 用于MLST分型的引物Table 1 Primers used for MLST
1.4 临床调查和取样 询问发病兔场既往病史、发病情况、药物使用情况,对病死兔进行临床解剖、观察和取样,采集新鲜的粪便和乳汁;对兔场周边环境进行调查取样,包括兔笼、兔舍、周转箱、饲料、水源等。
1.5 沙门氏菌选择性培养[13]
1.5.1 预增菌 将无菌采集的样品接种于5 mL的BPW中,37℃培养18~24 h。
1.5.2 选择性增菌 从培养后的BPW中吸取500 μL,分别接种于TTB、MM、SC三种选择性增菌液中,增菌液各5 mL,MM与SC放置37℃培养18~24 h,TTB放置42℃ 培育18~24 h。
1.5.3 分离培养 用接种环将菌液分别划线接种于DHL平板和BS平板,DHL平板放置37℃培育22~24 h,BS平板放置37℃培育40~48 h,观察单菌落形态特征。
1.6 生化特性 根据国家检测标准《食品卫生微生物学检验-沙门氏菌检验》[14],用改良马丁肉汤对疑似沙门氏菌单菌落培养,并进行生化特性分析,分别接种于三糖铁琼脂斜面、硫化氢、靛基质、尿素、氰化钾、赖氨酸脱羧酶、甘露醇、ONPG等微量生化反应管,37℃ 培养24 h,观察并记录。
1.7 肠炎沙门氏菌特异性PCR鉴定与序列测定 对疑似沙门氏菌单菌落进行菌落PCR鉴定,以肠炎沙门氏菌作为阳性对照,以阴性菌株为阴性对照,以蒸馏水为空白对照。反应体系:2×Mix 10.0 μL,上下游引物各0.5 μL,挑取单菌落,加dd H2O至总体积20.0 μL。反应条件:95℃ 预变性4 min;95℃变性15 s,52℃ 退火30 s,72℃ 延伸40 s,30个循环,72℃ 延伸1 min。用1%的琼脂糖凝胶对PCR产物进行电泳鉴定,电压120V,时间30 min,用凝胶成像系统处理图像,切胶回收目的片段,送南京擎科生物科技有限公司测序。
1.8 MLST分型[15]对从甲兔场、乙兔场和丙兔场粪便分离的3株肠炎沙门氏菌进行MLST分型比较试验。提取细菌基因组DNA,用7个管家基因所对应的特异性引物进行PCR扩增,反应体系:Taq酶0.5 μL,10×PCR buffer 5.0 μL,dNTP 4.0 μL,上下游引物各1.0 μL,模板DNA 1.0 μL,加ddH2O至总体积50.0 μL。反应条件:94℃ 预变性4 min;94℃ 变性30 s,55℃ 退火30 s,72℃ 延伸1 min,30个循环,72℃ 延伸4 min。用1%的琼脂糖凝胶对PCR产物进行电泳鉴定,将鉴定为阳性的产物送往南京擎科生物科技有限公司进行测序,运用DNAMAN软件进行序列结果比对,分别将7对序列输入MLST数据库(https://pubmlst.org/bigsdb?db=pubmlst_mlst_seqdef&set_id=2&page=profiles&scheme_id=2),并对序列型进行分析。
1.9 药敏试验 分别取来自3个兔场分离的4株肠炎沙门氏菌培养物100 μL均匀涂布于马丁平板,选取14种药敏试纸片贴于平板内,37℃培养24 h。根据抑菌圈直径判断耐药性。抑菌圈直径大于15 mm为高度敏感;直径大于10 mm且小于15 mm为中度敏感;直径小于10 mm为不敏感或耐药。
1.10 疫苗免疫预防 针对甲兔场的发病情况,用分离菌在本实验室自制灭活疫苗,对兔场母兔进行一次免疫和两次免疫试验。一次免疫的母兔,免疫2 mL/只;两次免疫的母兔,首免2 mL/只,间隔2周进行二次免疫,1 mL/只。在首次免疫后1个月内,观察新生仔兔死亡率;每隔两周采取新鲜粪便进行肠炎沙门氏菌检测,并统计分析。
2 结果
2.1 临床调查和取样 山东某兔场(甲兔场)于2017年2月份开始发病,病情与2016年相似[11],以两幢兔舍(A舍、B舍)病情最为严重。11日龄新生仔兔死亡率突然升高;每幢兔舍约900只种兔,仔兔数量约7000余只,每日仔兔正常死亡数应在10只以内,突然升高至50只以上,严重时段达100只以上,使用阿奇霉素、安普霉素、替米考星等药物效果不明显;部分怀孕母兔出现流产、死亡现象,阴道黏膜红肿,有脓性分泌物流出,病理剖检以脾脏肿大为主,其他实质性器官未发现明显肉眼可见病变(图1)。

图1 临床症状Fig.1 Clinical symptoms
2.2 选择性培养研究 采集样品经预增菌后于选择性增菌液TTB、MM、SC中培养后,接DHL平板和BS平板培养,DHL平板上的阳性沙门氏菌菌落为无色半透明菌落,有黑色中心或几乎全部为黑色,有些菌株无黑色中心;BS平板上的阳性菌落呈棕褐色或灰色,有金属光泽,有些菌株形成灰绿色菌落。经分析比较,MM选择性增菌液的阳性检出率要明显低于TTB和SC(表2)。
2.3 生化特性 沙门氏菌分离菌生化试验检测结果显示,所有分离菌均符合肠炎沙门氏菌的生化特性(表3)。

表2 沙门氏菌检出率Table 2 Positive rates of Salmonella

表3 生化检测结果Table 3 Results of biochemical test
2.4 肠炎沙门氏菌特异性PCR鉴定 用肠炎沙门氏菌特异性引物对疑似沙门氏菌单菌落进行PCR扩增。结果显示,扩增出的基因片段大小为498 bp,与目的基因片段大小相同(图2),序列测定结果与目的序列一致,可以判定本次沙门氏菌病的病原体为肠炎沙门氏菌。

图2 菌落PCR结果Fig.2 Results of bacterial colony PCR
2.5 不同样品检测结果 兔场的粪便检测均有阳性,其中甲兔场的A舍粪便检出率相对较高,达到73.33%;乳汁中也检测到肠炎沙门氏菌的存在,流产死胎的阳性检出率100%,在兔舍环境样本、饲料和水源中未检测到肠炎沙门氏菌。

表4 不同种类样品肠炎沙门氏菌阳性率Table 4 Positive rates of Salmonella Enteritidis indifferent sorts of samples
2.6 MLST分型 对从甲兔场、乙兔场和丙兔场粪便分离的3株肠炎沙门氏菌进行MLST分型比较试验并进行分析。结果显示,甲兔场、乙兔场和丙兔场菌株为同一序列型,都是ST.11(图3、表5)。
2.7 药敏试验 对分离的4株肠炎沙门氏菌进行药敏试验。结果显示,分离菌株对青霉素、链霉素、氨苄西林、四环素和多西环素的耐药性最高,对头孢噻肟、丁胺卡那和氟苯尼考的敏感性最高。细菌多重耐药现象严重(表6)。

图3 MLST分型方法中7个看家基因的PCR结果Fig.3 PCR products of 7 housekeeping genes in MLSTM: DNA分子量标准(DL2000); A: 甲兔场菌株; B: 乙兔场菌株; C:丙兔场菌株. 泳道1~7, 8~14, 15~21对应的看家基因依次为hisD,aroC, hemD, sucA, dnaN, purE, thrAM: DNA Marker(DL2000); A: Warren A; B: Warren B; C: Warren C. Lane 1-7, 8-14, 15-21 corresponds to housekeeping genes are hisD, aroC, hemD, sucA, dnaN, purE, thrA, respectively
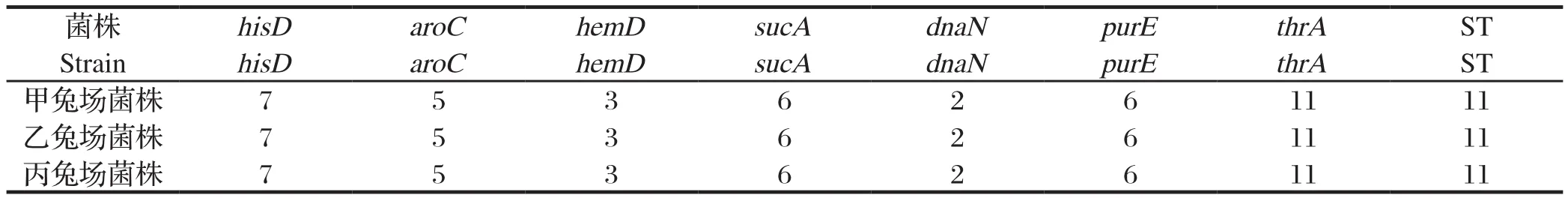
表5 MLST分型结果Table 5 Results of MLST

表6 药敏试验结果(单位:mm)Table 6 Results of drug susceptibility test (unit: mm)
2.8 疫苗免疫效果 经疫苗免疫后,甲兔场的病情得到有效控制。新生仔兔死亡率明显降低,肠炎沙门氏菌阳性检出率明显下降。两次免疫效果优于一次免疫效果(表7)。

表7 免疫前后肠炎沙门氏菌检出率Table 7 Detection rates of Salmonella Enteritidis pre- and post- immunization
3 讨论
通过对大量样品的检测与数据分析,本研究筛选出一套快速、准确的兔肠炎沙门氏菌实验室检测法。对3种选择性增菌液的阳性检出率进行比较,其中,TTB和SC选择性增菌液的阳性检出率相同,MM选择性增菌液的阳性检出率较低,与孔繁德[13]之前的研究报告基本相符。在后期大量样品检测试验中,我们淘汰了MM选择性增菌液,对选择性增菌液TTB和SC,我们同时使用或二者选其一,提高试验效率,结合相关生化试验和特异性菌落PCR鉴定,可以用于临床上大批量样品的检测,效果良好。利用优化后的方法对甲兔场、乙兔场和丙兔场进行流行病学调查,对分离菌株进行药敏试验和MLST分型比较。检测结果表明,不同兔场粪便阳性细菌检出率分别为73.33%、40.00%、30.30%、31.25%,说明家兔发病期间,普遍通过肠道途径向外排出病原;分离菌株呈现严重的多重耐药性,且不同兔场间的耐药情况差异明显,推测与各兔场抗生素使用的情况有关;3个兔场的沙门氏菌分离菌株经分型比较结果显示,菌株均为ST.11序列型,推测可能该类型菌有较强的传播能力,在当地呈地方性流行或者母兔来源于同一个种兔场;新鲜乳汁、死亡仔兔和死胎中也检测到肠炎沙门氏菌,说明肠炎沙门氏菌病可以通过胎盘垂直传播,在禽沙门氏菌病的传播途径中,通过蛋垂直传播为主。
沙门氏菌病属于人兽共患病,危害严重。由于多年来大规模使用抗生素治疗沙门氏菌病,沙门氏菌的耐药问题日益严重。因此,科学合理的预防尤为重要。本次发病兔场使用多种抗生素,治疗效果不明显。在使用自制灭活疫苗进行一次免疫和两次免疫后,病情得到有效控制。而且两次免疫效果优于一次免疫效果,说明对沙门氏菌病的防控,疫苗免疫相对于抗生素的治疗,更具优势。
本次发病兔场的规模化程度高、管理制度系统完整、日常消毒安排合理,但仍出现严重的沙门氏菌感染。这种情况除了与沙门氏菌自身生存能力强、易感染外,说明兔场可能在日常管理、消毒过程中仍存在一定盲点。要彻底消除此病,兔场还需加强对外来引进种兔的病原监测力度,实行严格的粪污处理措施,制定合理的免疫防控计划等,最终达到净化此病的目标。

