静电纺抗菌聚丙烯腈纳米纤维膜制备及其性能
黄程博, 任学宏
(江南大学 纺织服装学院, 江苏 无锡 214122)
随着我国经济的飞速发展,人们的物质生活水平显著提高,但仍不可忽视当前突出的健康问题;环境中存在的大量细菌可对人体健康造成危害,因此,抑制细菌在材料表面的生长,对抗菌材料的研究以及人类健康具有重要意义[1]。目前抗菌材料有季铵盐、金属离子和金属氧化物,在各种抗菌剂中卤胺化合物由于其优良的生物杀菌性和耐久性而引起了广泛的关注,且卤胺化合物对多种细菌均具有抗菌杀菌效果[2-3],已被广泛应用于生物杀菌涂料、纺织、水过滤等领域。
纳米材料由于具有比表面积大,直径小的特点而吸引了越来越多的学者将其应用到不同的领域[4-5]。静电纺丝是制备纳米级纤维的一种简单而有效的方法[6],通过静电纺丝技术得到的纤维具有多种优点,如直径大,比表面积大、多孔结构等,因此将抗菌剂引入到静电纺纳米纤维中具有巨大的潜力和实际应用价值[7-8]。聚丙烯腈因其官能团不活泼,且在正常条件下不易发生氧化反应,耐酸碱腐蚀,对一般试剂具有化学惰性,所以是静电纺丝常用的基材[9-10]。目前,静电纺聚丙烯腈纤维膜已被用于吸附染料、气液过滤方面[11-12]。而用于抗菌材料时,通过聚丙烯腈和小分子化合物共混获得抗菌性,这种材料存在抗菌性不稳定、易分解等缺点[13]。
为此,本文首先采用海因单体3-(4’-乙烯苄基)-5,5-二甲基海因 (VBDMH)与甲基丙烯酸甲酯(MMA)合成一种抗菌型卤胺高分子,然后将其与聚丙烯腈进行共混,通过静电纺丝制备稳定高效的抗菌性纳米纤维膜,并对其结构和性能进行研究。
1 实验部分
1.1 试剂与仪器
聚丙烯腈(PAN,相对分子质量为15 000)、海因(DMH)、甲基丙烯酸甲酯(MMA)、过硫酸钾、乙醇、甲醇、次氯酸钠、淀粉、稀硫酸(国药集团化学试剂有限公司); N,N-二甲基甲酰胺(DMF)、4-氯甲基苯乙烯(西格玛奥德里奇(上海)贸易有限公司);氢氧化钾(KOH)、碘化钾(KI)、硫代硫酸钠(上海Aladdin科技股份有限公司);磷酸盐缓冲液、金黄色葡萄球菌、大肠杆菌(美国奥本大学)。
INOVA-400型核磁共振仪,美国Varian技术有限公司;TM3030型扫描电子显微镜,日立高新技术公司;vario MICRO cube型元素分析仪,德国 Elementar 贸易有限公司;NICOLET iS10型傅里叶变换红外光谱测试仪,美国赛默飞世尔科技(中国)有限公司;JY-150Y型超声细胞粉碎机,上海秉越电子仪器有限公司;IKA RV 10型旋转蒸发仪,德国IKA科技有限公司;DF-1CD型数显恒温磁力搅拌油浴锅,常州金坛亿能实验仪器厂。
1.2 卤胺前驱体纳米颗粒的合成
根据文献[14]合成VBDMH粉末,具体实验步骤为:首先将5.28 g KOH溶解在乙醇溶液中,随后将12.8 g的DMH溶入KOH的乙醇溶液中;同时在圆底烧瓶中称取45 mL甲醇溶液,将15.27 g的4-氯甲基苯乙烯在通风条件下快速加入到烧瓶中,搅拌至充分溶解;然后将上述2种溶液混合均匀,置于60 ℃数显恒温磁力搅拌油浴锅中,持续匀速搅拌10 h。待溶液冷却后对其进行旋转、蒸发,通过重结晶提取较为纯净的VBDMH粉末。
为得到均匀的MMA和VBDMH混合溶液,将MMA和VBDMH依次加入到80 mL去离子水中,然后置于超声细胞粉碎机中。为避免混合液在振荡分散过程中温度过高,将其放置在冰水装置中,然后持续超声10 min,直至得到均匀分布的MMA和VBDMH混合溶液。之后将混合溶液加热至75 ℃,同时将0.05 g的过硫酸钾溶解在20 mL去离子水中,然后逐滴加入MMA和VBDMH混合液中,在N2保护条件下反应6 h得到含有卤胺高分子前驱体的液体。最后通过离心、提纯得到卤胺高分子前驱体纳米颗粒。卤胺高分子共聚物用Px(x=10∶90,20∶80,30∶70,40∶60)表示,P10∶90即代表聚合前VBDMH与MMA的量比为10∶90时所形成的聚合物。
1.3 抗菌PAN纳米纤维膜的制备
称取1.6 g的PAN固体粉末,将其加入到20 mL的DMF溶液中,在25 ℃条件下快速搅拌直至纺丝液澄清透明。然后将质量分数为8%的卤胺高分子前驱体加入到上述纺丝液中,匀速搅拌至高分子完全溶解进行静电纺丝,制备出PAN纳米纤维膜。纺丝过程中,调节纺丝电压为15 kV,喷射距离为15 cm。
1.4 纳米纤维膜的氯化
首先制备质量分数为10%的次氯酸钠溶液,并用稀硫酸溶液调至pH值为7备用;将1.3节制备的纳米纤维膜浸没到上述次氯酸钠溶液中,氯化1 h后,用大量的去离子水对纳米纤维膜表面进行冲洗,去除纤维间残留的自由氯离子;然后将纳米纤维膜放入45 ℃真空干燥箱中1 h后取出待用,以去除表面残留氯离子。
1.5 纳米纤维膜的含氯量测试
为测定纳米纤维膜的含氯量,采用碘化/硫代硫酸盐滴定法。具体操作步骤为:称取1 g淀粉并加入100 mL去离子水,在高温条件下配置成澄清透明的淀粉溶液,最后冷却至常温备用;再用少量去离子水润湿0.05 g氯化后的纳米纤维膜,然后加入KI并滴加少量淀粉溶液,快速搅拌使KI完全溶解,抗菌纳米纤维膜被渗透,观察其表面和溶液颜色变化。为避免溶液发生氧化,整个过程需要在密封条件下进行。显色完成后,用硫代硫酸钠溶液进行滴定,待溶液颜色完全消失,记录所用的硫代硫酸钠溶液的体积,并计算纳米纤维膜的含氯量,其计算公式为
式中:m为抗菌纳米纤维膜的质量,g;V为用于滴定抗菌纳米纤维膜的硫代硫酸盐标准液的体积,L;N为硫代硫酸盐的标准液的浓度,mol/L;C为抗菌纤维膜中氧化态氯的质量分数,%;35.45为氯原子的相对原子质量。
1.6 纳米纤维膜的微观形貌和结构测试
采用扫描电子显微镜观察纳米纤维膜表面的纳米颗粒和纳米纤维;并利用拍摄的电镜照片进行纳米纤维直径分析。
采用傅里叶变换红外光谱仪对纳米纤维及卤胺高分子前驱体的官能团进行表征。实验前先将试样在30 ℃烘箱中烘燥12 h,然后在室温条件下,采集4 000~500 cm-1之间的纳米纤维膜的红外特征峰。
采用核磁共振谱仪(1H NMR)对卤胺聚合物分子结构进行进一步表征,实验时以氘代试剂(CD3COCD3)为溶剂,参比物为四甲基硅烷。
1.7 表面元素组成测试
取2~5 mg的卤胺高分子前驱体在元素分析仪上对C、H、N、O等元素含量进行测试。
1.8 接触性抗菌测试
根据AATCC 100—2012《抗菌纺织品的评价方法》,分别检测氯化前后抗菌性纳米纤维膜对金黄色葡萄球菌和大肠杆菌的杀菌抑菌效果。制备大小(尺寸为2.54 cm×2.54 cm)厚度相同的对照样和抗菌样若干个,以及pH值为7的100 μmol/L磷酸盐缓冲液。分别将金黄色葡萄球菌和大肠杆菌悬浮于缓冲液中,配制成一定浓度的细菌悬浮液(每个实验样品约有106个CFU细菌)。然后将25 μL细菌悬浮液滴加到氯化前后抗菌纳米纤维膜的正中心,滴加完成后,采用“三明治”夹层接触试验法在样品表面再覆盖1层相同的样品,确保其与细菌能有良好的接触,实验在无菌环境中进行。达到抗菌接触时间后,为中和样品的残留氯,用5.0 mL浓度为0.02 mol/L的硫代硫酸钠溶液对实验样品进行淬火处理,并在离心管中高速振荡2 min,从而终止杀菌作用,然后对菌液进行多次稀释。在37 ℃条件下,将稀释液在营养基中接种培养24 h,使菌落快速生长繁殖。最后用细菌菌落计数法计算样品中细菌的数量,分析样品的抗菌效果。
2 结果与讨论
2.1 卤胺高分子前驱体的微观形貌分析
图1为乳液聚合并提纯后的卤胺高分子前驱体纳米微球的扫描电子显微镜(SEM)照片。可知:虽然VBDMH与MMA的聚合比例不同,但聚合形成的纳米颗粒表面形貌大致相同;随着VBDMH的聚合比例增加,卤胺高分子前驱体P20∶80到P40∶60的表面形貌均匀,纳米颗粒直径有略微增大的趋势。

图1 不同反应比例下卤胺高分子前驱体的SEM照片(×10 000)Fig.1 SEM images of nanoparticles prepared at different reaction proportions(×10 000)
综上所述,通过乳液聚合获得的纳米颗粒,其表面光滑,直径分布均匀,且纳米颗粒的离散度低。同时,通过探讨VBDMH的聚合比例对共聚物纳米颗粒影响可看出,VBDMH初始浓度的增加对颗粒的大小影响不大。
2.2 卤胺高分子前驱体的元素分析
表1示出不同聚合比例下卤胺高分子前驱体的元素分析结果。可以看出,当VBDMH与MMA的量比为10∶90时,P10∶90中元素C和N的含量分别为61.16%和4.9%,随着物质的量比逐渐增大,反应结束后共聚物单体的量比n∶m(n∶m为反应结束后共聚物中VBDMH和MMA的量比)也逐渐增大;当VBDMH与MMA初始量比为30∶70时,共聚物中VBDMH的量呈稳定增加的趋势。这是由于在反应中VBDMH成分越多,VBDMH的反应活性就越高。当VBDMH与MMA的聚合比例为40∶60时,共聚物单体的量比最大。

表1 不同比例的卤胺高分子前驱体中的元素比例Tab.1 Proportion of elements in nanopolymers of different proportions
2.3 卤胺高分子前驱体的结构分析
图2为VBDMH与MMA乳液聚合生成的卤胺高分子前驱体的化学式及核磁谱图。
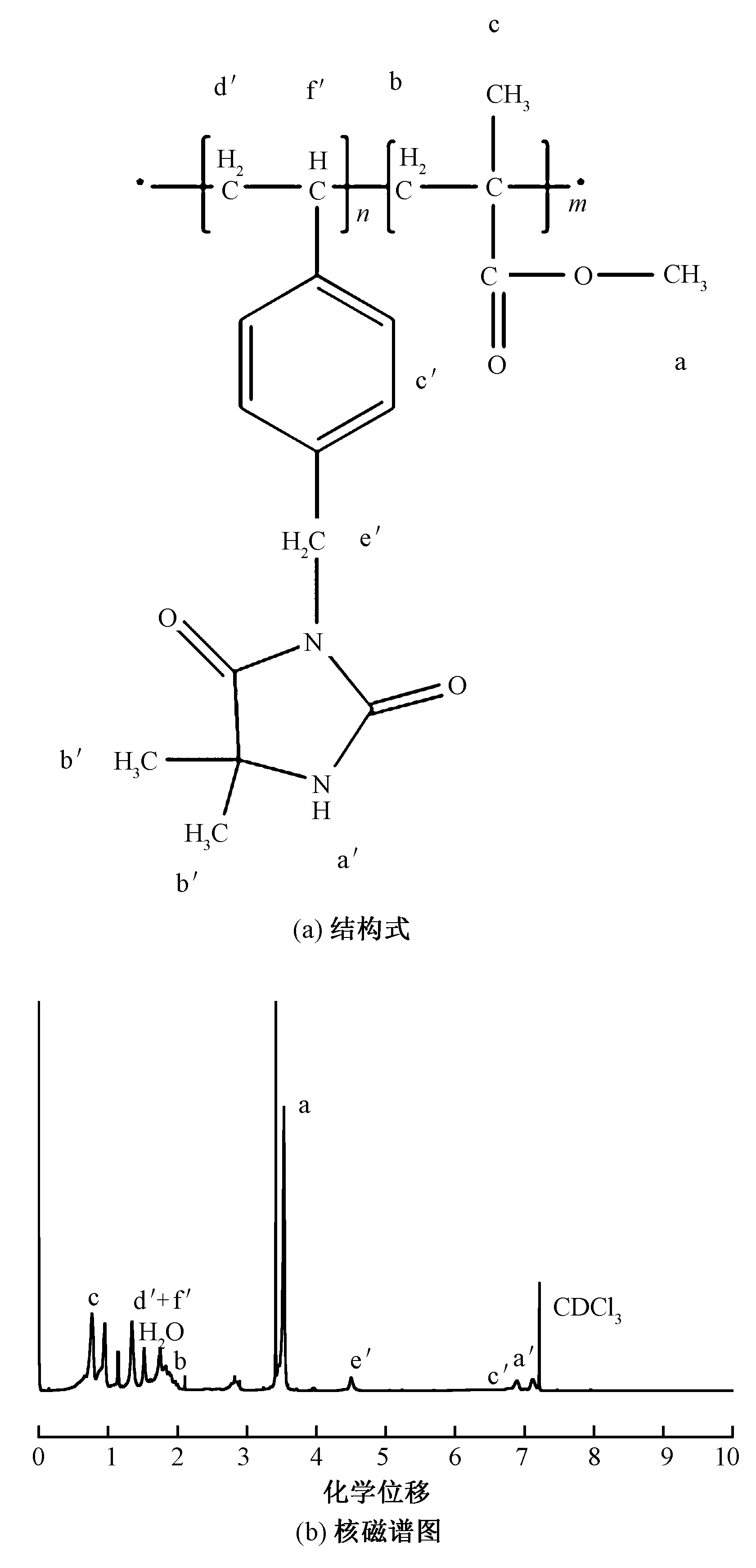
图2 卤胺高分子前驱体的结构式和核磁谱图Fig.2 Structure formula(a)and 1H NMR(b)of poly(VBDMH-co-MMA) nanoparticles
2.4 PAN抗菌纳米纤维膜的表面形貌
图3为氯化前后抗菌性纳米纤维的SEM照片。从图3(a)中可观察到,氯化前纳米纤维表面没有凹凸不平的现象,且没有形成珠结,直径尺寸分布均匀,这说明卤胺高分子前驱体能够很好地溶解在DMF溶液中。从图3(b)观察到纳米纤维表面没有明显变化,纤维取向随机、均匀相互交联。总之卤胺高分子前驱体能够溶解在DMF溶液中,高分子前驱体的添加对于静电纺丝过程和纳米纤维膜的形成没有产生直观的影响。

图3 氯化前后纳米纤维的SEM照片(×5 000)Fig.3 SEM images of nanofibers before (a) and after (b) chlorination(×5 000)
2.5 PAN抗菌纳米纤维膜的抗菌性能
氯化前后PAN抗菌纳米纤维膜的抗菌结果如表2所示。可以看出,氯化前的纳米纤维膜与氯化后的抗菌纳米纤维膜对2种细菌的杀菌、抑菌效果不同。从氯化前的纤维膜的抗菌结果看出,在接触时间30 min后,2种细菌的数量依然会减少很多。这是因为静电纺纳米纤维具有比表面积大的特点,且纤维与纤维相互交错,有利于细菌的附着,所以会有一部分细菌依附在纤维表面存活。从氯化后的纳米纤维膜的杀菌结果看出,在接触1 min后,抗菌纳米纤维对接种的细菌有明显的抑制作用;随着接触时间的延长,杀菌率逐渐升高,在30 min内可使大肠杆菌和金黄色葡萄球菌2类细菌失活,相对于原膜抗菌性提高20%~50%,抗菌性较好。

表2 纳米纤维膜的抗菌效果Tab.2 Antibacterial effect of nanofibers
3 结 论
本文通过乳液聚合获得的卤胺高分子前驱体,当VBDMH与MMA的初始量比为40∶60时,单体聚合反应活性最好,制备的卤胺高分子前驱体具有光滑的表面,且直径分布均匀,离散度相对较低。卤胺前驱体的添加对聚丙烯腈纳米纤维膜的形成没有较大的影响,抗菌纳米纤维膜具有光滑的表面,且纤维直径均匀分布。经过氯化后的抗菌纳米纤维膜在30 min内可使接触的大肠杆菌和金黄色葡萄球菌2类细菌失活,相对于原膜抗菌性提高20%~50%,抗菌性较好。
FZXB

