基于广义回归神经网络的微生物降解效应对助燃剂检测的影响
方 强, 刘 玲
(中国人民警察大学, 河北 廊坊 065000)
在放火案件的调查中,助燃剂的检测结果往往是判定是否故意放火最直接有力的证据,然而由于火场环境的复杂性和送检过程中的诸多影响因素,物证的检测往往受各种因素的干扰。目前,国内对干扰助燃剂检测的影响因素研究主要分为两大类,一是在整个火灾发生到送检过程中一直存在的挥发效应的影响,低沸点特征组分的挥发会干扰物证鉴定人员对检材内有无助燃剂的判断;二是火场中载体热解的干扰影响,载体热解生成助燃剂的特征组分,极易影响物证鉴定人员的判断,其中以建材、塑料和石化产品的热解干扰研究为主[1]。国外也将上述两类影响列入主要研究范围。此外,研究人员还发现,在放火火灾现场取样的过程中,物证提取人员往往采用低位取样的方式提高易燃液体的检出成功率,并同时期望能在地板缝等近地面处提取到助燃剂原样,样品往往伴随着土壤一同送检。在取样前至送检的过程中,土壤中可能存在的助燃剂特征组分会受到微生物的降解作用,原特征组分逐渐消失甚至生成新的化合物,这大大影响了物证鉴定人员对检材内组分的判断,从而影响放火案件性质的认定。
在火灾调查研究中,Chalmers等[2]将汽油、柴油等与土壤混合,置于密封环境,研究微生物降解效应对助燃剂检测的影响,结果表明,在提取时间大于14 d的样品内,可明显观察到降解效应对谱图的影响。Turner等[3]对比研究了挥发效应和微生物降解效应对助燃剂鉴定的影响,研究结果表明,沸点小于155 ℃的直链烷烃主要受挥发效应的影响,而长直链烷烃和低取代芳香化合物更易受微生物降解效应的影响,1,3,5-三甲苯和2-乙基甲苯对挥发效应和微生物降解效应具有极强的抗性。此外,不同季节条件下助燃剂燃烧残留物受微生物降解的影响程度也有所区别,夏季提取的样本受降解的影响最不明显[4],该类降解反应可以通过特定的化学试剂进行抑制[5]。多个研究[5-7]共同发现,助燃剂燃烧残留物中,直链烷烃、单取代芳香化合物、多取代芳香化合物受微生物降解效应的影响程度依次减小;重质馏分油中,偶数正构烷烃比奇数正构烷烃更易受微生物降解作用。此外,Katherine[8]将土壤载体变为常见的建筑材料(木垫片、石膏板),并按含水程度进行对比,发现在发霉、陈腐的建筑材料上也会发生类似的降解反应,并对助燃剂检测产生影响。在环境安全领域也有大量关于石化油品泄露后治理与修复的研究[9-14],此方面研究也为微生物降解效应在助燃剂检测方面的课题提供理论依据和研究思路。
依据国家标准《火灾物证鉴定方法 气相色谱-质谱法》[15],对于地面、炭灰或其他实物试样,可采取捕集、顶空、固相微萃取和活性炭吸附等方法提取;鉴于吹扫捕集法无法同时对多组样品进行预处理,若采用该方法无法严格控制密封时间这一变量,故不予选择;固相微萃取(SPME)是目前较新的火场残留物提取技术,依靠涂有固定相的吸附性石英纤维对待测样品进行吸附与富集,但其往往根据助燃剂中化合物的性质进行选择性吸附,并不能完全表征样品中的助燃剂组分,且无法采用自动进样控制进样过程中人为因素的干扰,故亦不予选择。对比而言,静态顶空的方式既可以解决不同极性助燃剂组分表征的问题,亦可保证样品密封时间的精确性,是目前国外法医科学研究人员较为推荐的样品预处理方式之一。
由于在助燃剂等相关火灾残留物分析过程中,分析人员的工作经验和主观认知一定程度上影响着鉴定结果,为避免误判、错判,研究人员常引入模式识别的概念用于数据集的鉴别[16-19],这也为物证鉴定工作的科学性提供一定的保障。本文采用主成分分析法(PCA)和PCA-广义回归神经网络(PCA-GRNN)两类分析方法,对不同土壤载体降解情况下的助燃剂残留物进行识别,旨在为助燃剂残留物的GC-MS数据进行科学性的分析。
1 实验部分
1.1 仪器、试剂与材料
Agilent GC 7890B/5977BMSD气相色谱-质谱联用分析仪、HP-5MS色谱柱(30 m×0.25 mm×25 μm)、7693自动进样器(美国Agilent公司);微型注射器(50 μL,上海高鸽有限公司);制式0.2 L油漆罐(带密封盖,德州麦凯卓电子商务有限公司)。
二硫化碳(分析纯)购自天津福晨化学试剂厂;助燃剂92#汽油购自廊坊中石化加油站;无蜡牙线、木质柱状活性炭(周长8 mm、高度16 mm,每块活性炭高度相差不到1 mm)购自郑州森海环保科技有限公司;市售通用培养土样购自江苏天补生态肥业有限公司;普通土样取自河北廊坊住宅区无植被处。
1.2 样品前处理
将90 g普通/培养土样置于制式油漆罐内,用微型注射器取20 μL汽油,注入土壤下表面2 cm处,分别存放2、5、7、10、14、21和30 d,期满后采用静态顶空预处理方式,取木质柱状活性炭,于罐顶用无蜡牙线和回形针悬挂活性炭,做顶空吸附处理,于70 ℃水浴环境下加热2 h[20]。冷却至室温,取出活性炭,装入含有1 mL二硫化碳的色谱试剂瓶中,超声振荡5 min,等待进样,每组样品做3次,样品总数42组。
1.3 GC-MS条件
1.3.1色谱条件
进样口温度275 ℃,压力值4.838 5 Pa; He气总流量19.015 mL/min;分流比20∶1;柱前压800 kPa;程序升温条件:初始温度50 ℃,保持3 min,以10 ℃/min的速率升至280 ℃,保持4 min。
1.3.2质谱条件
电子轰击电离(EI)源;离子源温度230 ℃;接口温度280 ℃;溶剂延迟2.30 min;四级杆温度150 ℃;扫描范围m/z50~550;扫描频率2.8次/s。
2 结果与讨论
2.1 不同土样样品的降解分析
2.1.1普通土样
不同密封时长下普通土样受微生物降解的总离子流色谱图见图1。可以发现,当密封保存时间在10 d以内时,样品色谱图的主要变化区域集中在保留时间小于8.7 min的部分,上述区域各物质色谱峰的响应强度整体呈现下降趋势,且出现出峰时间靠后的高沸点化合物响应强度大幅变化的结果;而保留时间大于8.7 min的物质,其10 d内整体响应强度变化较小,但也出现特定物质消失的现象。

图 1 不同密封时间下普通土样的总离子流色谱图Fig. 1 Total ion current (TIC) chromatograms of general soil samples under different sealed times 1. 1,2,3-trimethylbenzene; 2. 1-methyl 3-propylbenzene; 3. isobutylbenzene; 4. 2-ethyl 1,3-dimethylbenzene; 5. 1-methyl-4-propyl-benzene; 6. 1-ethyl 2,4-dimethylbenzene; 7. isopropyltoluene; 8. 2-ethenyl-1,3-dimethyl-benzene; 9. 1,2,4,5-tetramethylbenzene; 10. [1S-(1α,2α,5β)]-5-methyl-2-(1-methylethyl)cyclohexanol (C10H20O).
为探究具体化合物的变化情况,对样品进行分析,并提取m/z为91、92、106、120和134的离子,获得芳香烃化合物的提取离子流色谱图。如图2所示,单取代芳香烃化合物如甲苯、乙苯、异丙基苯和1,2,4-三甲基苯(峰9)会在10 d内大量降解,二甲苯的同分异构体的色谱响应也大幅下降。但已有研究[7]表明,二甲苯等沸点小于155 ℃的芳香烃化合物更易受挥发效应的影响而导致其相对含量的减少。在5 d内,除了1,2,4-三甲基苯(峰9)外,其他多取代芳香烃化合物均对微生物的降解效应呈现出较强的抵抗性,该现象与Turner等[7]的研究结果相符合;而在5~10 d范围内,除1,2,3-三甲基苯(峰10)、2-乙基1,3二甲基苯(峰12)、1,2,3,5-四甲基苯(峰14)、1,2,4,5-四甲基苯(峰15)仍保持较强的抗降解性,其余组分也开始降解;但密封14 d时,仅可检出微量的二甲苯、三甲苯及其同分异构体和四甲苯及其同分异构体;密封保存30 d后,在样品中检出甲醛,符合单取代芳香烃化合物降解过程中支链烷烃取代基脱氢变醛的降解原理[21]。
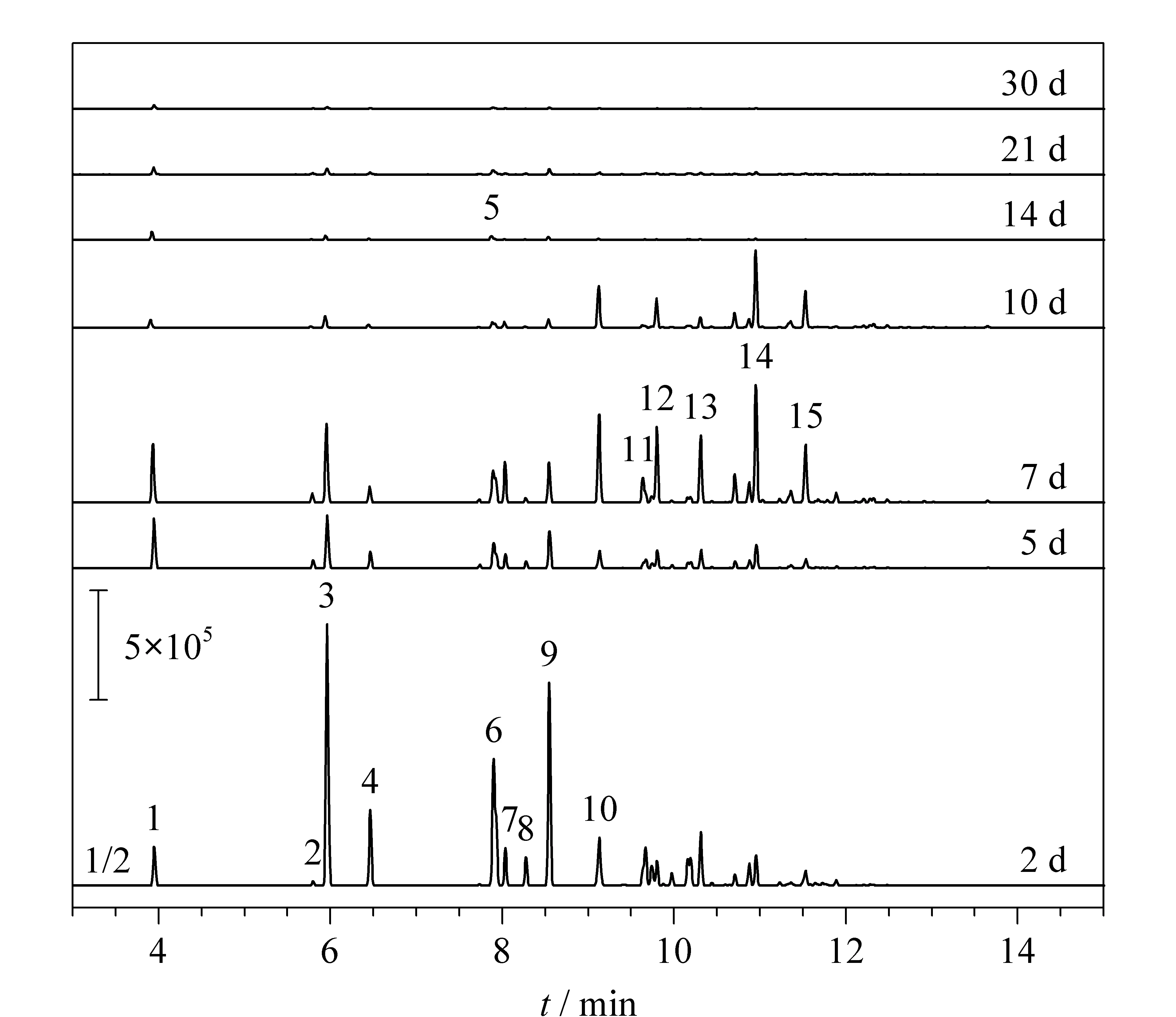
图 2 不同密封时间下普通土样中芳香烃的提取离子色谱图Fig. 2 Extraction ion chromatograms (EICs) of aromatic hydrocarbon in general soil samples under different sealed time 1. toluene; 2.m-xylene; 3.p-xylene; 4.o-xylene; 5. ethylbenzene; 6. isopropylbenzene; 7. 1,3,5-trimethylbenzene; 8. 1-ethyl 2-methylbenzene; 9. 1,2,4-trimethylbenzene; 10. 1,2,3-trimethylbenzene; 11. 1-methyl 3-propylbenzene; 12. 2-ethyl 1,3-dimethylbenzene; 13. 1-ethyl 2,4-dimethylbenzene; 14. 1,2,3,5-tetramethylbenzene; 15. 1,2,4,5-tetramethylbenzene.

图 3 普通土样中不同取代位数的芳香烃的相对含量Fig. 3 Relative contents of aromatic hydrocarbons with different substitution numbers in general soil samples MAH: monosubstituted aromatic hydrocarbons; PAH2: disubstituted aromatic hydrocarbons; PAH3: trisubstituted aromatic hydrocarbons; PAH4: tetra-disubstituted aromatic hydrocarbons.
将芳香烃化合物按取代位的数量进行分类,对其相对含量的变化进行研究,结果如图3所示,发现单取代芳香烃化合物和含2个取代位的烷基芳香烃化合物的相对含量会在密封10 d内下降至10%以下,10 d后则会慢慢上升;3个取代位烷基芳香烃化合物的相对含量则较稳定,一直维持在0%~20%之间;而4个取代位的烷基芳香烃化合物(本次实验中多为四甲苯及其同分异构体芳香烃),则在密封10 d后才被慢慢降解。由此可见,当样品密封存放时间小于10 d时,多取代芳香烃化合物较单取代芳香烃的降解能力强,而当封存时间超过10 d后,大量多取代芳香烃化合物也会降解至无法检出;当密封时间为30 d时,仍可检出少量邻位多取代芳香烃化合物(1,2,3-三甲基苯、2-乙基-1,3-二甲基苯、1,2,3,5-四甲基苯)。
在图1的总离子流色谱图中,发现了[1S-(1α,2α,5β)]-5-甲基-2-(1-甲基乙基)环己醇(下文用C10H20O代表,峰10),此物质未曾在以前的助燃剂鉴定工作中出现。为探究C10H20O这一产物是否为普通土样内的微生物降解产物,将20 μL汽油泼洒到土样上并立即进行静态顶空处理,同密封放置时间为2 d和5 d的样品进行比较分析(见图4)。由图4可知,当汽油泼洒到土样后立即提取时,可检出C7、C8和C11直链烷烃,并未检出C10H20O;当密封放置时间大于2 d时,可检测出C10H20O,同时可检出C7和C8直链烷烃,可能是因为C9~C12烷烃在反应焓和水溶性方面适合微生物进行降解[22]。;当密封时间为5 d时,C8也无法检出,仅可检出C10H20O,且依照NIST谱库检索匹配度达94.06。
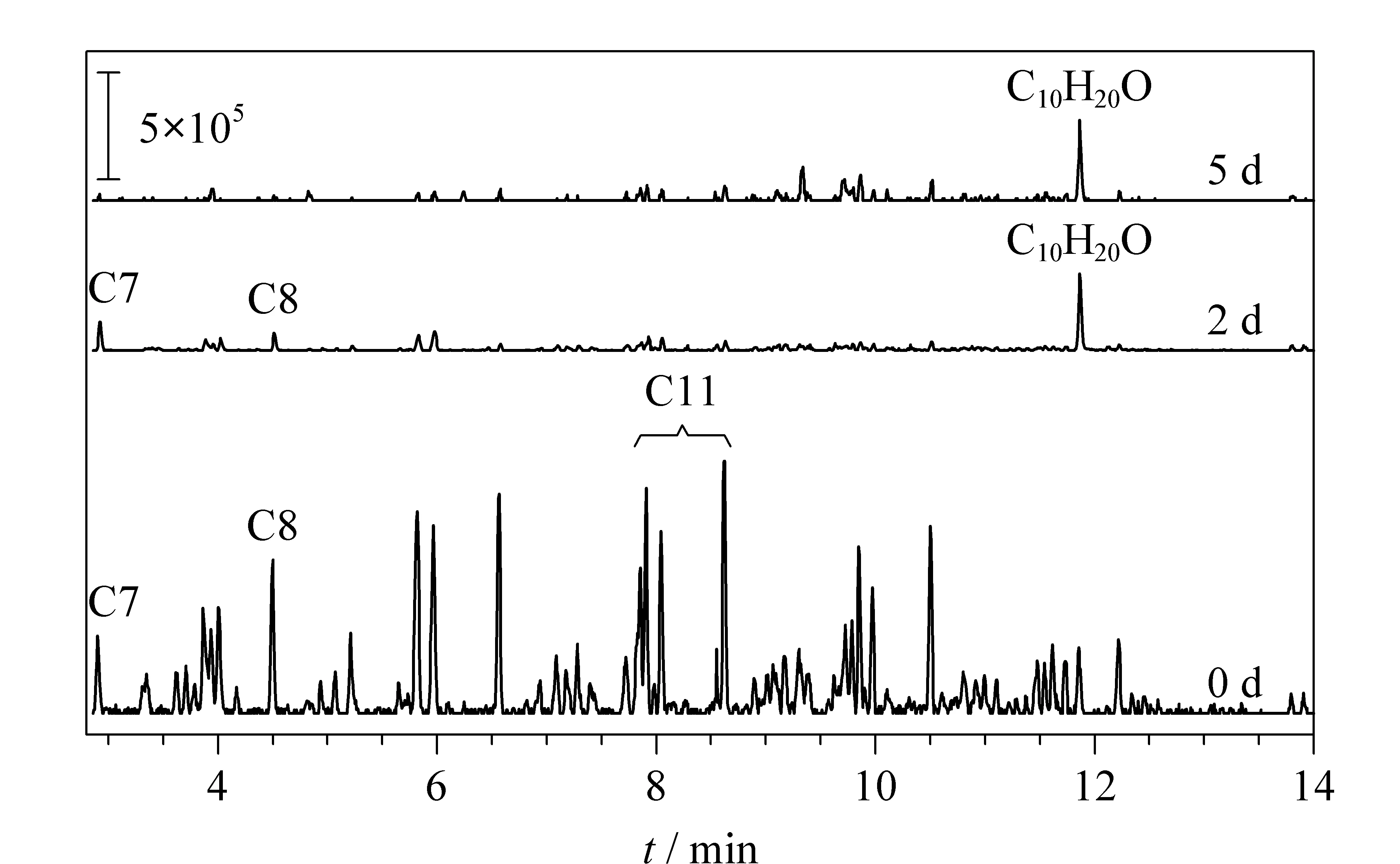
图 4 存放0 d、2 d、5 d后普通土样品中烷烃的提取离子色谱图Fig. 4 EICs of alkanes in general soil samples afterstorage of 0 d, 2 d, 5 d
结合图1中峰6的变化情况,以及芳香烃化合物在降解过程中需要先活化为醇的原理,推测C10H20O为1-乙基2,4-二甲基苯同分异构体降解过程中的活化产物,进而再降解氧化为脂肪酸等物质,最终开环。由于芳香烃化合物的降解步骤分为活化和开环两步进行,此处C10H20O的存在只能说明降解过程中活化阶段已发生,至于能否进行下一步开环反应,还要根据土壤内微生物的种类与降解酶的合成情况,故并不与多取代芳香烃难降解性的结论相悖。
2.1.2培养土样
图5为以培养土为载体的样品在不同密封存放时间下的总离子流色谱图。结果发现,随着密封时间的增加,各组分相对峰高基本维持稳定;在密封5~30 d的样品中均可检测出C10H20O。
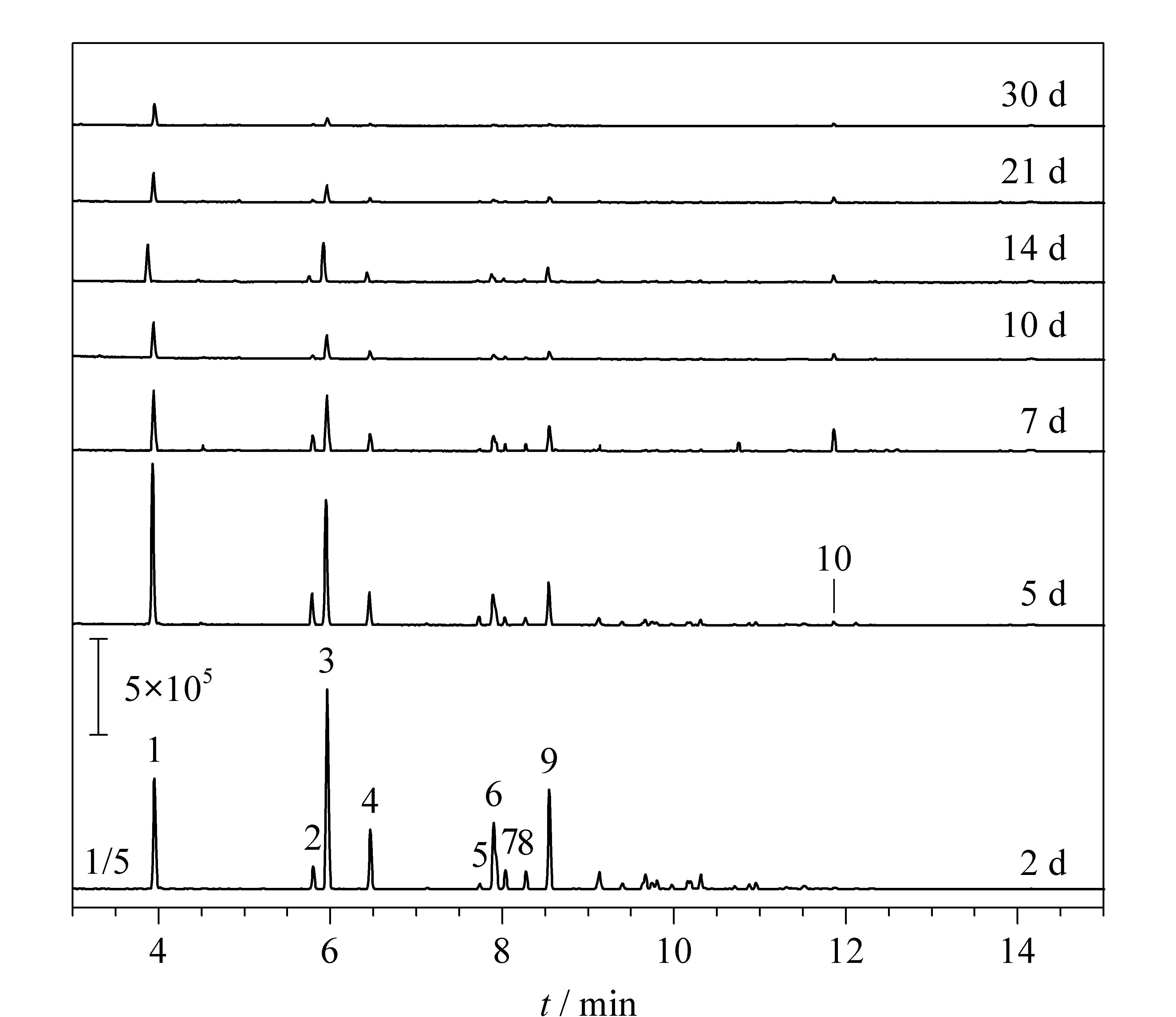
图 5 不同密封时间下培养土样品的总离子流色谱图Fig. 5 TIC chromatograms of nutrient soil samplesunder different sealed time1. toluene; 2.m-xylene; 3.p-xylene; 4.o-xylene; 5. ethylbenzene; 6. isopropylbenzene; 7. 1,3,5-trimethylbenzene; 8. 1-ethyl 2-methylbenzene; 9. 1,2,4-trimethylbenzene; 10. C10H20O.
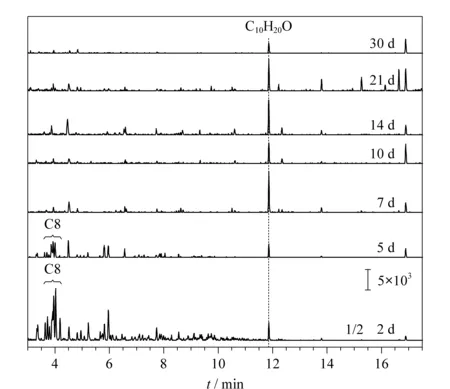
图 6 不同密封时间下培养土样品中烷烃化合物的提取离子色谱图Fig. 6 EICs of alkane compounds in nutrient soilsamples under different sealed time
图6为不同密封时间下培养土样品中烷烃化合物的提取离子色谱图,除密封存放时间为2 d、5 d的样品中尚可检出C8直链烷烃的同分异构体和C10H20O,其余样品都无法检出直链烷烃。
通过分析培养土样品的芳香烃提取离子色谱图,发现各芳香烃组分的色谱响应不随密封时间的增长而变化。结合图5和图6,可见汽油在培养土的环境下也发生了微生物降解反应,但并未出现普通土样中,特定物质优先降解的现象,原因可能与培养土黏度大、密度小、吸附性良等因素有关。由于微生物降解过程中涉及的影响因素较多,目前未能给出明确的原因,但此类黏度大、碳源氮源丰富的土壤已作为新型火场提取吸附材料(用于自动热脱附预处理方式)被国外火灾调查人员投入使用[23]。
2.2 模式识别的应用
2.2.1PCA应用
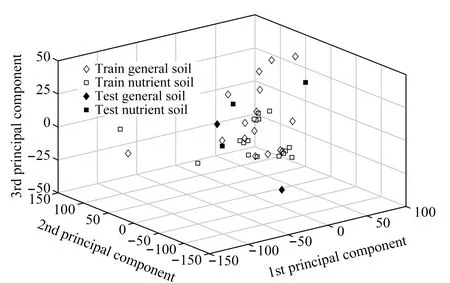
图 7 PCA法分析前3个主成分构成的三维散点图Fig. 7 3D point map of the first three principal components in principal component analysis (PCA)
PCA是最常见的一种对数据进行降维处理的方法,其核心概念是通过线性组合的方式以数量较少且互相独立甚至不相关的变量解释原数据中的大部分变量。在Qualitative Navigator B.08软件上观察此实验42组样品的色谱图,发现两组因偶然情况(活性炭移动过程中掉落、破碎)发生,致使样品的色谱图不理想。将色谱数据经过软件自动积分和数据导出,生成相对峰面积的表格,特定峰的选取为图2标注的15个物质峰,导入Matlab R2017a环境后,生成40×15的样本矩阵,再将每组样品对应的密封时间作为第16列变量加入数据矩阵中。矩阵去中心化后通过主成分分析,对样本进行降维处理,其中随机5组样本作为测试集进行交叉验证。图7为取权重较大的前3个主成分制成三维散点图,可以看出,并未出现肉眼可见的区域边界。
2.2.2GRNN应用
GRNN是前馈型神经网络的一种,由径向基(RBF)神经网络延伸而来。标准的RBF神经网络的计算结果经常不能达到全局收敛,而停止在局部收敛;而GRNN由于可以通过交叉验证和回归的方法确定平滑参数,故计算结果具有全局收敛性,更适用于数量少、样本相似度高的训练集。
考虑到此次实验组数较少,谱图数据相似度较高,采用PCA-GRNN方式加以识别,以避免数据样品少导致的过拟合现象,采用Early Stopping的处理方式,在迭代的过程中进行交叉验证,若连续10次迭代过程中测试集的最高准确率不再升高,即迭代停止。

图 8 PCA-GRNN法回归分析过程中运行时间和准确率的变化情况Fig. 8 Changing situation of running time and accuracies during PCA-generalized regression neural network (PCA-GRNN) regression analysis process
如图8所示,随机选取35组样本,经环境自带PCA函数处理后,记录能以新线性组合表示该35组数据样本信息的变量个数(P),迭代上述过程,至P取到最小值为止,选择第一次取至最小值时的35组样本为训练集;剩下5组样本作为测试集。由图8可知,当第3次迭代过程后,GRNN的最高识别准确率达100%且不再上升,故在12次迭代结束后停止迭代,即最终迭代后的运行时间小于0.1 s,正确率为100%。
3 结论
本文在助燃剂鉴定研究方面探究微生物降解效应的影响,采用静态顶空法对土壤内的助燃剂进行预处理,并采用PCA和PCA-GRNN两种分析方法对不同土壤载体下的助燃剂谱图进行判别、检验。比较发现,单一PCA并不能对样本数据进行良好的分类,而PCA-GRNN这一方法对于少量训练集的样本数据具有更为准确的判别效果。方法为火灾物证鉴定提供了新的数据分析手段和探究助燃剂鉴定影响因素的新方向。

