癌源外泌体的制备及其对胃癌细胞STK15表达的影响*
杨 勇,陈 霖,杨宏新,李 磊,于 建,何源哈达,杨 晨,徐 伟,高艳伟,高维实
(1.内蒙古自治区人民医院肿瘤外科,呼和浩特 010017;2.内蒙古医科大学基础医学院,呼和浩特 010059;3.湖北省宜昌市第一人民医院中医科 443000;4.内蒙古医科大学临床医学院,呼和浩特 010059;5.内蒙古自治区人民医院中西医科,呼和浩特 010017)
随着分子生物学和免疫学的发展,肿瘤的生物治疗成为国际研究的热点。近几年具有亚细胞结构的外泌体(exosomes)日益受到重视,有学者预言外泌体可能会成为未来疾病诊断和治疗的工具[1]。外泌体源自细胞并通过胞吐方式分泌到细胞外,是具有膜性结构的小囊泡[2],来源于不同细胞的外泌体所含成分也不同,目前已证实很多类型细胞都能释放外泌体,但外泌体负载的抗原物质存在很大差异,所以对不同来源的外泌体的深入研究对于肿瘤的个性化治疗显得非常重要[3]。丝氨酸/苏氨酸激酶15(serine/threonine kinase 15,STK15)是中心体扩增相关基因,与细胞有丝分裂相关,有学者把其作为中心体扩增的标记物。早期有学者认为外泌体有抗肿瘤作用,有人推测其可能会成为抗肿瘤疫苗[4],但随研究的深入,有学者发现其负载肿瘤抗原有促进肿瘤细胞增殖作用[5-6],故本研究以胃癌MGC-803细胞为模型,从其培养上清液中制备胃癌细胞分泌的外泌体,然后通过体外实验证明外泌体对胃癌细胞的作用,以及对胃癌细胞产生效应的可能机制,为今后外泌体肿瘤疫苗研发提供理论依据,现报道如下。
1 材料与方法
1.1材料 人低分化胃癌细胞株MGC-803为本实验室常规传代保存。RPMI 1640培养基和胎牛血清购自美国Gibco公司,甲基偶氮唑蓝(MTT)购自美国Sigma公司,二辛可宁酸(BCA)法蛋白定量试剂盒购自北京百泰克生物技术有限公司,STK15一抗购自美国GeneTex公司,链霉卵白素-过氧化物酶(S-P)检测试剂盒和二氨基联苯胺(DAB)显示试剂盒及多聚赖氨酸购自福建迈新试剂公司。
1.2方法
1.2.1细胞培养 胃癌MGC-803细胞液氮取出复苏后,置于含10%灭活胎牛血清、100 U/mL双抗(青霉素和链霉素)的RPMI 1640培养液中,于37 ℃、5%CO2、饱和湿度培养箱内培养,0.25%胰酶消化液消化传代,平均3~4 d传代1次,所有实验均采用对数生长期的细胞。
1.2.2外泌体的制备及蛋白定量 胃癌MGC-803细胞用75 mL培养瓶培养至对数生长期后,除去含血清培养基,用磷酸盐缓冲液(PBS)洗涤3遍,随后加入不含血清的RPMI 1640培养基,培养24 h后收集上清制备外泌体。(1)收集的上清液1 500 r/min离心10 min,3 500 r/min离心10 min;(2)采用15 000 r/min离心30 min,去除细胞及细胞碎片等物;(3)50 000 r/min离心2 h,用无菌PBS液稀释沉淀物、采用滤器除菌(0.22 μm)。首先采用BCA法用标准品测定得到蛋白标准曲线,然后根据标准曲线测得外泌体蛋白水平。将沉淀物分装在小离心管中,取出部分外泌体进行电镜检测,其余小管-80 ℃冰箱保存备用。
1.2.3电镜鉴定外泌体结构 将20 μL外泌体悬液滴加在载样铜网上,室温条件静置1 min后将铜网上多余液体用滤纸从侧面吸干,在铜网上滴加pH值为6.8的磷钨酸溶液(3%)30 μL,1 min后将磷钨酸用滤纸吸干,室温静置10 min后在透射电镜下观察外泌体并照像。
1.2.4胃癌细胞增殖活力检测 将对数生长期的MGC-803细胞用常规胰酶消化,PBS洗涤后再制成单细胞悬液,采用96孔板进行细胞培养,每孔接种100 μL细胞悬液(1×104个/mL),培养12 h后,分别加入终浓度为0.05、0.10、0.20、0.50 μg/μL的外泌体。实验设置实验对照组及空白对照组,每组设8个复孔,每孔终体积为180 μL。培养12、24、36、48 h后,每孔加入MTT溶液(5 g/L) 20 μL,孵育4 h后吸弃上清,然后加入200 μL二甲基亚砜(DMSO),充分混匀。570 nm波长条件下用酶标仪测定各孔平均吸光度值。
1.2.5细胞增殖相关基因STK15表达变化 将包被多聚赖氨酸盖玻片置于6孔培养板中,培养12 h待细胞贴壁后加入浓度为0、0.20、0.50 μg/μL的外泌体。培养24 h后将盖玻片取出放置于丙酮液中固定15 min,蒸馏水洗涤后,滴加3%的过氧化氢10 min,PBS洗涤,滴加血清封闭液10 min,滴加STK15一抗(1∶100),4 ℃冰箱过夜,PBS代替一抗作为阴性对照。次日PBS洗涤,滴加生物素标记的二抗工作液10 min,PBS洗涤,滴加链霉素抗生物素蛋白过氧化酶10 min,PBS洗涤,滴加DAB显色液5 min,自来水冲洗,苏木精复染,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片,在显微镜下观察染色结果。采用彩色图像分析系统测量阳性反应物的灰度值,在40倍视野下每张片子随机测量4个视野取其平均值代表STK15染色强度。

2 结 果
2.1外泌体的制备和蛋白定量 胃癌MGC-803细胞按照上述方法经超速梯度离心后得到外泌体,经标准品测定得到标准曲线为Y=0.653 4X-0.005 8,测得制备的外泌体浓度为13.39 μg/μL。

图1 倒置显微镜下胃癌MGC-803细胞(×200)
2.2外泌体的形态学鉴定 光学显微镜下可以看到胃癌细胞呈现梭形、多角形(图1),通过超速梯度离心法从胃癌MGC-803细胞上清液中得到外泌体,在透射电镜下观察到外泌体呈现圆形或椭圆形小囊泡,具有特征性的盘状结构,有完整的包膜,内为低电子密度物质,直径为50~130 nm,见图2。
2.3外泌体对MGC-803细胞活力的影响 制备的外泌体与胃癌MGC-803细胞共培养,经MTT结果显示外泌体随着浓度从0.05、0.10、0.20、0.50 μg/μL升高,570 nm波长平均吸光度值升高,随着时间延长吸光度值亦升高,通过方差齐性检验和方差分析后证实各时间节点的组间增殖活性差异有统计学意义(P<0.05),外泌体以时间和剂量依赖性方式促进胃癌MGC-803细胞增殖,见表1。
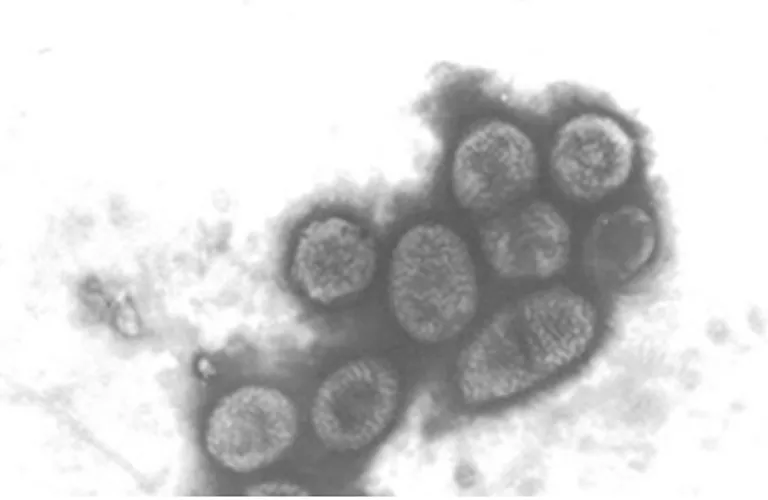
图2 透射电镜下的外泌体(×15 000)
a:P<0.05,与0 μg/μL外泌体组比较;b:P<0.05,与0.50 μg/μL外泌体组比较
A:0 μg/μL外泌体组;B:0.20 μg/μL外泌体组;C:0.50 μg/μL外泌体组
图3 MGC-803细胞0、0.20、0.50 μg/μL外泌体组中STK15基因表达(×400)
2.4免疫组织化学检测结果 免疫组织化学染色结果显示,STK15蛋白阳性反应物主要定位于细胞核,部分细胞质也有表达,阳性产物呈棕黄色颗粒,0.50 μg/μL外泌体的STK5表达高于0.20 μg/μL外泌体组,0.20 μg/μL外泌体组STK15表达高于MGC803细胞组,各组间表达强度差异有统计学意义(P<0.05)。0、0.20、0.50 μg/μL外泌体组中STK15基因表达,见图3。
3 讨 论
外泌体作为一种膜性小泡,最初是用来描述由网织红细胞分泌的小囊泡,直径为30~100 nm,呈现扁球体状,外膜为磷脂双分子层,在囊泡表面负载丰富的膜性分子,这些膜性分子与其功能和来源相关[7]。目前认为外泌体是由细胞膜内陷形成早期内体,早期内体的界膜向内凹陷出芽形成许多小泡,称之为多泡体(multivesicular bodies,MVB),当MVB膜与细胞膜融合后,再形成小泡被释放至细胞外空间,这种小泡被称之为外泌体。外泌体的膜也是由磷脂双分子层组成,由于脂类分子可以进行不间断运动,这样外泌体可与具有膜性结构的物质不断融合来交换物质,蕴含的生物信息逐渐被接触的细胞所容纳。目前人们知道,细胞之间的信息传递过程非常复杂,许多细节需要诠释,谁来扮演细胞之间的“信使”是目前这个领域亟待需要解决的难题。外泌体小泡表面负载活性物质很多[8],肿瘤细胞源的外泌体,负载信息更多[2],作用更为复杂[9-10]。甚至有学者认为,不同类型肿瘤细胞共表达的肿瘤共同抗原可能就存在于外泌体囊泡上,外泌体可能以自分泌和旁分泌形式影响癌细胞和正常细胞之间的信息传递[11]。通过外泌体载体传递抗原给抗原呈递细胞(如树突状细胞),介导CD4+T细胞免疫反应来治疗同基因源性和异基因源性肿瘤显示巨大潜力。
有效、安全、稳定和实用是肿瘤理想的治疗性疫苗应该具备的基本特征。从目前研究结果看肿瘤源外泌体具有膜的结构特征,大小只有100 nm左右,甚至更小,负载了肿瘤细胞的特征分子,具有纳米疫苗的特征,可以作为一种新型的亚细胞疫苗,当然其免疫原性、安全性、免疫反应性、耐受性等需要在实验中进一步验证。肿瘤源外泌体疫苗,由于其负载肿瘤相关抗原多,与细胞膜有特殊的可融合性,在细胞间的信息传递过程中发挥巨大作用,而作为肿瘤疫苗与其他肿瘤肽疫苗、核酸疫苗相比,从理论上可激发的免疫反应更强烈,甚至在上述疫苗无效的情况下也可能诱导明显的免疫应答。早期有研究报道当接种L1210细胞分泌的外泌体,移植性肿瘤细胞的生长可部分被抑制;抗肿瘤的T细胞免疫应答反应可被来自热休克淋巴瘤细胞的外泌体诱导[12]。王东关等[13]发现,树突状淋巴细胞可被肿瘤源外泌体活化成为特异性的细胞毒性T细胞(CTL),来杀伤肿瘤细胞。随着现代生物科学的发展,人们采用CRISPR/Cas9技术对肿瘤细胞的基因编辑工作更为简单,而外泌体作为细胞分泌的小泡,应该负载基因编辑后肿瘤细胞的特殊抗原,所以外泌体作为免疫调控和肿瘤治疗的工具或药物载体显示巨大潜力[1,14-15]。本研究采用超速离心法制备的肿瘤细胞外泌体,经电镜证实具有外泌体的特征。将制备外泌体作用于胃癌MGC803细胞,发现其可促进胃癌细胞生长,而且随外泌体浓度增加对胃癌细胞的增殖作用也增强,同时随着时间延长胃癌细胞增殖活性也越强,肿瘤源外泌体对胃癌细胞的生长作用具有时间和浓度依赖性。研究结果提示外泌体负载重要肿瘤抗原,由其传递给抗原呈递细胞产生的免疫效应可能非常强烈。
STK15基因编码一类丝/苏氨酸蛋白激酶,是中心体扩增相关激酶,其定位于中心体,位于染色体周围,是细胞增殖过程的关键基因[16],在细胞周期的G1/S期开始出现。中心体作为细胞主要微管组织中心,在细胞有丝分裂期可形成两极纺锤体,STK15不仅参与中心体的复制、分离和成熟,而且还参与纺锤体两极的组装与稳定性维持。当细胞周期结束后STK15迅速通过泛素化降解途径降解,STK15的精确适时表达在细胞有丝分裂中起重要作用。当正常细胞STK15表达不容易检测到,但细胞癌变后STK15高表达,结果导致多级纺锤丝形成,染色体不均等分离,遗传物质不稳定,出现肿瘤恶性特征。有研究结果证实STK15可以转化NTKT3细胞,使免疫缺陷裸鼠体内形成肿瘤,STK15是细胞增殖过程的重要标志。本研究发现胃癌MGC803细胞STK15有少量表达,加入0.20 μg/μL和0.50 μg/μL浓度的外泌体后,其表达水平逐渐增高(P<0.05),而细胞增殖活性也逐步提高(P<0.05),胃癌源外泌体携带抗原成分可使胃癌细胞的STK15基因过表达,从而加速肿瘤细胞增殖分裂。研究也提示制备的外泌体充当了“信使”,通过膜分子的相互作用将中心体复制相关蛋白传递给胃癌细胞,导致胃癌细胞增殖加速。
外泌体最近已经成为癌症和其他疾病中潜在有希望的诊断和预后生物标志物[17]。本研究提示肿瘤源的外泌体或经基因修饰后的外泌体可能在肿瘤免疫治疗方面具有更大的生机。有研究表明,在免疫应答下调或诱导免疫耐受过程中外泌体也在发挥作用,如外泌体通过诱导免疫耐受促进了肿瘤细胞的生长[18],这给肿瘤治疗提出新的挑战,需要深入研究。

