调节性T淋巴细胞在HER2阳性乳腺癌免疫机制中的作用*
刘济铭,潘 桃,全 瑶
(重庆市璧山区人民医院急诊科 402760)
乳腺癌是女性最常见的恶性肿瘤之一[1]。人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是乳腺癌患者的重要预后指标,其过度表达会导致肿瘤细胞增殖快,容易复发,约有30%的乳腺癌患者合并HER2基因的过表达和扩增[2]。调节性T淋巴细胞(regulatory T cell,Treg细胞)有别于其他T淋巴细胞,该亚群能参与自身免疫性疾病的发展过程,同时还拥有免疫耐受功能[3]。胃腺癌患者外周血中CD4+CD25+FOXP3+Treg细胞表达明显增加[4]。此外,Treg还通过分泌抑制性细胞因子TGF-β1和IL-10来发挥免疫调节功能[5]。本研究拟观察Treg细胞在HER2阳性乳腺癌患者中的表达情况,并且探讨Treg细胞在HER2阳性乳腺癌中发挥免疫抑制作用的机制。
1 资料与方法
1.1一般资料
1.1.1乳腺癌患者标本来源 标本来源于本院2015年1月至2017年6月HER2阳性乳腺癌患者共70例,所有病例均为女性,年龄26~70岁(中位年龄46岁)。术前均未进行内分泌、化疗、放疗等治疗,所有标本均为荧光原位杂交法(FISH)/显色原位杂交法(CISH)检测后并确定为HER2阳性乳腺癌。
1.1.2试剂来源 刀豆蛋白A(ConA)购自美国Sigma公司,EdU细胞增殖检测试剂盒购自锐博(Ribo)公司,人淋巴细胞分离液购自美国TBD公司;多甲藻黄素-叶绿素蛋白-花青素5.5(peridinin chlorophyll protein-cyanin 5. 5,PerCPCy5.5)标记的抗人CD3,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的抗人CD4,别藻青蛋白(APC)标记的抗人CD25,藻红蛋白(phycoerythrin,PE)标记的抗人FoxP3,人转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)酶联免疫吸附试验(ELISA)试剂盒购自四正柏公司。
1.2方法
1.2.1分组 抽取健康献血者、HER2阳性未转移乳腺癌患者、HER2阳性转移乳腺癌患者的静脉血,用淋巴细胞分离液进行分离,3 000 r/min梯度离心,吸取中间白色层细胞,即为外周血单个核细胞(PBMC),用完全培养基重悬PBMC,以2×105/孔种入96孔细胞培养板中,并将接种细胞分为对照组、HER2阳性未转移乳腺癌组、HER2阳性转移乳腺癌组。各组均加入ConA进行处理。
1.2.2EdU检测各组细胞增殖情况 各组细胞于培养结束前12 h加入EdU试剂,继续培养至60 h;按EdU试剂盒说明书进行操作,最后将收集的细胞加入100 μL Apollo反应液,孵育30 min后弃上清液,加入磷酸盐缓冲液(PBS)后用流式细胞仪进行检测。
1.2.3流式细胞术检测CD4+CD25+FOXP3+Treg细胞的比例 收集培养至60 h的各组细胞,分别取2×105个细胞进行流式细胞学检测。于各组细胞中分别加入5 μL的APC标记的抗人 CD25、FITC 标记的抗人CD4,避光染色30 min,用多聚甲醛固定5 min后加入破膜剂处理7 min,加入5 μL PE 标记的抗人FoxP3,室温避光染色30 min,用PBS重悬后上机检测。
1.2.4实时荧光定量聚合酶链反应(PCR)检测每组细胞FoxP3 mRNA的表达情况 收集培养至60 h的各组细胞,用RNA试剂盒提取各组细胞的RNA,反转录为相应的cDNA,行实时荧光定量PCR检测,扩增条件如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 31 s,循环40次;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。用甘油醛-3-磷酸脱氢酶(GAPDH)为内参,引物由Primier6.0软件设计。GAPDH的上游引物5′-TGA TTC TAC CCA CGG CAA GTT-3′,下游引物:5′-TGA TGG GTT TCC CAT TGA TGA-3′;FoxP3的上游引物:5′-GAG AAG CTG AGT GCC ATG CA-3′;下游引物:5′-AGA GCC CTT GTC GGA TGA T-3′,实验结果使用2-△△Ct方法进行分析。
1.2.5PBMC中树突状细胞(DC)检测 收集各组细胞,PBS洗涤细胞,首先挑选出CD11c和人类白细胞DR抗原(HLA-DR)双阳性的细胞,在此基础上挑选出CD11c和CD123双阳性的细胞,并在此基础上选出CD86阳性的细胞,即为本次研究的DC细胞。于各组细胞内加入5 μL PE-Cy7标记人CD86抗体、PE标记人HLA-DR抗体、APC标记人CD123抗体、FITC标记人CD11c抗体,4 ℃避光孵育30 min。同时设同型对照,孵育完后用PBS洗涤弃上清液,用150 μL PBS重悬细胞,流式细胞仪检测,以未处理的细胞为阴性对照。
1.2.6ELISA检测各组细胞IL-10和TGF-β的表达情况 收集培养至60 h的细胞上清液,冻存于-80 ℃。按ELISA试剂盒说明书分别检测TGF-β和IL-10,用酶标仪检测450 nm吸光度(A)值,读出数据并做出标准曲线,计算出TGF-β、IL-10水平。
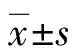
2 结 果
2.1各组细胞EdU检测结果 EdU检测结果显示,经过ConA刺激60 h后,3组细胞均有增殖,说明ConA能显著刺激各组细胞的增殖。与对照组[(1.13±0.32)%]相比,HER2阳性乳腺癌未转移组[(15.86±2.00)%]、HER2阳性乳腺癌转移组[(20.96±1.79)%]细胞增殖明显(P<0.01),与HER2阳性乳腺癌未转移组相比,HER2阳性乳腺癌转移组细胞增殖明显(P<0.01)。见图1。
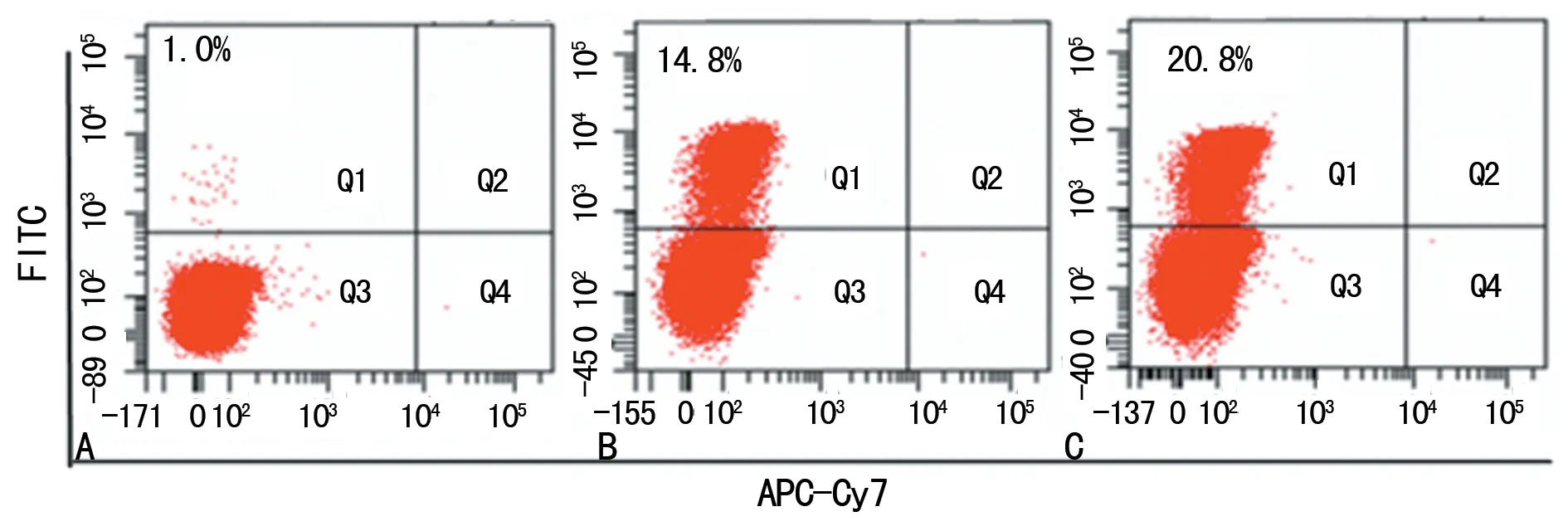
A:对照组;B:HER2 阳性乳腺癌未转移组;C:HER2 阳性乳腺癌转移组
图1流式细胞术检测各组细胞PBMC增殖情况
2.2各组Treg细胞比例变化 与对照组[(2.21±0.37)%]相比,HER2阳性乳腺癌转移组[(7.58 ±0.74)%]和HER2阳性乳腺癌未转移组[(10.59±0.68)%]中CD4+CD25+Foxp3+Treg细胞比例(Q2)占CD4+T细胞比例明显升高(P<0.01);HER2阳性乳腺癌转移组中CD4+CD25+Foxp3+Treg细胞比例(Q2)占CD4+T细胞比例明显高于HER2阳性乳腺癌未转移组(P<0.01)。见图2。
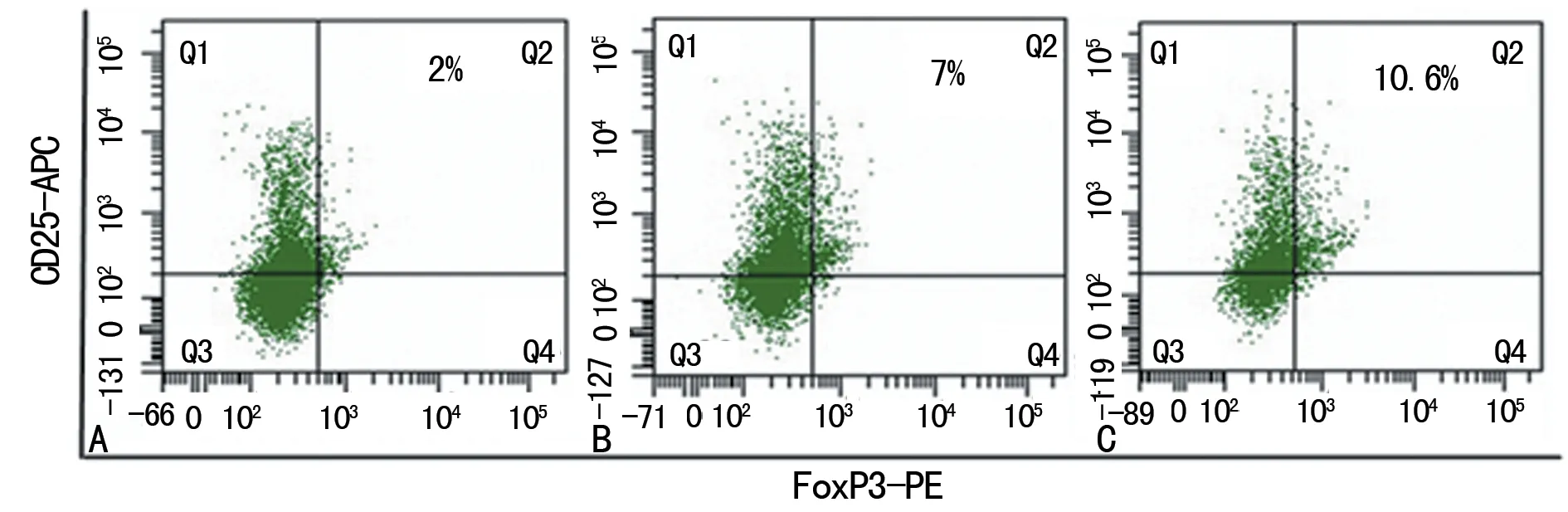
A:对照组;B:HER2 阳性乳腺癌未转移组;C:HER2 阳性乳腺癌转移组
图2流式细胞仪检测CD4+CD25+FOXP3+Treg细胞的比例
2.3FoxP3 mRNA的表达情况 以对照组为参照,HER2阳性乳腺癌未转移组(4.15±0.23,P<0.05)、HER2阳性乳腺癌转移组(7.81±0.41,P<0.01)FoxP3 mRNA的表达水平均显著增高;而HER2阳性乳腺癌转移组FoxP3 mRNA表达水平显著高于HER2阳性乳腺癌未转移组(P<0.05)。
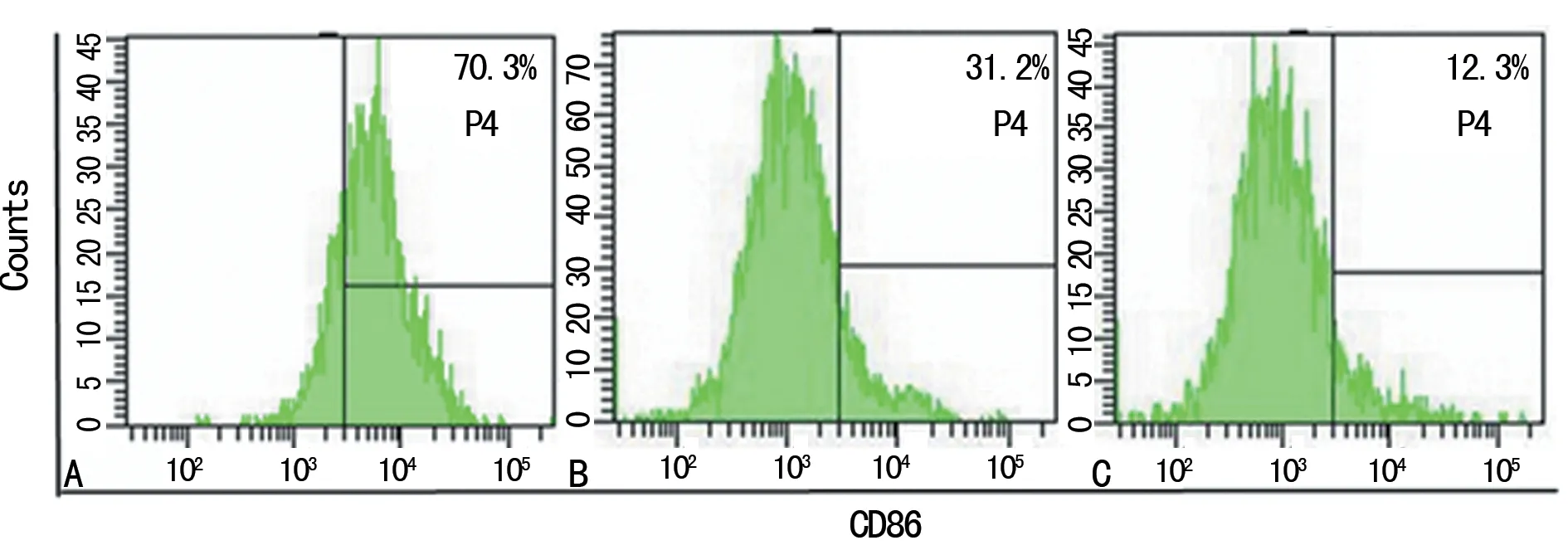
A:对照组;B:HER2 阳性乳腺癌未转移组;C:HER2 阳性乳腺癌转移组
图3各组DC表面分子CD86的表达情况

a:P<0.01,与对照组比较;b:P<0.01,与HER2 阳性乳腺癌未转移组比较
图4各组细胞上清中细胞因子的含量比较
2.4各组DC的检测结果 与对照组[(70.49±1.22)%]相比,HER2阳性乳腺癌未转移组[(30.56±0.82)%]、HER2阳性乳腺癌转移组[(12.00± 0.90)%]CD86分子表达明显降低(P<0.01),与HER2 阳性乳腺癌未转移组相比,HER2 阳性乳腺癌转移组能更显著抑制CD86的表达(P<0.01)。见图3。
2.5各组细胞因子的结果 HER2阳性乳腺癌未转移组、HER2阳性乳腺癌转移组中IL-10、TGF-β的水平显著高于对照组(P<0.01),而HER2阳性乳腺癌转移组高于HER2阳性乳腺癌未转移组(P<0.01)。见图4。
3 讨 论
ConA是一种能在体外能活化初始T淋巴细胞的丝裂原。本研究中采用EdU来检测细胞增殖情况,这种检测方法较磺酸基苯基-3-(4,5-二甲基噻唑)-5-(3-羧甲氧基苯基)-二氢四唑嗡盐(MTS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)更灵敏、快速、准确。本次研究中观察到ConA能明显刺激PBMC的增殖,在HER2阳性乳腺癌中ConA刺激PBMC增殖更快,提示肿瘤细胞生长较正常细胞生长更加迅速,从而导致肿瘤治疗困难,治疗效果不佳。
CD4+CD25+FOXP3+Treg细胞与Th1和Th2型细胞有明显的差异[6],除了具有维持自身免疫耐受、调控免疫反应强度外,还参与诱导移植耐受、肿瘤免疫逃逸的作用。此类细胞表面可表达多种分子,如CD25、Foxp3等[7-8],而Foxp3是Treg细胞的特异性标识,是Treg细胞发挥作用、分化增殖的重要标志,其可以影响细胞的增殖分化及调节功能[7-8]。那么,Treg细胞在HER2阳性乳腺癌中免疫抑制是否发挥作用呢?为了解其中的作用关系,本研究采用流式细胞术标记Treg细胞的CD4、CD25和Foxp3以观察Treg细胞在HER2阳性乳腺癌中是否有免疫抑制作用。本研究发现,ConA能明显增加HER2阳性乳腺癌中Treg细胞的比例,而HER2阳性转移乳腺癌中CD4+CD25+FOXP3+Treg细胞占CD4+T细胞的百分比较HER2阳性未转移乳腺癌更高。实时荧光定量PCR也具有类似的结果:提示HER2阳性乳腺癌患者中Treg细胞的Foxp3基因表达明显升高。因此,可以证实在HER2阳性乳腺癌患者体内Treg细胞水平明显高于健康人,Foxp3基因表达也是明显升高,提示HER2阳性乳腺癌患者的抑制作用是通过上调Treg细胞实现的,且HER2阳性转移乳腺癌较HER2阳性未转移乳腺癌患者体内Treg细胞表达更多,因Treg细胞可以通过两条途径:免疫无能和免疫抑制来使肿瘤细胞发生免疫逃逸作用,从而诱导机体对肿瘤产生免疫耐受或无应答[9],导致肿瘤细胞的疯狂增殖,因此难以实现有效的抗肿瘤疗效,从而降低患者生存率。
DC是专职抗原提呈细胞(APC),功能非常强大,可分为成熟DC和不成熟DC,成熟DC高表达CD-11c、CD80、MHC分子、CD86、CD40等,其抗原提呈作用、促进机体免疫应答的作用强;而不成熟DC则正好与之相反,其可以通过诱导Treg细胞增加或促使效应T细胞转变为无能细胞而引起免疫耐受[10],因此,DC的成熟度与其表面的抗原提呈分子及表达的共刺激分子情况有极大的关系[11]。本研究中选用CD86、CD11c、CD123、组织相容性复合物(MHC)-Ⅱ来检测DC的表型变化,结果发现HER2阳性乳腺癌中DC表面分子CD86表达明显降低,提示HER2阳性乳腺癌可以下调DC的免疫表型,可能通过诱导Treg细胞增加或促使效应T细胞转变为无能细胞而发挥免疫耐受作用。CD4+CD25+FOXP3+Treg还能通过分泌TGF-β1和IL-10(均为抑制性细胞因子)来发挥免疫抑制作用[12-14]。在肿瘤细胞与PBMC共同培养时,通过外源性加入TGF-β1可以诱导Treg细胞的分化增殖,从而发挥肿瘤的免疫逃逸[15]。IL-10能促使初始T细胞增殖分化为Treg细胞,具有强大的抑制细胞因子生成、抑制免疫细胞激活的作用。本次试验中,发现TGF-β1、IL-10与CD4+CD25+FOXP3+Treg细胞的变化相一致,即HER2阳性未转移乳腺癌中TGF-β1、IL-10的分泌增多,而HER2阳性转移性乳腺癌中TGF-β1、IL-10分泌更多,提示HER2阳性乳腺癌而不论是否转移均可分泌抑制性细胞因子而发挥免疫抑制作用,但转移性乳腺癌较非转移性乳腺癌发挥免疫抑制作用更强,转移性乳腺癌患者免疫抑制作用更强,后期生存率更低。
肿瘤的免疫治疗是肿瘤治疗过程中非常重要的手段之一。本研究提示在HER2阳性乳腺癌患者中Treg细胞的表达明显升高,DC的表达明显降低,抑制性细胞因子的表达明显升高,提示HER2阳性乳腺癌患者处于免疫抑制或免疫耐受的状态,从而为既往乳腺癌的免疫治疗效果不佳的原因提供了最新的解释。因此,在以后的研究中,寻找能抑制或清除Treg细胞增殖分化、发挥免疫抑制作用的新方法将成为提高HER2阳性乳腺癌患者免疫治疗效果的新策略。

