树上干杏开花坐果期内源激素变化规律
李少泽,张志刚,程 平,杨 璐,李 宏,任雅琴,王栋梁,王自龙
(1.新疆农业大学林学与园艺学院,乌鲁木齐830052;2.新疆林业科学院,乌鲁木齐830000)
0 引 言
【研究意义】杏(PrunusarmeniacaL)是新疆的重要果树之一,栽培历史悠久,优良品种多[1,2],主栽品种有小白杏、胡安娜杏、色买提杏、树上干杏等。新疆杏树发展经历了从1999年4×104hm2(60万亩)快速发展到2008年的21.33×104hm2(320万亩),又减少到2017年的11.33×104hm2(170多万亩),新疆杏果品质优良、口感好,但多数品种不耐储运,导致了杏树面积的大起大落,影响了杏产业的发展。目前,树上干杏因其耐储运、口感好、品质佳、抗寒性较强等优良特性[3],在新疆伊犁、乌鲁木齐、阿克苏等地区大面积推广,但树上干杏早春花期常受倒春寒的影响,致使其落花、落果,严重影响树上干杏的产量。研究内源激素对树上干杏开花、落花及坐果的调控机制,对树上干花期调控、提高坐果有实际意义。【前人研究进展】植物激素是一种微量的生理活性物质,虽然含量极微但却在植物体内发挥着重要的调控作用[4],植物内源激素的变化可以调节果树的花期和坐果。目前,内源激素动态变化对开花、坐果的调控作用已在多种经济树种上得到验证。赤霉素(GA3)普遍存在于高等植物中,是一种天然的植物激素。冯慧等[5]报道赤霉素能抑制多种果树的花芽分化。Goldschmidt[6]在试验中研究了柠檬的营养枝、混合枝和纯花芽枝的内源激素水平,对比营养枝与纯花芽枝,发现纯花芽枝赤霉素的含量最低而营养枝的赤霉素水平最高,说明了低水平的赤霉素才可以使柠檬的花芽形成;高水平的GA3具有诱导植物开花、打破休眠、促进雄花分化[7];郭辰等[8]研究了东兴金花茶发现,相对低的GA3水平有助于花芽分化,而GA3的增加可以加速开花前和开花期间的花朵转化。在开花期间,高含量的GA3可以减轻生理落果[9];油菜素内酯(BR)的主要生理功能是促进细胞的伸长和分裂[10], 徐如涓等[11]在葡萄、柑橘等花果期,用BR外源激素对其进行处理,发现可以减轻落花落果,有效提高坐果。脱落酸(ABA)普遍存在与植物中,是一种生长抑制性激素,有人指出[12]ABA可以促使枝条生长停止,促进 CTK 类物质、淀粉和糖的积累,有利于生殖生长;而有人指出,脱落酸可以诱导休眠,使生长点的细胞停止生长,不能形成花。曹尚银等[13]研究苹果花芽分化发现高ABA含量促进成花,低含量的ABA则会抑制成花;郭辰等[8]发现,在开花前,东兴金花茶花花芽从营养生长转变为生殖生长的重要因素之一是一定低浓度的ABA,而处在末花期时,则会使得脱落酸含量大幅增加,子房膨大幼果形成时,ABA则处于较低的水平。脱落酸及其浓度的高低在花芽或果实发育的不同时期中起的作用不尽相同。【本研究切入点】内源激素在果树各生育期作用较复杂,单一内源激素的含量变化,各内源激素之间的相互拮抗等,会影响植物生理变化。研究树上干杏开花期坐果期内源激素变化规律。【拟解决的关键问题】通过测定树上干杏开花期、坐果期3种内源激素含量的动态变化,研究内源激素对树上干杏开花、落花以及坐果的影响。为喷施外源激素推迟杏树花期,避开早春霜冻,提高杏树产量提供理论依据。
1 材料与方法
1.1 材 料
试验地点位于新疆乌鲁木齐县水西沟镇绿野园林公司(E87.496°、N43.479°),此地全年平均温度5~7℃,≥10℃的有效积温2 812℃左右,年均无霜期为179 d,平均年降水量208.4 mm,年蒸发量2 616.9 mm,年日照2 813.5 h,试验区面积 0.8 hm2,株行距 4 m × 6 m,树龄10年,东西行向,树形为疏散分层型,试验地管理水平中等。于试验地中选择树势一致、无病虫害的树上干杏树12株样株作为试验材料,并对其编号1~12。
1.2 方 法
1.2.1 物候期观测
2018年3月30日至6月25日,对树上干杏进行物候观测记录。每2 d观测1次开花期、坐果期,并记录各物候期时间。表1
表1 物候期观测标准[14]
Table 1 Biotemperature observation standard
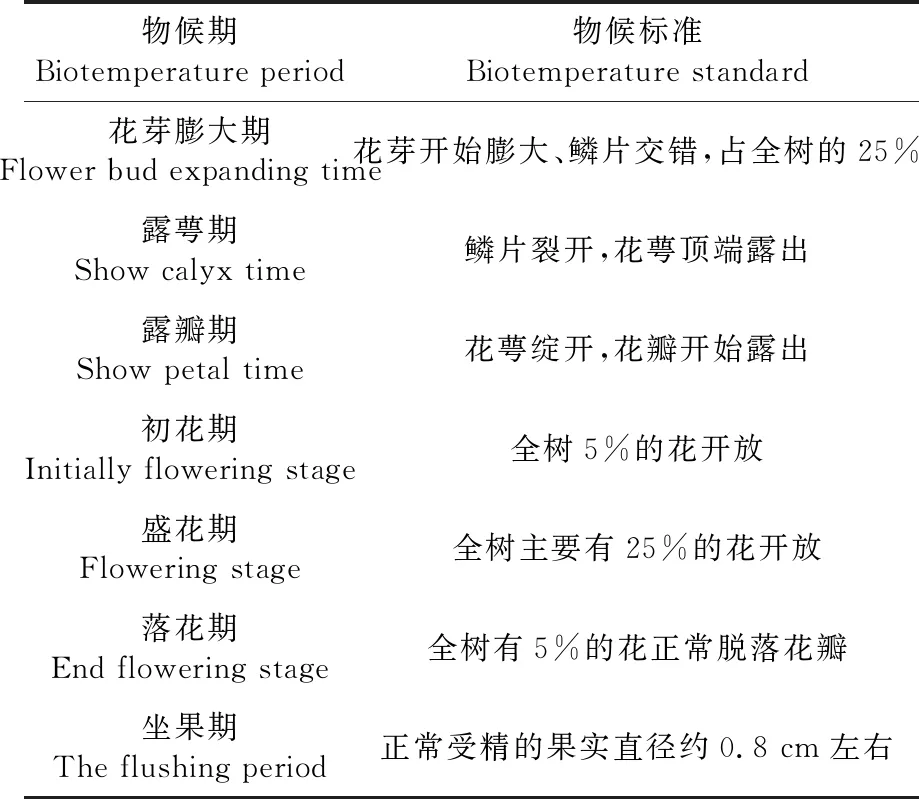
物候期Biotemperature period物候标准Biotemperature standard花芽膨大期Flower bud expanding time花芽开始膨大、鳞片交错,占全树的25%露萼期Show calyx time鳞片裂开,花萼顶端露出露瓣期Show petal time花萼绽开,花瓣开始露出初花期 Initially flowering stage全树5%的花开放盛花期Flowering stage全树主要有25%的花开放落花期End flowering stage全树有5%的花正常脱落花瓣坐果期 The flushing period正常受精的果实直径约0.8 cm左右
1.2.2 采样
采样在2018年的3月30日~6月4日进行。分别在3月30日、4月2日、4月5日、4月9日、4月13日、4月17日、4月20日、4月23日、4月25日、4月26日、4月27日、4月28日、4月29日、4月30日、5月1日、5月3日、5月5日、5月17日、5月26日、6月4日采样,共采样20次。
将编好的1~12样株平均分成3组,每组4株样株,在样株的中上部的东、西、南、北 4 个方向进行采样,花芽膨大期每组采集花芽4 g,露萼期、露瓣期每组分别采集花蕾4 g,初花期、盛花期、落花期每组分别采集花朵4 g,坐果期每组采集幼果30 g。采得后立刻置于冰袋上,装入布袋,将采摘的样品分组编号Ⅰ、Ⅱ、Ⅲ,并放在液氮中保存。
1.2.3 激素提取和检测
采用酶联免疫吸附测定法(ELISA)参照该试剂盒说明书进行检测,测定样品中赤霉素(GA3)、油菜素甾醇(BR)、脱落酸(ABA)的含量。所用试剂盒均购自于上海润裕生物公司,用酶标仪(XJCK-SB-051 型)在450 nm处测定吸光度值。
酶联免疫吸附测定试剂盒检测方法:将待处理的4 g样品置于小研钵里,用液氮将样品研碎,立刻称取1 g所需样品放入离心管中并加入3 mL的PBS(Sigma-Aldrich)用分散机(XJLK-SB-020)充分匀浆。将离心管中的匀浆液放入离心机(5 000转)离心10 min,取上清液待测。此时进行标准品的稀释,在酶标包被板上分别设空白孔、标准孔、待测样品孔,将50 μL的标准品加入包被板上的标准孔中;将40 μL的样品稀释液加入待测样品孔中,之后加入10 μL的待测样品,样品加入底部后,晃动混匀贴好封板膜,并置于37℃的温育箱温育30 min,之后取下密封膜,弃去液体、并晾干,用清洗液填充每个孔,静置30 s,然后丢弃,重复5次,然后拍干。除了空白孔外,向每个孔中加入酶标试剂50 μL,再次温育后甩干再次洗涤后拍干。向每个孔中加入着色剂A 50 μL和B 50 μL,通过摇动轻轻混合,并在37℃下避光10 min后,向每个孔中加入50 μL终止溶液,若为蓝色则为终止反应。测量可在反应终止后的15 min内进行,具体步骤如下:各孔的吸光度用450 nm波长测量(以空白孔调零)。
1.3 数据处理
在Excel工作表中计算,标准浓度为横坐标,相应的OD值为纵坐标,绘制标准品线性回归曲线。运用SPSS 19.0,Excel 2003进行数据分析及图的绘制。
2 结果与分析
2.1 树上干杏物候期
研究表明,树上干杏的花芽于3月底开始膨大;至4月9日进入露萼期;4月20日进入露瓣期;4月25日开始有5%的花朵开放,即进入初花期;4月27日进入盛花期;5月3日进入落花期,有5%的花正常脱落花瓣;5月14日进入坐果期,正常受精的果实约为0.8 cm左右。表2
表2 树上干杏开花坐果期物候
Table 2 Phenological phase of reproduction growth process in apricot trees

物候期花芽膨大期 露萼期露瓣期初花期盛花期落花期 坐果期Biotem Flower bud Show Show Initially Flowering End ThePeratureexpandingcalyx timepetal time flowering stageflowering flushingPeriod stagestage period时间 3月30日 4月9日4月20日4月25日4月27日 5月3日 5月14日Date ~4月9日~4月20日~4月25日 ~4月27日~5月3日 ~5月8日~6月4日
2.2 树上干杏开花坐果期内源激素含量的变化规律
2.2.1 内源激素GA3含量的动态变化
研究表明,在树上干杏开花坐果的过程中,花芽膨大期至盛花期GA3含量呈上升趋势,花芽膨大期初期(3月30日)GA3含量最低194.12 pg/mL,盛花期末期(5月1日)达到最高值511.17 pg/mL,升高了163.3%,内源激素GA3含量在194.12 ~511.17 pg/mL,对花芽的发育起促进作用。此后盛花期末期(5月1日)至落花期末期(5月5日)含量有所下降,由511.17 pg/mL下降至435.50 pg/mL,下降了14.8%,5月1~3日GA3含量急剧下降12.8%,5月3~5日GA3含量下降2.3%,盛花期末期至落花期GA3含量下降速率快,花朵内GA3含量快速下降是导致花朵衰败的原因之一,GA3的含量保持在相对高的水平会减少花朵衰败时间。坐果期时,果实内的GA3含量呈下降趋势,坐果初期(5月17日)GA3含量为360.61 pg/mL ,6月4日GA3含量下降至313.67 pg/mL,GA3含量下降有利于果实的发育,坐果期末期(6月4日)GA3含量仍高于花芽膨大初期(3月30日),GA3含量仍然保持较高水平状态,幼果发育可能比开花所需的GA3含量少,但较高水平(313.67 ~360.61 pg/mL)的GA3仍对幼果的发育起重要作用。自休眠解除后,花芽内的GA3含量一直是处于不断变化中的,GA3在杏树开花、坐果中起着重要的作用。图1

图1 赤霉素(GA3)含量动态变化
Fig.1 dynamic change of gibberellin (GA3) content
2.2.2 内源激素BR含量的动态变化
研究表明,从花芽膨大期到盛花期,BR含量虽有波动,但总体呈上升趋势,主要在露萼期和盛花期出现峰值,从花芽膨大期(3月30日)69.6 ng/L上升至露萼期(4月17日)的125.8 ng/L,上升了80.7%。整个盛花期BR含量总体较高,于盛花末期(5月1日)达到153.65 ng/L,这表明在125.8~153.65 ng/L范围内的内源激素BR对花芽发育以及成花具有促进作用。从盛花末期(5月1日)的153.65 ng/L下降至落花末期(5月5日)的118 ng/L,下降了22.96%,从落花末期至坐果期BR含量缓慢下降,坐果期初期(5月17日)还保持较高BR含量水平111.45 ng/L,后期降至低水平74.31 ng/L。坐果期初期幼果的发育可能还需要较高浓度的BR。图2

图2 油菜素甾醇(BR)含量动态变化
Fig.2 dynamic change of Brassinol (BR) content
2.2.3 内源激素ABA含量的动态变化
研究表明,ABA含量在树上干杏开花坐果中,从花芽膨大期(3月30日)72.71 μg/L至盛花期(5月1日)190.26 μg/L虽有波动,总体为上升趋势,高含量的ABA可能会促进杏花开放衰老。花芽膨大期初期(3月30日)花芽内的ABA含量最低72.71 μg/L,整个花芽膨大期ABA含量在72.71~105.12 μg/L,处于较低水平,花芽膨大期较低含量的ABA可能利于花芽萌动。ABA含量于盛花末期(5月1日)上升为190.26 μg/L,上升了161.67%。盛花末期ABA含量达到峰值,这可能与花瓣即将脱落有关。盛花末期后,ABA含量开始下降,落花期仍保持着较高的含量,落花期花朵内ABA含量在181.79 ~168.92 μg/L,这可能与落花期促进花瓣的脱落有关。落花期末期至坐果期ABA含量迅速下降,由168.92 μg/L下降至103.73 μg/L,下降了38.59%,整个坐果期ABA含量处于较低水平状态(103.73~110.71 μg/L),坐果期低含量的ABA可能利于幼果生长发育。图3
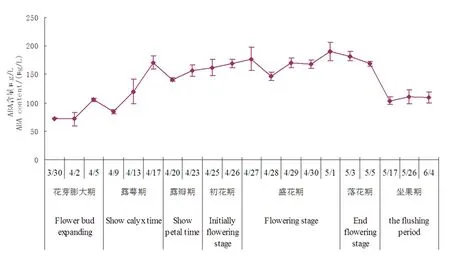
图3 脱落酸(ABA)含量动态变化
Fig.3 dynamic change of Abscisic acid (ABA) content
2.3 树上干杏开花坐果期内源激素相关性
研究表明,在开花坐果期间,树上干杏花芽、花蕾、花朵以及果实中ABA与BR含量、ABA与GA3含量、BR与GA3含量极显著相关,相关系数分别为0.883、0.934、0.896。表3
表3 树上干杏开花坐果期不同内源激素含量相关性
Table 3 Correlation analysis of endogenous hormone content in apricot tree during flowering and fruiting

相关系数Correlative coefficient 脱落酸 ABA 油菜素内酯BR 油菜素内酯BR0.883**赤霉素GA30.934**0.896**
注:**代表激素含量在 0.01 水平上显著相关(P<0.01)
Note:The **indicate correlation significance at theP=0.01 levels of probability,respectively
3 讨 论
GA3含量会随着花芽膨大、花蕾的形成以及开花逐渐升高,在194.12~511.17 pg/mL,对花芽的发育起促进作用。Hoad[15]认为高GA3会抑制果树成花,主要是通过加速淀粉水解、促进α-淀粉酶形成实现的;然而前人发现[8],在开花前和开花期间GA3上升能加速成花的转变。研究与后者的试验结论一致。研究中,盛花末期至落花期,花朵内GA3含量快速下降可能是导致花朵衰败的原因之一,GA3的含量保持在相对高的水平会减少花朵衰败时间。赵莉等[16]研究发现,通过外施GA3改变了内源GA3的含量,促进花蕾的增长,GA3的含量在花衰败之后明显上升,延缓了植物的衰老进程。与研究试验结论一致。研究中GA3含量下降有利于果实的发育,幼果发育可能比开花所需的GA3含量少,但较高水平(313.67 ~360.61 pg/mL)的GA3仍对幼果的发育起重要作用。吴尚等[17]报道高含量的GA3能够促进细胞分裂和伸长,从而使果实在坐果期迅速膨大。郭辰等[8]发现促进坐果以及果实生长的重要因素之一是末花期后幼果内高含量的GA3。在研究果实生长发育期时的库尔勒香梨内源激素含量变化规律时,发现在果实发育初期GA3含量最高,有利于幼果坐果[18]。牛自勉等[19]在研究苹果花期前后子房内源激素的变化时发现,丹霞品种苹果从初花期至盛花期GA3含量升高,盛花期达到最大,坐果期子房内GA3含量有所下降,但比初花期GA3含量高,由此认为盛花及坐果期苹果子房中较高的GA3含量有助于子房坐果。研究结果与以上研究者的试验结论一致。
研究发现,在125.8~153.65 ng/L内源激素BR对花芽发育以及成花具有促进作用。蔡华等[20]研究发现,油菜素内酯的生理活性极强,高浓度时起抑制作用,反之则作用强。李计红[21]研究发现,内源油菜素内酯对拟南芥的成花具有促进作用。试验结果与李计红的研究一致,BR对树上干杏花芽发育及成花有促进作用。BR参与了开花调控,并且是影响植物开花重要激素。研究还发现,坐果期初期较高含量(111.45 ng/L)的BR利于幼果的发育。Symons[22]发现BRs参与到葡萄的成熟中。Montoya[23]报道在番茄果实发育的早期阶段,内源性BRs的浓度较高。Vardhini[24]表明外源性BRs已经被证明可以促进番茄果实的成熟。研究结果与以上研究者的试验结论一致。
研究中,低含量(72.71 ~105.12 μg/L)的ABA可能利于花芽萌动,杏花的开放衰老可能需要高浓度的ABA,低水平(103.73 ~110.71 μg/L)的ABA可能利于幼果生长发育。ABA能提高蛋白质水解酶RNase活性、加速蛋白质和核酸降解[25],脱落酸作为一种植物生长抑制型激素,会加速植物组织的衰老,主要通过减缓或者抵消GA3来实现[17]。脱落酸对成花的作用意见不一,有研究指出ABA处于高水平时会抑制花形态的建成[26],但其他研究者报道[27],毛竹花的发育需要成花期高含量的ABA,杨途熙等[28]报道,花盛开之后ABA含量快速升高与杏花的衰老有关;研究与后者得到的结论相同。还有研究表明,仁用杏花芽从休眠至觉醒,脱落酸含量的降低是必不可少的条件,幼果期时低水平的ABA则会利于幼果生长发育[29]。与试验结果一致。
植物内源激素在开花、坐果等生理过程中并不是孤立作用,而是相互调节、相互影响、相互作用的。试验结果表明,树上干杏开花坐果期ABA与BR含量、ABA与GA3含量、BR与GA3含量呈极显著相关。由此可见,内源激素之间是相互影响、相互制约的,并在树上干杏体内共同起着重要的调控作用。但以上几种激素是如何在树上干杏体内起平衡作用的,除激素间的相互作用外,可能更受到环境因素的影响,有待于进一步探讨。
4 结 论
树上干杏开花、落花以及坐果期的发育过程受GA3、BR以及ABA含量的影响。研究认为,树上干杏开花坐果的过程中,内源激素GA3含量在194.12~511.17 pg/mL,对花芽的发育起促进作用,较高水平(313.67~360.61 pg/mL)的GA3对幼果的发育起重要作用;内源激素BR在125.8~153.65 ng/L对花芽发育以及成花具有促进作用,坐果期初期较高含量(111.45 ng/L)的BR可能利于幼果的发育;高含量的ABA可能会促进杏花开放衰老,低含量(72.71~105.12 μg/L)的ABA可能利于花芽萌动,低水平(103.73~110.71 μg/L)的ABA可能利于幼果生长发育。树上干杏花芽、花蕾、花朵以及幼果中ABA与BR、ABA与GA3、BR与GA3含量都呈极显著相关关系,在树上干杏体内相互调节相互影响。

