慢性萎缩性胃炎胃黏膜Runx3基因及蛋白表达与幽门螺杆菌感染的关系研究
夏 韬,丁西平,朱 敏,王 卫
(1.安徽医科大学附属省立医院消化内科,合肥 230001;2.安徽省庐江县人民医院消化内科 231500)
胃癌是常见的消化道恶性肿瘤之一,严重威胁人类的健康。近年来,随着人们良好饮食习惯的形成及幽门螺杆菌(Hp)的根除,胃癌的发病率有所下降,但发病率及病死率仍高居全球前列[1-2]。据2015年中国癌症数据报告,我国胃癌的发病率和病死率在恶性肿瘤中均高居第2位[3]。胃癌发生受多种因素影响,并且是一个多阶段的逐步发展过程。在慢性萎缩性胃炎(CAG)的基础上发生的肠上皮化生和不典型增生等变化被称为胃癌前病变,其是否进一步发展为胃癌还受Hp感染、环境和遗传等多因素的影响[4-5]。Runx3基因作为目前公认的抑癌基因,近年来研究认为其甲基化与胃癌及CAG密切相关[6]。因此,通过研究CAG患者胃黏膜中Runx3基因表达与Hp感染的关系,对了解二者在CAG中的相互影响具有重要意义。本研究使用实时荧光定量聚合酶链反应(PCR)及免疫蛋白印迹法(Western blot)分析了CAG患者根除Hp前后胃黏膜中Runx3基因及蛋白表达的变化,现报道如下。
1 资料与方法
1.1一般资料 选取2016年1月至2017年6月于庐江县人民医院及安徽省立医院经胃镜检查及病理证实的CAG患者80例作为研究对象。纳入标准:(1)年龄大于或等于18岁;(2)首次诊断患者;(3)经胃镜及病理证实为中、重度CAG;(4)签署知情同意书。排除标准:(1)自身免疫性胃炎、胃食管反流病、消化道溃疡及消化道出血等消化道其他良性病变患者;(2)消化道恶性肿瘤患者;(3)近期(3个月)内服用叶酸、维生素B12的患者;(4)有胃部手术史的患者;(5)伴有严重心脑血管病、全身感染性疾病及脏器衰竭的患者;(6)妊娠期、 哺乳期或准备受孕的妇女;(7)不愿按要求完成研究或有精神病的患者。本研究经安徽省立医院医学伦理委员会批准,患者均签署知情同意书。根据Hp感染情况,将53例Hp阳性患者作为观察组,将27例Hp阴性患者作为对照组。两组间性别、年龄、体质量指数(BMI)、吸烟及饮酒比例等一般资料比较,差异均无统计学意义(P>0.05),见表1。
1.2仪器与试剂 主要仪器:凝胶图像分析仪(珠海黑马医学仪器有限公司),Tprofessional Thermocycler PCR仪(美国Biometra公司),实时定量PCR仪(美国ABI公司),紫外分光光度计(日本日立公司),低温高速离心机、电子天平、移液器(德国Eppendorf公司)。主要试剂:组织基因组提取试剂盒(天根生化科技有限公司)、Wizard DNA Clean-Up System试剂(美国Promega公司)、PCR引物(大连宝生物工程有限公司)、甲基化酶 SssI(美国New England Biolabs公司),Taq plus PCR Master-Mix、SYBR Green Ⅰ Mastex、Runx3小鼠抗人单抗(美国Santa Cruz公司),羊抗鼠IgG(北京中杉金桥生物技术有限公司)。
1.3试验方法 (1)胃镜检查:纳入者均由固定的内镜医师行胃黏膜取材,根据病变部位选取胃黏膜进行活检病理检查及液氮保存。病理检查由两名病理科医师进行读片确定。(2)诊断:CAG的诊断参照《中国慢性胃炎共识意见》[4],包括内镜诊断和病理诊断;确诊以病理诊断为依据。(3)Hp检验:采用国际公认的金标准C13尿素呼气试验。(4)Hp根治:参照《第4次全国幽门螺杆菌感染处理共识报告》[7]推荐方案,根治2个月后复查C13尿素呼气试验。(5)Runx3基因甲基化检测:对提取DNA进行亚硫酸氢钠修饰和纯化,然后进行甲基化特异性PCR(MSP)及电泳分析。(6)Runx3基因mRNA的表达:提取胃镜所取胃黏膜组织mRNA,反转录合成cDNA;设标准品校正和去离子水(ddH2O)代替DNA模板的阴性对照,每份样品均同时做2个平行复孔进行qPCR。以β-actin为内参,并对所有样品进行均一化处理。(7)Runx3蛋白表达的测定:提取总蛋白后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,Runx3检测条带44×103,内参甘油醛-3-磷酸脱氢酶(GAPDH)条带36×103。Image J软件分析条带灰度值,目的蛋白相对表达水平=目的蛋白条带灰度值/内参条带灰度值。

2 结 果
2.1Hp感染对中、重度CAG患者胃黏膜Runx3基因甲基化的影响 MSP法检测CAG患者胃黏膜Runx3基因甲基化情况,见图1。对照组中8例患者胃黏膜Runx3基因甲基化,阳性率为29.6%(8/27);观察组中28例患者胃黏膜Runx3基因甲基化,阳性率为52.8%(28/53)。两组Runx3基因甲基化阳性率比较,差异有统计学意义(χ2=3.890,P=0.049)。

表1 两组一般资料比较

MA:标记物;MP:甲基化阳性对照;UP:非甲基化阳性对照;C:空白对照;1:观察组重度CAG患者胃黏膜标本;2:对照组中度CAG患者胃黏膜标本;3:观察组中度CAG患者胃黏膜标本;4:对照组重度CAG患者胃黏膜标本
图1 MSP法检测CAG患者胃黏膜Runx3基因甲基化
2.2Hp感染对中、重度CAG患者胃黏膜Runx3基因mRNA和蛋白表达的影响 观察组患者胃黏膜Runx3 mRNA表达水平低于对照组,差异无统计学意义(t=1.233,P=0.221)。亚组分析显示,观察组中度CAG患者胃黏膜Runx3 mRNA表达水平低于对照组中度CAG患者,差异无统计学意义(t=0.552,P=0.583);观察组重度CAG患者胃黏膜Runx3 mRNA表达水平低于对照组重度CAG患者,差异有统计学意义(t=2.226,P=0.036),见表2。观察组CAG患者胃黏膜Runx3蛋白表达水平低于对照组,差异有统计学意义(t=2.143,P=0.035),见图2。亚组分析显示,观察组中度CAG患者胃黏膜Runx3蛋白表达水平低于Hp阴性的对照组中度CAG患者,差异无统计学意义(t=1.468,P=0.148);观察组重度CAG患者胃黏膜Runx3蛋白表达水平低于对照组重度CAG患者,差异有统计学意义(t=2.240,P=0.035),见表2。

表2 两组Runx3 mRNA及蛋白表达水平比较
*:P<0.05,与对照组比较
2.3根除Hp对中、重度CAG患者胃黏膜Runx3基因甲基化、mRNA及蛋白表达的影响 根除Hp治疗后2个月复查,观察组53例CAG患者中44例转阴,9例仍为阳性(中度CAG患者6例、重度CAG患者3例)。观察组中44例Hp转阴CAG患者根除Hp前有22例Runx3基因甲基化阳性,根除后6例转为阴性。与根除前比较,根除Hp后中重度CAG患者胃黏膜Runx3 mRNA表达水平升高,差异有统计学意义(t=-3.249,P=0.002);亚组分析显示,与根除前比较,根除Hp后中度及重度CAG患者胃黏膜Runx3 mRNA表达水平升高,差异均有统计学意义(t=-2.460、-2.534,P=0.020、0.028),见表3。与根除前比较,根除Hp后中重度CAG患者胃黏膜Runx3蛋白表达水平升高,差异有统计学意义(t=-3.166,P=0.003),见图3;亚组分析显示,与根除前比较,中度及重度CAG患者胃黏膜Runx3蛋白表达水平升高,差异均有统计学意义(t=-2.164、-2.724,P=0.038、0.020),见表3。

表3 CAG转阴患者根除Hp前后Runx3 mRNA及蛋白表达水平比较
*:P<0.05,与根除前比较
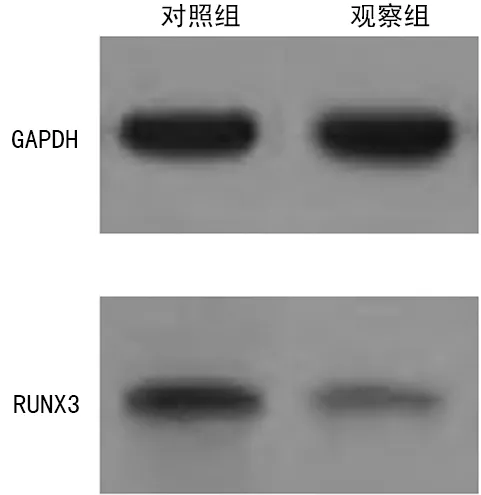
图2 Western blot检测Runx3蛋白在对照组及观察组CAG患者胃黏膜组织中的表达
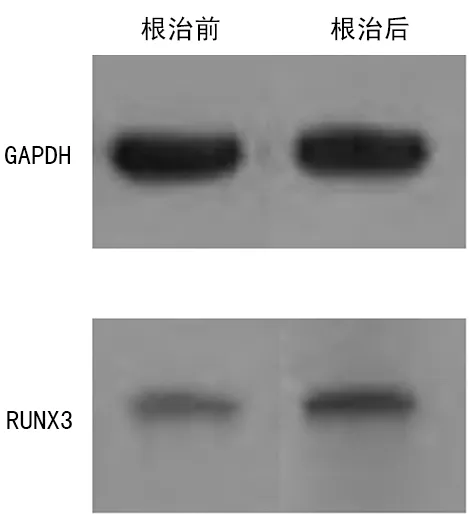
图3 Western blot检测Runx3蛋白在中重度患者根治前后胃黏膜组织中的表达
3 讨 论
现代医学观点认为,临床多数疾病的发生是由遗传因素和环境因素共同作用的结果[8]。如胃癌的发生、发展与遗传学、表观遗传学、Hp感染及饮食习惯的相关性已得到学术界的公认,而且基因多态性及表观遗传学与Hp感染的交互作用研究已有报道[9-10]。JIA等[11]研究显示,Hp感染所致胃黏膜的慢性炎症可增加患者的遗传基因易感性,能够导致胃黏膜抑癌基因的异常甲基化,在促进胃癌的发生过程中具有重要作用。HONG等[12]报道,Hp感染可通过在胃癌前病变中的炎性反应和低胃酸环境,使伴有白细胞介素-1β(IL-1β)基因多态性的患者更易发生胃癌。CAG的发生、发展亦是基因与环境共同及相互作用的结果。不良环境和不健康饮食习惯的暴露可通过多种途径影响抑癌基因的表达,包括自身基因多态性及表观遗传学的改变,进而共同促进CAG及胃癌的发生、发展。慢性胃炎特别是CAG的发生、发展过程受多种因素影响,反复或持续Hp感染、不良饮食习惯等均为促进及加重胃黏膜萎缩和肠化生的潜在因素,可导致CAG的患病风险增高并增加癌变的可能[13-15]。
Runx3基因为Runx家族的重要成员之一,目前研究表明Runx3启动子区CpG岛的异常甲基化可直接导致基因静默和表达缺失引起基因和蛋白表达的降低,进而导致其抑癌作用的失活[16-17]。近年有研究发现,Runx3基因的抑癌作用源于它是转换生长因子-β(TGF-β)信号转导通路中的转录因子,在Runx蛋白的参与下,通过Smad复合物与靶位点的结合,TGF-β/Smad复合物才能从细胞质转入细胞核内的功能靶点,发挥调控细胞生长发育、凋亡和恶性转化等作用[18]。Runx3基因内含2个高度保守的CpG岛,其甲基化水平可影响基因表达;当Runx3 表达失活时,影响TGF-β信号通路的转导,可以参与胃癌等多种疾病的发生[19-21]。CAG为胃癌的癌前病变,了解胃癌的多个相关因素,如Hp及Runx基因在CAG中的相互作用具有一定的临床意义。黄唯等[22]的研究已证实,CAG患者存在Runx3基因的表达下调,且Runx3基因表达水平降低与CAG及胃癌的发生、发展存在一定的相关性。
有研究认为,Runx3 mRNA及蛋白的表达与CAG的严重程度有关,而甲基化可能是导致Runx3蛋白表达下调的主要原因[23-24]。DNA甲基化主要发生在富含CpG岛的启动子区域,通过该区域的甲基化将直接阻碍转录因子与启动子结合,从而使基因不能转录或转录水平降低[25]。因此,重度CAG患者胃黏膜Runx3基因及蛋白表达下降可能与CAG患者Runx3基因高甲基化影响mRNA的表达有关。CHOI等[26]研究提示,胃癌伴Hp感染患者胃黏膜Runx3基因的表达水平低于Hp阴性者,考虑与Hp感染可能诱使Runx3基因甲基化,从而导致抑癌基因Runx3失活,下调Runx3基因的表达。本研究显示,观察组患者胃黏膜Runx3 mRNA及蛋白表达水平低于对照组;亚组分析提示,观察组中度CAG患者胃黏膜Runx3蛋白表达水平低于对照组中度CAG患者,而mRNA的表达水平在观察组与对照组中度CAG患者间无明显差异;观察组重度CAG患者胃黏膜Runx3 mRNA及蛋白表达水平均低于对照组重度CAG患者,与黄唯等[22]研究结果相似。提示CAG患者胃黏膜Runx3 mRNA及蛋白的表达不但与CAG的严重程度相关,而且与Hp感染密切相关;尤其在重度CAG伴Hp感染患者中,胃黏膜Runx3 mRNA及蛋白的表达下降明显。研究结果显示,观察组患者Runx3基因甲基化率高于对照组,因此在CAG伴Hp感染患者尤其是重度CAG伴Hp感染患者中,Hp感染可能在原有Runx3基因甲基化基础上诱导甲基化进一步加重,引起抑癌基因Runx3失活,导致Runx3基因及蛋白表达的下调。Runx3基因及蛋白低表达和Hp感染在胃癌发生、发展过程中有协同作用;因此,在Hp感染的CAG患者中应予以积极根除Hp治疗。
本研究显示,在CAG伴Hp感染患者尤其是重度CAG伴Hp感染患者中,Hp感染可能诱导甲基化进一步加重,导致抑癌基因Runx3 mRNA及蛋白表达均明显下降。根除Hp治疗后2个月,中、重度CAG患者胃黏膜Runx3 mRNA及蛋白表达水平明显升高;亚组分析显示,中度及重度CAG患者胃黏膜Runx3 mRNA表达水平均升高;且根除Hp治疗后部分CAG患者Runx3基因甲基化阳性转为阴性。研究结果进一步证实Hp感染可能通过诱导甲基化引起抑癌基因Runx3失活,导致Runx3基因及蛋白低表达;而在根除Hp后,可逆转Hp感染所致的抑癌基因Runx3 mRNA及蛋白表达下降。因此,在对Hp感染的CAG患者应积极予以根除Hp治疗,可以消除Hp在CAG发展中作用及激活抑癌基因Runx3的抑癌作用,其具体调节机制有待于进一步研究。

