2 型糖尿病性骨质疏松症患者骨转换标志物的改变
张露露
(上海市长寿街道社区卫生服务中心全科门诊 上海200060)
随着人们饮食习惯、生活方式和人口结构的变化,糖尿病已经成为我国最常见的内分泌系统疾病之一。根据国际糖尿病联合会(International Diabetes Federation,IDF)的最新数据,截止到2017年,全世界糖尿病患者总人数约为4.25 亿,大概每11 个成人中就有1 人患有糖尿病。在中国成年人群体(20~79 岁)中糖尿病患者的比例高达10.91%,我国糖尿病患者总人数高居全球首位,而这一比例到2045 年将可能增高到11.56%,且与患者年龄因素有关[1]。相关临床研究指出,2 型糖尿病患者并发糖尿病性骨质疏松症(Diabetic Osteoporosis,DOP)的风险明显高于健康人群[2]。DOP 是糖尿病在骨骼系统的重要并发症之一,是指糖尿病并发单位体积内骨量减少,骨组织微结构改变,骨强度降低、脆性增加等易发生骨折的一种全身性、代谢性骨病,其致残、致死率高,严重影响了患者的生存质量[3]。骨转换标志物[4]是骨组织本身的代谢(合成与分解)产物,对判断骨转换类型和反映骨丢失速率都具有较高的灵敏度和特异性,是骨质疏松症早期诊断、疗效评估和骨折风险评估的重要指标。本研究旨在通过回顾性对比分析2 型糖尿病患者和正常体检人群的骨转换标志物与骨密度之间的关系,为2 型糖尿病患者骨质疏松症的诊断和治疗提供参考依据。现报道如下:
1 资料与方法
1.1 一般资料 选取2014 年1 月~2017 年12 月本院收治的226 例2 型糖尿病患者作为糖尿病组,均符合《中国2 型糖尿病防治指南(2013 年版)》[5]中的诊断标准。糖尿病组男89 例,女137 例;年龄40~76 岁,平均年龄(56.9±7.3)岁;糖尿病病程3~22 年,平均病程(10.3±7.6)年。选择同期在我院进行体检的160 例健康成年人作为对照组,其中男72 例,女88 例;年龄40~68 岁;平均年龄(57.6±4.8)岁。两组患者的一般资料相比较,差异无统计学意义,P>0.05,具有可比性。本研究经我院医学伦理委员会审批通过。
1.2 排除标准 合并骨转移瘤、风湿性关节炎、甲旁亢、甲亢、甲减等及其他影响钙磷代谢疾病者;存在严重肝肾功能障碍者;使用糖皮质激素、维生素D和钙剂等影响钙磷代谢药物者;病例资料不全者。
1.3 对照组纳入标准 经空腹及餐后血糖检查无糖尿病者;无肝、肾、骨关节病者;无其它内分泌疾病者。
1.4 研究方法
1.4.1 临床资料收集 收集两组研究对象的年龄、性别、身高、体质量、体质量指数(Body Mass Index,BMI)、病程和空腹血糖(FPG)等一般资料。
1.4.2 骨转换标志物及相关指标的检测 采集患者静脉血及尿液样本,测定血液样本中糖化血红蛋白(HbAlc)、血钙、骨钙素(Osteocalcin,OC)、骨碱性磷酸酶(Bone Alkaline Phosphatase,BALP)和Ⅰ型前胶原氨基末端前肽(Procollagen ⅠN-terminal Peptide,PⅠNP)和Ⅰ型胶原蛋白C 末端交联肽(Type ⅠCollagen Protein C-terminal Crosslinking Peptide,CTX)和尿液中吡啶啉(Pyridinoline,PYD)。
1.4.3 骨密度测定 采用美国GE 公司生产的Lunar-Prodigy 双能X 线骨密度仪(DXA),分别测定两组研究对象的正位腰椎(L2~L4)、股骨颈及Ward's区的骨密度(BMD)。
1.5 统计学处理 数据处理采用SPSS20.0 统计学软件,计数资料采用%表示,计数资料采用χ2检验,计量资料以(x±s)表示,两组计量资料比较采用student-t 检验,多组计量资料比较采用t 检验;两变量间相关性采用直线相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较 糖尿病组与对照组的年龄(t=1.061,P=0.289 3)和性别比例(χ2=1.217,P=0.270)相比较,差异均无统计学意义,P>0.05;但糖尿病组的体质量指数(t=2.866,P=0.004 4)、空腹血糖(t=19.47,P<0.000 1)和糖化血红蛋白(t=9.467,P<0.000 1)均明显高于对照组,差异均有统计学意义,P<0.01。见表1。
表1 两组临床资料比较

表1 两组临床资料比较
注:与对照组比较,*P<0.01。
组别 n 男(例) 女(例) 年龄(岁) 体质量指数(kg/m2) 病程(年) 糖化血红蛋白(%) 空腹血糖(mmol/L)对糖照尿组病组1 26 2 0 6 7 82 9 8 18 3 7 5 57 6..6 9±±4 7..8 3 2 2 3 5..9 8±±5 7..3 1* 10.3±7.6 5 8..8 7±±1 3..7 6* 4 1.03.±8±1.42.1*
2.2 不同年龄组骨密度测定值比较 糖尿病组与对照组的腰椎(L2~L4)骨密度减低相比较,差异无统计学意义,与年龄的相关性也不明显。糖尿病组患者的股骨颈骨密度明显低于对照组,且随年龄的增长,骨密度逐渐减低(40~49 岁:t=2.262,P=0.026;50~59 岁:t=3.334,P=0.001 2;≥60 岁:t=3.231,P=0.001 5);Ward's 区骨密度也呈现出相同的趋势(40~49 岁:t=2.232,P=0.028 0;50~59 岁:t=2.234,P=0.027 3;≥60岁:t=2.326,P=0.0213)。见表2 和图1。
表2 不同年龄组骨密度测定值比较(g/m2

表2 不同年龄组骨密度测定值比较(g/m2
注:与对照组比较,*P<0.05,#P<0.01。
?

图1 不同年龄组骨密度比较
2.3 2 型糖尿病患者骨转换标志物与骨转换标志物比较 糖尿病组与对照组相比较,血清钙更低(40~49 岁:t=12.89,P<0.000 1;50~59 岁:t=6.310,P<0.000 1;≥60 岁:t=5.693,P<0.000 1),血清BALP更 低(40~49 岁:t=6.305,P <0.000 1;50~59 岁:t=5.536,P<0.000 1;≥60 岁:t=5.512,P<0.000 1),OC含量更低(40~49 岁:t=1.287,P=0.201 4;50~59 岁:t=2.179,P=0.031 3;≥60 岁:t=5.017,P<0.000 1),而血清PⅠNP(40~49 岁:t=4.881,P<0.000 1;50~59 岁:t=5.294,P<0.000 1;≥60 岁:t=4.980,P<0.000 1)及CTX(40~49 岁:t=137.2,P <0.000 1;50~59 岁:t=182.0,P<0.000 1;≥60 岁:t=175.3,P<0.000 1)的含量更高,同时尿中PYD(40~49 岁:t=5.387,P<0.000 1;50~59 岁:t=4.868,P<0.000 1;≥60 岁:t=4.244,P<0.000 1)含量也更高,且与研究对象的年龄有关。见表3。
表3 不同年龄组骨转换标志物比较
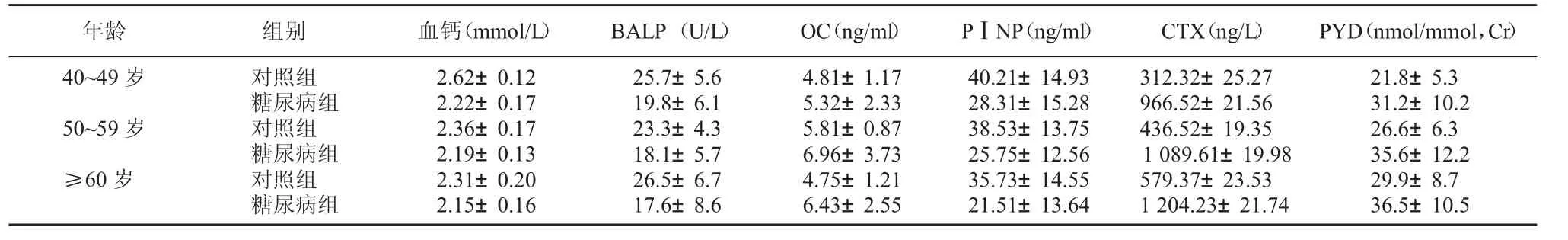
表3 不同年龄组骨转换标志物比较
年龄 组别 血钙(mmol/L) BALP(U/L) OC(ng/ml) PⅠNP(ng/ml) CTX(ng/L) PYD(nmol/mmol,Cr)40~49 岁 对照组2.62±0.1225.7±5.64.81±1.1740.21±14.93312.32±25.2721.8±5.3糖尿病组2.22±0.1719.8±6.15.32±2.3328.31±15.28966.52±21.5631.2±10.2 50~59 岁 对照组2.36±0.1723.3±4.35.81±0.8738.53±13.75436.52±19.3526.6±6.3糖尿病组2.19±0.1318.1±5.76.96±3.7325.75±12.561 089.61±19.9835.6±12.2≥60 岁 对照组2.31±0.2026.5±6.74.75±1.2135.73±14.55579.37±23.5329.9±8.7糖尿病组2.15±0.1617.6±8.66.43±2.5521.51±13.641 204.23±21.7436.5±10.5
2.4 糖尿病组转换标志物平均值与骨密度平均值之间的相关性 2 型糖尿病患者股骨颈和Ward's区骨密度平均值与骨转换标志物的平均值有较好的相关性;且Ward's 区的r 值普遍高于股骨颈;腰椎(L2~L4)骨密度平均值与骨转换标志物间的相关性并不显著。见表4。
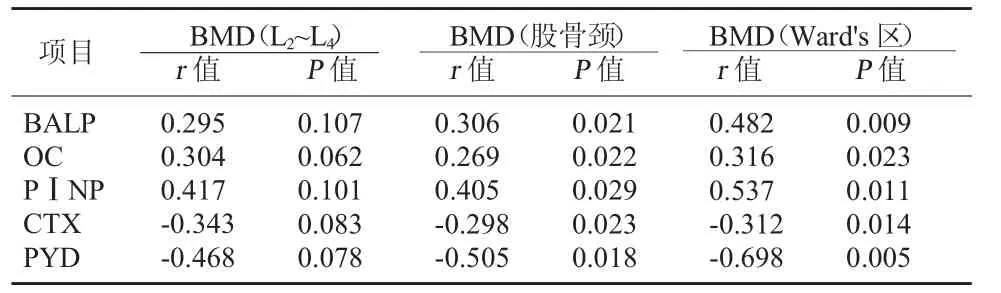
表4 糖尿病组骨转换标志物平均值与骨密度平均值之间的相关性
3 讨论
骨质疏松症(OP)是一种以低骨量和骨组织微结构破坏为特征,导致骨骼脆性增加、易发生骨折的全身性疾病[6],而糖尿病性骨质疏松症属于继发性骨质疏松症,是糖尿病引起骨骼系统的重要并发症之一。目前,双能X 线骨密度测量仪是临床上广泛应用于诊断骨质疏松症的重要手段,其灵敏度和精确度都比较高,但对骨质疏松症的诊断存在一定的滞后性。本研究结果显示,2 型糖尿病患者股骨颈及Ward's 区的骨密度均明显低于同龄体检人群,说明2 型糖尿病是骨质疏松症的一个高危因素,且与糖尿病病程呈负相关,提示高血糖是骨量降低的一个重要原因[7]。本研究中,2 型糖尿病患者腰椎(L2~L4)骨密度与正常对照组的差异并不明显,这可能与中老年人群腰椎退行性变引起的腰椎骨质增生有关[8]。
骨转换标志物分为骨形成和骨吸收两大类。血清BALP 不受非骨组织影响,非常稳定。血清PⅠNP和CTX 为IDF 推荐的用于诊断骨质疏松的较敏感指标。而CTX 不受饮食的影响,直接由尿液排出,是目前认为较敏感、特异、无创伤的骨吸收标志物。BALP 由成骨细胞分泌,是成骨细胞成熟和具有活性的标志,可反映骨形成的状态[9~10]。OC 是由成骨细胞合成和分泌的一种特异性非胶原蛋白,是成熟骨细胞的标志物,能够反映成骨细胞的功能和骨质矿化活性。Ⅰ型胶原是唯一同时存在骨与软骨中的胶原类型,其代谢产物PⅠNP[11]和CTX[12]分别反映了Ⅰ型胶原的合成和分解速率,间接反映了骨转换情况,其中PⅠNP 升高提示合成速率加快,而CTX 升高提示分解速率加快。PYD 在胶原分子间构成横向连接,起到稳定Ⅰ型胶原的作用[13],Ⅰ型胶原吸收后,大部分PYD 经肾脏排泄,可反映骨吸收的状态。
本研究结果显示,2 型糖尿病患者的血钙和BALP 显著降低,表明成骨细胞的活性受到了抑制,OC 的增高可能是患者骨量减低后机体通过反馈调节引起的反射性增高。胰岛素通过成骨细胞表面存在的胰岛素受体,可促进胰岛素样生长因子和PTH等对成骨细胞的作用而增加成骨细胞的活性[14]。但2 型糖尿病患者胰岛素会绝对或相对减少,引起成骨细胞活性降低,血清BALP 下降。长期高血糖可导致渗透性利尿,使钙、磷、镁等从尿中大量排出,使机体处于负钙平衡,骨形成减低;同时机体负钙平衡会刺激甲状旁腺素(PTH)分泌[6],为了维持血钙浓度,骨吸收增强,Ⅰ型胶原分解加强而合成受到抑制,导致PⅠNP 水平明显下降,CTX 水平明显增高,尿中PYD 排泄也明显增高,而骨吸收增强很可能是OC 水平反射性增高的原因。本研究还表明,年龄是引起骨质疏松症的一个重要因素,高龄糖尿病患者罹患骨质疏松症的几率和严重程度要明显高于低龄人群。糖尿病患者骨转换标志物与骨密度测定结果有很好的相关性,尤其是与股骨颈和Ward's 区的骨密度测定结果有很好的相关性。因此,测定老年患者骨密度时建议优先测量股骨颈和Ward's 区,可排除退变性骨质增生对测量结果的影响[8]。
综上所述,在诊断2 型糖尿病性骨质疏松症时,骨转换标志物与骨密度测量有很好的拟合性,可早期预测2 型糖尿病患者的骨质疏松程度,并可用于监测骨质疏松症的治疗效果。与Lofman 等[15]的研究结果基本一致。

