C1q/TNF相关蛋白3减轻氧化应激诱导的间充质干细胞衰老
张正斌,朱丽雯,谭延振,冯攀,张冰,吴岩,易蔚,王晓明,孙阳*
(空军军医大学第一附属医院:1老年病科,3心血管外科,西安 710032;2陕西中医药大学第二临床医学院,咸阳 712000)
间充质干细胞(mesenchymal stem cells,MSCs)具有自我更新和多向分化的潜能,广泛用于组织损伤修复[1]。动物实验显示MSCs对心肌梗死(myocardial infarction,MI)疗效显著,但是临床实验表明自体干细胞移植治疗MI疗效不佳[2]。原因可能是动物实验中分离制备的是年轻供体来源的MSCs,而临床实验中使用的干细胞多为MI患者自体采集的衰老MSCs。而衰老干细胞增殖、分化、分泌等生物学功能下降[3],因此,如何延缓衰老是提高MSCs修复能力的关键。C1q/TNF相关蛋白3(C1q/TNF-related protein 3,CTRP3)是新发现的脂肪因子,参与肝脏脂质代谢、缺血心肌保护、细胞增殖分化等生理病理进程[4,5]。Hou等[6]证实CTRP3通过激活磷酯酰肌醇-3-激酶/蛋白激酶(phosphatidyl inositol-3-kinase/protein kinase B,PI3K/AKT)通路减轻缺血缺氧诱导的MSCs凋亡。本研究拟通过过氧化氢(hydrogen peroxide,H2O2)诱导构建MSCs衰老模型,探讨CTRP3对衰老MSCs抗损伤的作用并初步探讨其机制。
1 材料与方法
1.1 MSCs的培养
小鼠来源的P5代骨髓MSCs购于广州赛业(MUBMX-01001),细胞复苏后接种于含10%胎牛血清及1%双抗(链霉素和青霉素)的间充质干细胞专用培养基(MUBMX-90011,广州赛业)中,置于37℃、5% CO2细胞培养箱中培养。
1.2 CTRP3蛋白的制备
CTRP3蛋白的制备方法同前[4]。CTRP3基因由GENEWIZ(江苏,中国)产生,并克隆到原核蛋白表达载体pET30a(Novagen,Merck)中。将表达载体转移到BL21(DE3)细菌中。BL21(DE3)/pET30a-CTRP3在LB培养基中生长并在37℃下振荡3 h。向培养基中加入异丙基-BD-硫代半乳糖苷(终浓度:1 mmol/L)。将溶液在16℃下振荡4~5 h,并以5 000转/min离心。通过HisTrap HP纯化蛋白质,除去内毒素后将蛋白质脱盐浓缩。
1.3 MSCs衰老模型的建立
MSCs在完全培养基中培养,待细胞融合至70%,换无血清培养基培养,同时加入不同浓度的H2O2处理2~4 h,然后进行衰老指标检测(细胞活力和β-半乳糖苷酶染色)。
1.4 CCK8测细胞活性
用CCK8试剂盒(C008-3,七海生物)测定不同处理组细胞的增殖活性。将MSCs接种于96孔板,待细胞融合至70%,换无血清培养基,不同条件处理后,向每孔中加入10 μl CCK-8液,避光孵育2~4 h后,使用酶标仪在450 nm波长测量吸光度值(A450 nm)。
1.5 细胞β-半乳糖苷酶染色
250 μmol/L H2O2处理MSCs,2 h或4 h后,行β-半乳糖苷酶染色,试剂购于碧云天(C0602)。吸去细胞培养液,PBS轻洗后加入固定液固定20 min。吸去固定液,加入染色液(配置:β-Gal染色液A,B,C分别10,930,10 μl;X-Gal 溶液50 μl),37℃水浴过夜,避光。在光学显微镜下计数,β-半乳糖苷酶染色阳性的细胞为衰老细胞,显示蓝色。
1.6 MSCs成脂成骨诱导分化实验
成骨、成脂诱导分化试剂盒购于广州赛业(MUBMX-90021,MUBMX-90031)。成骨诱导实验时,P6代MSCs接种于预包埋0.1%明胶的6孔板中,置于37℃、5% CO2培养箱中培养。当细胞融合度达到70%,加入 2 ml成骨诱导分化完全培养基。每3 d换液1次,3周后,待细胞形态明显改变时,用茜素红染色。1%盐酸(Sigma-Aldrich)抽提茜素红后420 nm酶标仪读数定量 (A420 nm)。成脂诱导时,将MSCs置于37℃,5% CO2的培养箱中培养。细胞融合度达到100%时,加入MSCs诱导分化培养基A液。诱导3 d后,吸走A液,加入培养基B液。24 h后吸走B液,换回A液。A液和B液交替作用5次后,继续用B液维持培养7 d后用油红O染色分析。PBS洗涤干燥后,200 μl的异丙醇抽提脂肪滴,酶标仪510 nm波长测量吸光度值(A510 nm)。
1.7 Western blotting分析细胞蛋白表达水平
细胞裂解液、蛋白酶抑制剂和磷酸酶抑制剂按8∶1∶1混合配置细胞裂解缓冲液。裂解20 min后12 000转/min,4℃离心20 min,吸取上清液加入1/4体积上样缓冲液后煮沸10 min。蛋白样品在12%SDS-PAGE凝胶上电泳,然后转移到PVDF膜。5%脱脂牛奶孵育2 h。BAX(CST,2772),Bcl2(CST,3498),cleaved caspase 3(CST,9661)和GAPDH(CMCTAG,AT0002)一抗(1∶1 000)4℃过夜,TBST洗涤后,抗兔或抗鼠二抗(1∶5 000)(中杉金桥,ZB-2301,ZB-2305)室温孵育2 h。化学发光法显色,Image lab软件分析条带灰度值,GAPDH作为内参照。
1.8 RNA提取和RT-PCR
PBS轻洗细胞后,按每10 cm2加入1 ml TRIzol,用RNA提取试剂(Invitrogen)提取总RNA,具体操作同说明书。经NanoDrop2000分光光度仪测定RNA浓度后用反转录试剂(TAKARA)将RNA反转录成cDNA。以cDNA为模板扩增P16,P21和SIRT1基因。引物序列见表1。

表1 RT-PCR引物序列Table 1 RT-PCR primer suquence
1.9 统计学处理
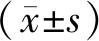
2 结 果
2.1 H2O2呈浓度依赖性地抑制MSCs增殖活性
为探讨氧化应激对MSCs增殖活性的影响,分别用200、400、600 μmol/L H2O2处理MSCs 4 h和2 d后观察细胞形态和增殖活性。光镜下显示对照组MSCs立体感强,形态均一,呈梭形,且生长密度大;而高浓度H2O2处理组(600 μmol/L)MSCs的形态皱缩变圆,密度明显降低,细胞活力仅为对照组的40%(P<0.05),且培养基中有较多漂浮细胞,表明600 μmol/L H2O2处理显著增加细胞死亡(图1)。CCK8实验结果证实H2O2处理呈浓度依赖性地抑制MSCs增殖活性,其中200 μmol/L H2O2抑制细胞增殖达约70%,与对照组比较,差异有统计学意义(P<0.05;图1),可作为进一步探讨诱导MSCs衰老的最佳浓度。
2.2 成功建立衰老模型
200 μmol/L H2O2处理MSCs 2 h或4 h后,完全培养基继续培养48 h,光镜下观察细胞形态,CCK8实验检测细胞活性,β-半乳糖苷酶染色阳性细胞比例显示细胞衰老。与对照组相比,200 μmol/L H2O2处理2 h组细胞密度变小,单个细胞形态变大,β-半乳糖苷酶染色阳性细胞比例增加(P<0.05;图2)。与200 μmol/L H2O2处理2 h组相比,200 μmol/L H2O2处理4 h,细胞活性显著下降,衰老进一步加重(P<0.05;图2)。
2.3 CTRP3抑制MSCs的衰老
进一步明确CTRP3蛋白是否会抑制MSCs衰老进程。200 μmol/L H2O2处理4 h诱导MSCs衰老的同时,在培养基中加入CTRP3(终浓度为5 μg/ml)。4 h后撤去H2O2,继续5 μg/ml CTRP3孵育MSCs 48 h。应用β-半乳糖苷酶染色。与H2O2处理组相比,CTRP3明显降低衰老细胞比例(P<0.05;图3)。CCK8实验显示,与对照组比较,200 μmol/L H2O2处理4 h后细胞增殖显著受到抑制(P<0.05)。进一步实验发现,5 μg/ml的CTRP3可促进衰老MSCs增殖,2组差异有统计学意义 (P<0.05;图3)。
2.4 CTRP3增强衰老MSCs的分化潜能
MSCs经成骨诱导分化,茜素红染色,光镜下观察各组均有明显的矿盐沉积,H2O2处理组矿盐沉积数量较对照组显著减少。而与H2O2处理组相比,CTRP3处理显著增加衰老MSCs的矿盐沉积(图4)。诱导为成骨细胞的MSCs经1%盐酸抽提后在420 nm波长读数,结果显示H2O2处理显著降低MSCs的成骨分化能力(与对照组比较,P<0.05;图4)。而CTRP3处理改善了衰老MSCs向成骨细胞分化的能力(与H2O2组比较,P<0.05)。MSCs经成脂诱导分化,油红染色后光镜下观察到大量脂滴形成(图4)。酶标仪读数结果发现,H2O2组MSCs成脂能力较对照组显著降低(P<0.05),CTRP3处理可增强衰老MSCs向脂肪细胞分化的能力(与H2O2组比较,P<0.05;图4)。

图1 不同浓度H2O2处理对MSCs增殖活性的影响Figure 1 Effect of different doses of H2O2 on proliferation of MSCs (×100)MSCs:mesenchymal stem cells.Compared with CTRL group,*P<0.05;compared with 200 μmol/L H2O2 group,#P<0.05; compared with 400 μmol/L H2O2 group,△P<0.05.

图2 H2O2处理诱导MSCs衰老模型的建立Figure 2 Establishment of MSCs aging model by H2O2 inductionA:×400;B:×100.MSCs:mesenchymal stem cells.Compared with CTRL group,*P<0.05;compared with 2 h group,#P<0.05.

图3 CTRP3处理对MSCs的衰老及增殖活性的影响Figure 3 Effect of CTRP3 on aging and proliferation of MSCs (×400)CTRP3:C1q/TNF-related protein 3;MSCs:mesenchymal stem cells. Compared with CTRL group,*P<0.05;compared with H2O2 group, #P<0.05.
2.5 CTRP3抑制衰老MSCs凋亡
细胞凋亡影响MSCs生物学活性的发挥。接着,我们探讨CTRP3是否对衰老引起的MSCs凋亡有抑制作用。TUNEL染色显示,与对照组相比,H2O2组TUNEL阳性细胞比例显著增多(P<0.05),CTRP3处理可显著减少MSCs凋亡(与H2O2组比较,P<0.05;图5)。Western blotting实验结果显示H2O2组cleaved caspase 3表达水平增高(P<0.05),Bcl2/BAX表达水平降低(P<0.05)。而CTRP3降低衰老细胞cleaved caspase 3水平(P<0.05),升高Bcl2/BAX (P<0.05;图6),证实衰老组MSCs凋亡较对照组加重,CTRP3能抑制衰老MSCs的凋亡。

图4 CTRP3对衰老MSCs成骨成脂分化情况的影响Figure 4 Effect of CTRP3 on osteogenesis and adipogenesis of MSCs(×100)A:osteogenesis;B:adipogenesis.MSCs:mesenchymal stem cells;CTRP3:C1q/TNF-related protein 3.Compared with CTRL group,*P<0.05;compared with H2O2 group,#P<0.05.

图5 CTRP3抑制衰老MSCs的凋亡Figure 5 Inhibition of CTRP3 on apoptosis of MSCsCTRP3:C1q/TNF-related protein 3;MSCs:mesenchymal stem cells.Compared with CTRL group,*P<0.05;compared with H2O2 group,#P<0.05.

图6 CTRP3处理对衰老MSCs cleaved caspase 3, BAX和Bcl2等凋亡相关蛋白表达的影响Figure 6 Effect of CTRP3 on expression of cleaved caspase 3,BAX and Bcl2 of MSCsCTRP3:C1q/TNF-related protein 3;MSCs:mesenchymal stem cells.Compared with CTRL group,*P<0.05;compared with H2O2 group,#P<0.05.
2.6 CTRP3下调P16和P21表达,上调SIRT1的表达
P16和P21通过上调衰老相关蛋白调控衰老进程,而SIRT1抑制衰老。P16、P21和SIRT1通路已被证实参与H2O2诱导MSCs衰老进程中[7],为进一步明确CTRP3对衰老MSCs的保护机制,我们通过RT-PCR检测P16、P21通路和SIRT1表达激活情况。结果发现,与衰老组相比,CTRP3处理组MSCsP16和P21mRNA水平显著下降(P<0.05),而SIRT1mRNA表达水平显著上调(P<0.05;图7)。表明CTRP3可能通过抑制P16和P21通路,激活SIRT1信号通路延缓MSCs衰老进程。

图7 CTRP3对MSCs衰老相关基因SIRT1,P16和P21 mRNA表达的影响Figure 7 Effect of CTRP3 on expression of SIRT1,P16 and P21 mRNA of MSCsMSCs:mesenchymal stem cells.Compared with CTRL group,*P<0.05;compared with H2O2 group,#P<0.05.
3 讨 论
本研究通过建立氧化应激诱导的细胞早衰模型,研究CTRP3对衰老MSCs增殖、凋亡和分化等表型的影响。结果证实CTRP3能延缓MSCs衰老,P16、P21通路和SIRT1通路可能是其发挥作用的关键信号通路。
近年来,MSCs移植对心肌梗死的疗效一直受到争议。缺血、炎症、氧化应激等病理条件常常诱导MSCs衰老凋亡,严重影响了MSCs的疗效[7,8]。有研究证实移植MSCs在损伤部位仅仅存活数周到数月,细胞有限的存活期通常与不良的局部微环境诱导细胞早衰和凋亡有关[9]。体外H2O2诱导MSCs早衰模型常用于模仿体内氧化应激因素诱导移植MSCs衰老过程[10,11]。本实验发现H2O2以浓度依赖的方式抑制MSCs增殖。高浓度H2O2直接引起细胞死亡,而低浓度H2O2处理的MSCs表现为细胞变大且扁平、细胞增殖能力下降及β-半乳糖苷酶染色阳性细胞比例增加,表明低浓度H2O2可成功诱导MSCs衰老模型的建立,这与先前的研究报道一致[11]。
CTRP3是CTRP家族中重要的成员,具有显著的调节糖脂代谢、抗炎和促血管生成等生物学作用[5]。最近的几篇研究陆续报道CTRP3可通过抗氧化应激途径,减轻氧化应激对心脑等重要靶器官的损害,体外实验表明CTRP3通过激活AMPK通路减轻氧化应激诱导的细胞损伤和凋亡[12,13]。另外,外源性给予CTRP3能激活PI3K/Akt通路,抑制缺血缺氧诱导的MSCs凋亡[6]。我们的实验进一步研究了CTRP3对氧化应激诱导的MSCs衰老进程的影响。通过β-半乳糖苷酶染色实验发现CTRP3显著降低氧化应激条件下衰老细胞的比例。进一步检测衰老细胞生物学功能和凋亡情况,发现CTRP3促进衰老MSCs增殖,增强衰老MSCs分化能力,抑制衰老MSCs凋亡,提示CTRP3可能是新的抗衰老和凋亡分子。P16可通过抑制CDK4/CDK6与cyclin D结合,P21则通过与多种cyclin-CDK复合物结合,使细胞增殖停止于G1期,从而导致细胞衰老[14]。SIRT1信号通路的失活亦可促进细胞衰老,损害细胞功能[11,15]。我们用RT-PCR的方法初筛了几个衰老相关通路,发现CTRP3上调SIRT1mRNA表达水平,下调P16mRNA和P21mRNA表达水平。因此,我们推测,CTRP3发挥抗MSCs衰老的作用可能依赖于P16、P21和SIRT1通路。

