卷叶贝母根高效诱导愈伤组织及快速增殖研究
(1.成都大学 药学与生物工程学院, 四川 成都 610106; 2.成都列五中学, 四川 成都 610007)
卷叶贝母(FritillariacirrhosaD.Don)属于百合科多年生草本植物,生长在海拔2 800~4 700 m的高山灌丛或草地中[1],喜在冷凉气候条件下生长,具有耐寒、喜湿、怕高温、喜荫蔽的特性。卷叶贝母具有清热润肺,化痰止咳之功效,用于肺热燥咳,干咳少痰,阴虚劳嗽,咯痰带血等症状,以卷叶贝母为原料的中成药达100种以上[2],卷叶贝母是稀有的治疗咳嗽的良药。近年来,由于卷叶贝母价格昂贵,加之无计划的盲目采挖,自然资源已日趋枯竭,其价格也不断上涨。
随着组织培养技术在药用植物上的广泛应用,其已成为保护濒临灭绝的野生药用资源和生产替代品的关键手段[3]。组织培养技术生长周期短,繁殖率高,摆脱了大自然中四季、昼夜的变化以及灾害性气候的不利影响,且条件均一,对植物生长极为有利,便于稳定地进行周年培养生产。卷叶贝母植物的入药部位是其鳞茎,笔者按照2015年药典方法测定了野生卷叶贝母植株的鳞茎和根器官中的总生物碱含量,发现鳞茎中的总生物碱含量为0.068%,而根中的总生物碱含量为0.071%,比鳞茎稍高。因此本实验采用卷叶贝母的根进行愈伤组织诱导和增殖培养研究,以期获得生长快、有效成分含量高的优质愈伤组织,为进一步开展卷叶贝母大规模细胞培养生产药用成分提供良好的材料,从而很好地缓解卷叶贝母药材资源短缺问题,同时也可为卷叶贝母的遗传转化工作奠定基础。
1 材料与方法
1.1 材 料
本实验材料来自四川省阿坝自治州的野生卷叶贝母植株根,经成都大学中药鉴定室鉴定为卷叶贝母(FritillariacirrhosaD.Don)。
1.2 方 法
1.2.1外植体不同消毒时间的筛选
选取生长2年以上、生长状况良好的卷叶贝母植株根,先用浓度为0.03%的升汞液将根表面冲洗干净后,放在18 ℃的条件下阴干4 h,再放在超净台上,采用在每100 mL的0.1%升汞溶液中滴加0.7 mL浓度为0.4%聚乙二醇辛基苯基醚溶液进行消毒处理,并用无菌水洗5次,最后用无菌滤纸吸干材料表面的水分,在超净台上进行消毒的时间分别为1,3,5,7,9 min,编号为A 1~A 5。
将消毒后的根,接种于MS+6-BA 2.0 mg·L-1+NAA 0.3 mg·L-1培养基上,各培养基中添加蔗糖30 g·L-1、琼脂5.5 g·L-1,pH值为6.0,在温度15 ℃,每天光照6 h和光照强度为1 800 lx的条件下培养(下同),培养30 d后统计愈伤组织的染菌率和启动率。
1.2.2不同激素配比对根愈伤组织诱导的影响
切取已消毒的卷叶贝母根尖1.5 cm,接入改良的MS基本培养基(无机物硝酸氨的含量减半)中,并且添加细胞分裂素异戊烯基腺嘌呤(2 iP)的浓度范围设定为0.5~1.5 mg·L-1,生长素萘乙酸(NAA)的浓度范围设定为0.3~1.0 mg·L-1,共配制12种培养基,编号分别为B 1~B 12,培养30 d后统计愈伤组织的诱导情况。
1.2.3不同激素配比对根愈伤组织增殖的影响
选取培养的质地较紧密和颜色为白色的愈伤组织,切成0.6 cm3团块大小转接入B 5+多效唑1.0 mg·L-1+活性炭1.5 mg·L-1的基本培养基中,再附加生长素2,4-D 的浓度范围为1.0~4.0 mg·L-1,细胞分裂素KT 0.1~1.0 mg·L-1,共配制10种培养基,编号分别为C 0~C 9,在温度18 ℃,每天光照3 h和光照强度为400 lx的条件下增殖培养,培养30 d后统计愈伤组织的增殖情况。
1.2.4实验数据统计
染菌率(%)=(染菌外植体数/接种外植体总数)×100%;
启动率(%)=(启动的外植体数/接种外植体总数)×100%;
诱导率(%)=(产生愈伤组织的外植体数/接种外植体总数)×100%;
愈伤组织增殖倍数=收获的重量/接种的重量。
2 结果与分析
2.1 外植体不同消毒时间的研究
在组织培养过程中,对外植体进行有效的消毒处理是非常重要的。本实验针对卷叶贝母植株根生长在土壤中的状况,选择先采用浓度为0.03%的升汞液冲洗根表面后,再在超净台上采用改良的升汞液进行不同时间的消毒处理,其实验结果见表1。
表1 不同消毒时间对卷叶贝母根外植体的消毒影响
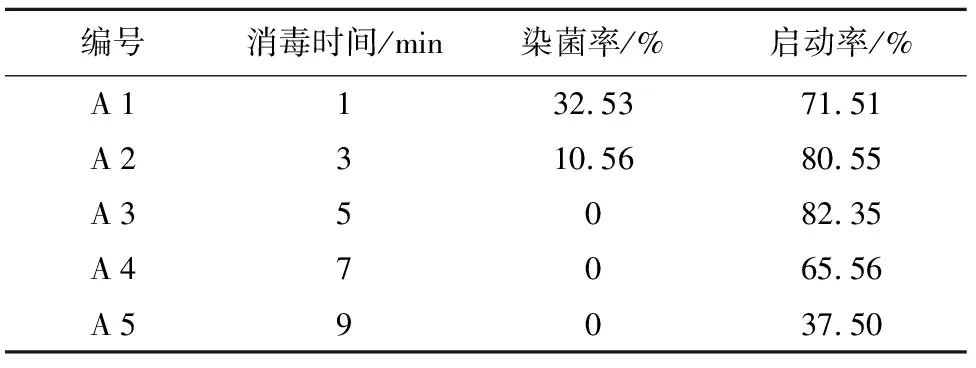
编号消毒时间/min染菌率/%启动率/%A1132.5371.51A2310.5680.55A35082.35A47065.56A59037.50
注:接种30 d后统计数据,以根体积产生膨大计为启动的外植体。
从表1可以看出,采取不同的消毒时间对卷叶贝母根外植体的染菌率和启动率都有显著影响。从观察根外植体的染菌状况来看,随着A 1到A 5消毒时间的逐渐递增,外植体的染菌率表现出逐渐降低的趋势,其中在A 3至A 5的消毒时间段,根外植体都没有出现染菌,接种30 d后统计的染菌率都为0%;而从卷叶贝母根外植体的启动状况来看,随消毒时间由A 1到A 5的逐渐递增,根外植体的启动率呈先上升后下降的趋势,其中在A 3的消毒时间内,根外植体的启动率最高达到82.35%,而在A 5的消毒时间根外植体的启动率最低,仅为37.50%,并且通过观察实验发现,当消毒时间达到5 min时,根外植体呈现出明显的升汞中毒现象,外植体质地变得松软,生长也停滞。这是因为升汞HgCl2为重金属盐类,其作用机制是HgCl2与微生物蛋白质的巯基结合而使微生物失活,但同时对植物也会造成伤害[4]。因此,从降低卷叶川贝根外植体的染菌率和提高其启动率两方面来综合考虑,应选取A 3即5 min的消毒时间,在此条件下外植体的污染率为0%,而启动率为82.35%。
2.2 不同激素配比对根愈伤组织诱导的影响
选取表1中的A 3即5 min消毒时间对卷叶贝母根进行消毒处理后,接种在含有不同浓度异戊烯基腺嘌呤(2 iP)和NAA的组合的12种培养基中,培养30 d后统计实验结果(见表2)。
表2 不同激素配比对根愈伤组织诱导的影响
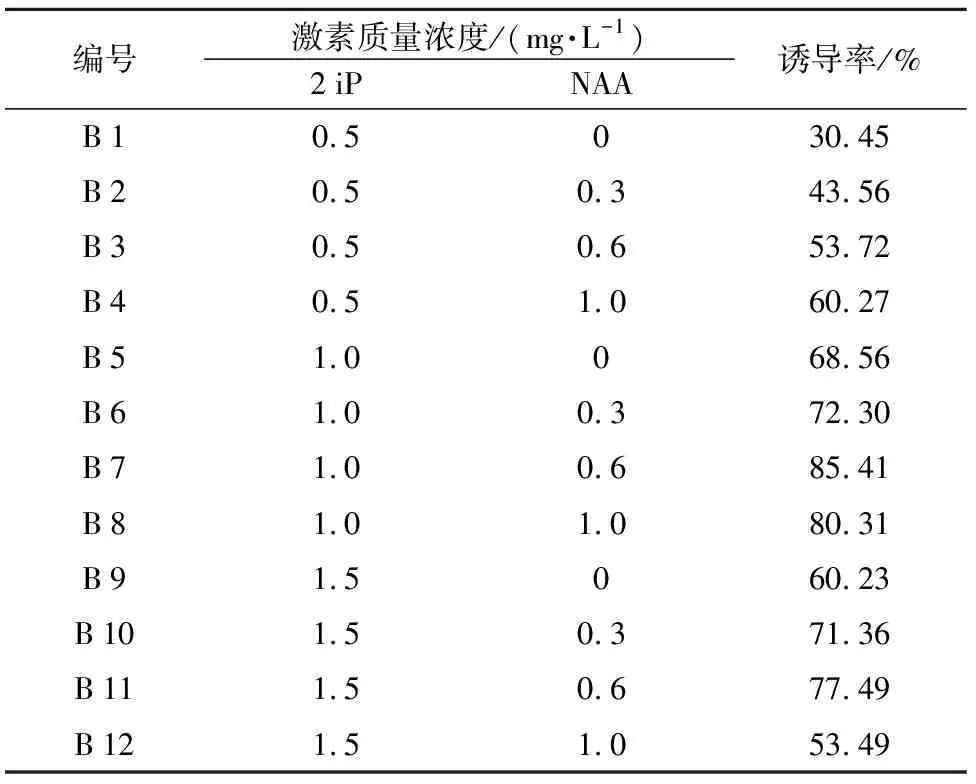
编号激素质量浓度/(mg·L-1)2iPNAA诱导率/%B10.5030.45B20.50.343.56B30.50.653.72B40.51.060.27B51.0068.56B61.00.372.30B71.00.685.41B81.01.080.31B91.50 60.23B101.50.371.36B111.50.677.49B121.51.053.49
由表2可以看出,由不同浓度的2 iP和NAA组合的培养基配方,对卷叶贝母根外植体的愈伤组织诱导影响较大。当2 iP浓度为0.5 mg·L-1不变时,B 1~B 4随着NAA浓度逐渐升高,诱导率逐渐增加,其中B 4时诱导率达到60.27%;而当2 iP浓度为1.0 mg·L-1不变时,B 5~B 8随着NAA浓度逐渐升高,其愈伤组织诱导率呈现出先上升后下降趋势,其中以B 7的诱导率为最高,为85.41%;当2 iP浓度为1.5 mg·L-1不变时,B 9~B 12随着NAA浓度逐渐升高,其愈伤组织诱导率也呈现出先上升后下降的趋势,其中以B 12的愈伤组织诱导率低,为53.49%,这说明尽管NAA具有促进卷叶贝母根外植体产生愈伤组织的作用,但是高浓度的NAA还是有其抑制作用,这一结果与付文奇等[5]、康微等[6]的研究结果相同。
当NAA浓度为0.3 mg·L-1时,B 1、B 5、B 9随着2 iP浓度逐渐升高,诱导率呈先增后减的趋势,这一结果表明,低浓度的2 iP能促进卷叶贝母根愈伤组织的诱导,而高浓度则抑制愈伤组织的诱导。使用的激素种类、浓度及培养条件对外植体愈伤组织的诱导有很重要作用,实质是培养基中的外源激素被植物吸入植物体内,再和内源激素共同作用诱导产生愈伤组织[7]。综合分析表2可以看出,B 7培养基MS+2 iP 1.0 mg·L-1+NAA 0.6 mg·L-1是诱导卷叶贝母根愈伤组织产生的最佳培养基配方;观察发现,卷叶贝母根外植体在培养7 d时,在根基部的切口处出现了明显的膨大,在培养15 d后开始有呈白色较紧密的愈伤组织产生,在培养30 d后统计其愈伤组织的诱导率为85.41%。
2.3 不同激素配比对根愈伤组织增殖的影响
选择由2.2 诱导获得的质地较紧密、颜色为白色的愈伤组织,切成0.6 cm3团块大小转接入表3的10种培养基中,培养30 d后统计根愈伤组织的增殖倍数,实验结果见表3。
表3 不同激素配比对根愈伤组织增殖的影响
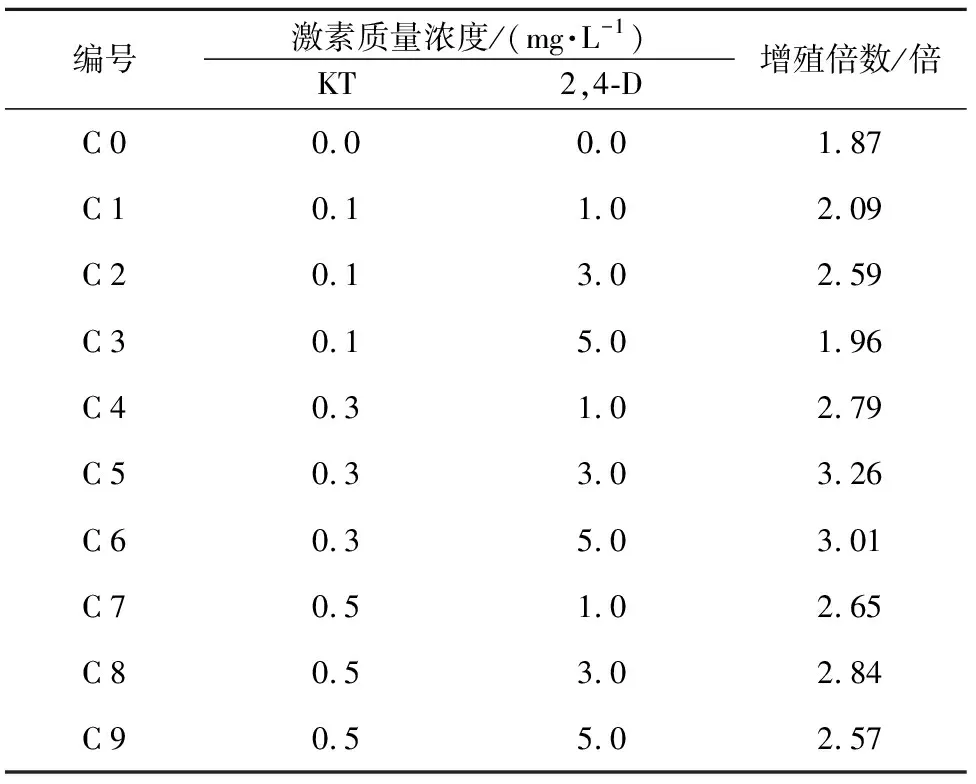
编号激素质量浓度/(mg·L-1)KT2,4-D增殖倍数/倍C00.00.01.87C10.11.02.09C20.13.02.59C30.15.01.96C40.31.02.79C50.33.03.26C60.35.03.01C70.51.02.65C80.53.02.84C90.55.02.57
由表3可知,将根愈伤组织接入未加激素的C 0培养基中,在培养30 d后的愈伤组织增殖倍数仅为1.87倍,是上述10种培养基中最低的。说明植物激素对卷叶贝母根愈伤组织的增殖生长有重要的促进作用。当KT浓度为0.1,0.3,0.5 mg·L-1保持不变时,随着2,4-D浓度逐渐升高,C 1~C 3,C 4~C 6,C 7~C 9均呈现出由低升高再降低的趋势,说明2,4-D在低浓度对愈伤组织增殖有促进作用而高浓度抑制其生长,与涂红艳等[8]的研究结果一致;随着2,4-D浓度的增加,培养的愈伤组织褐化情况加重,这是由于高浓度的2,4-D对愈伤组织有一定的毒效应。
当2,4-D为3.0 mg·L-1保持不变时,随着KT浓度逐渐升高,C 2、C 5和C 8增值倍数分别呈现出先增加后减少的趋势,说明低浓度KT对愈伤组织增殖有一定促进作用,而高浓度KT反而抑制愈伤组织生长;同时在C 7~C 9中,褐化程度明显减小,说明高浓度的KT有明显减轻褐化作用[9];上述不同浓度激素的培养基中均能形成愈伤组织,其中倍数最大的方案为附加KT 0.5 mg·L-1和2,4-D 3.0 mg·L-1,此时增殖倍数为3.26倍。综合考虑愈伤组织增殖倍数及生长情况可以得出,C 8培养基MS+2,4-D 3.0 mg·L-1+KT 0.5 mg·L-1最适于卷叶贝母愈伤组织的增殖,产生生长健康、无褐化和玻璃化现象的愈伤组织。
3 结 论
本实验利用卷叶贝母根为外植体,经适宜的消毒和诱导培养基筛选培养后,成功地诱导出愈伤组织,成功地实现了卷叶贝母愈伤组织的快速增殖培养,本研究对利用生物技术大规模生产母药物有效成分奠定了坚实基础。从消毒时间筛选、诱导培养基的筛选、增殖培养基筛选等方面进行了较系统的研究,外源生长调节剂如细胞生长素和细胞分裂素,是诱导外植体脱分化的重要因素[10]。细胞生长素能影响细胞分裂、伸长和分化,有利于外植体脱分化形成愈伤组织,而细胞分裂素能降低愈伤组织的诱导率,抑制愈伤组织的生长。试验结果表明,选择外源激素的种类、浓度及不同的激素组合对外植体细胞诱导以及增殖发生具有显著影响,这是因为激素是植物体内的微量信号分子,其浓度以及不同组织对激素的敏感性控制了植物的整个发育进程。
本实验主要选取2年生以上的卷叶贝母根为外植体,实现了其愈伤组织诱导与增殖;另外,尝试选用1年生的卷叶贝母根进行实验,但在长时间的培养过程中很少有外植体启动和愈伤组织产生的情况,这说明选择处于不同生长时期的外植体材料对其愈伤组织的诱导也有十分重要的影响;在对外植体进行消毒处理时,相同条件下若将根切开接入培养基,染菌率会大大增加,而启动率无明显提高,所以外植体的处理对愈伤组织诱导有着一定影响;同时,将根以平放方式放在培养基上的诱导率明显优于竖直方式插入培养基,这说明选择接种方式对愈伤组织诱导有着重要作用;另外,在进行愈伤组织卷叶贝母增殖培养时,选择进行增殖的愈伤组织不能切割太小,但是创伤面要尽量小,这样更有利于愈伤组织的快速增殖。

