炎症性肠病的治疗新策略
晏华兵,贺 娜,冯 巩※
(1.西安医学院研究生处,西安 710021;2.西安医学院第一附属医院消化内科,西安 710077)
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性肠道疾病,具有终生复发的倾向。近年来,亚太地区IBD患病率呈逐年增长趋势[1]。IBD包括一系列慢性、进行性和致残性胃肠道炎症性疾病,如克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),但确切病因仍不明确,现普遍认为是多因素参与的过程,包括环境触发因素、管腔微生物群及其相关抗原和佐剂在遗传易感个体中激活免疫系统,造成免疫紊乱[2]。当前研究热点集中在这一过程的不同因素,如胃肠道微生物群,IBD靶向治疗以及改善功能失调的免疫反应[3-4]。IBD治疗方案包括一般治疗、药物治疗、手术治疗。现对IBD治疗领域的新进展予以综述,以提高IBD的治疗效果。
1 饮食疗法
饮食是正常肠道微环境的关键参与者,影响肠道微生物的组成、功能、肠道屏障和宿主免疫力。从以植物为基础的饮食转变为以动物为基础的饮食,从根本上改变了菌群分类和代谢,导致胆汁酸和硫化物代谢的改变,两者可能在IBD中起作用[5]。有数据表明,造成饮食成分变化的最重要因素是卡路里、碳水化合物和蛋白质的摄入量[6]。
1.1饮食与IBD的关系 目前,饮食与IBD的关系成为研究热点。流行病学研究表明,特定饮食成分或饮食模式的摄入与发生IBD的风险之间存在关联[7]。D′Souza等[8]的一项评估包括西方饮食和素食在内的多种饮食模式,并对加拿大儿童饮食模式和CD发生风险的评估进行病例对照研究发现,以肉类、高脂食物和甜点为特征的饮食模式(西方饮食)可增加女性患CD的风险(OR=4.7,95%CI1.6~14.2),而蔬菜、水果、橄榄油、鱼、谷物和坚果的消费与男性和女性患CD的风险降低相关(男性:OR=0.2,95%CI0.1~0.5;女性:OR=0.3,95%CI0.1~0.9)。一项以人群为基础的环境危险因素研究表明,诊断前经常食用快餐(西方饮食)的CD风险增加[9]。
一些研究将蛋白与IBD风险增加联系起来。一项包括67 581例法国女性的前瞻性研究发现,高动物蛋白与IBD风险显著增加相关(OR=3.03,95%CI1.45~6.34),尤其与UC相关(OR=3.29,95%CI1.34~8.04)[10]。植物蛋白摄入量与以上两种疾病均无关。另一项评估饮食摄入和UC复发的研究发现,红肉与UC复发的关联性最强(OR=5.19,95%CI2.09~12.9)[11]。
碳水化合物摄入量增加与IBD风险之间相关性的研究结论尚不一致。Jantchou等[12]的研究未将碳水化合物摄入确定为IBD、CD或UC的危险因素。Racine等[13]对366 351例来自欧洲癌症和营养前瞻性研究队列的IBD参与者的研究发现,高糖和低纤维摄入与UC之间存在关联(OR=1.68,95%CI1.00~2.82)。
膳食脂肪与IBD风险的升高或降低有关,并取决于脂肪的类型。一项对170 805名女性随访超过26年的研究发现,大量摄入膳食长链n-3多不饱和脂肪酸与UC风险降低相关;相反,大量摄入反式不饱和脂肪会增加患UC的风险[14]。
流行病学研究中,对膳食纤维的一致认识也体现在素食的饮食模式中,水果或水果和蔬菜的膳食纤维摄入量与CD风险呈负相关。有研究表明,较高的长期水果摄入量与较低的CD风险相关,与UC无关[14]。但仍有若干研究空白,包括更多关于接触工业添加成分的数据(乳化剂、防腐剂和增稠剂等)。
1.2饮食疗法在诱导缓解与维持缓解中的作用 饮食疗法对IBD的可能作用主要体现在CD中。饮食疗法中,既往完全肠内营养主要用于诱导早发或新发CD,缓解或作为儿童和成人营养不良或术前支持疗法[15]。完全肠内营养以医学配方形式独家使用液体营养,不接触其他食物,通常持续6~8周,这种效应并不依赖蛋白质来源(配方类型),而非常依赖排除普通餐桌食品。较新的开放标签研究表明,现有的和新的饮食策略可能具有更广泛的作用,可用于维持缓解,诱导生物制剂失效患者和复杂疾病患者的缓解[16]。
1.2.1诱导缓解 诱导缓解主要是针对IBD的活动期。Lee等[16]研究表明,完全肠内营养可改善IBD患儿的黏膜炎症。Connors等[17]研究表明,完全肠内营养可诱导60%~86%的IBD患儿缓解,同时伴有炎症标志物(如红细胞沉降率、C反应蛋白和粪便钙卫蛋白)的显著降低。对轻度至中度CD的多中心前瞻性队列研究发现,完全肠内营养在诱导缓解和线性生长方面优于皮质类固醇,但完全肠内营养在其他结果(如复发时间或2年以上的并发症)方面并未显示出优越性[18]。Grover等[19]采用结肠镜检查评估54例完全肠内营养治疗8周的黏膜愈合情况的前瞻性试验发现,33%(18/54)的患者黏膜完全愈合,另有19%(10/54)的患者接近完全愈合,且随访3年以上,黏膜完全愈合者持续缓解较好。
1.2.2维持缓解 用饮食维持缓解的观点具有争议性和挑战性。一方面,饮食疗法需要足以维持体内平衡,并防止炎症瀑布式级联反应的发生,但难以进行持续长期的研究。一些评估部分肠内营养维持缓解的研究得到了较好的结果,Wilschanski等[20]的随访研究发现,不接受鼻饲的诱导缓解儿童较接受鼻饲儿童更容易复发。对10项研究的Meta分析发现,其中大部分未被随机分组,使用部分肠内营养后显示一些内镜改善[21]。一项对42例经过4~12周完全肠内营养进入临床缓解期的儿科CD患者,随后以部分肠内营养作为补充饮食,经过40个月随访的回顾性单中心研究发现,CD中位维持缓解时间为6个月(0~36个月),提示部分肠内营养对CD的维持缓解治疗有效[22]。
2 药物治疗
当前IBD药物治疗方案包括非特性抗炎药物(如氨基水杨酸类、糖皮质激素免疫调节剂)和针对炎症的靶点生物制剂。IBD新的靶向药物治疗主要集中在新的小分子抑制剂、新的单克隆抗体和基因治疗(反义核苷酸片段、基因修饰)方面。靶向药物通过阻断免疫炎症过程中的不同环节发挥作用。
2.1单克隆抗体
2.1.1英夫利昔单抗与阿达木单抗 英夫利昔单抗是一种单克隆抗体,被批准用于UC和CD的治疗,按5 mg/kg静脉输注给药。抗肿瘤坏死因子α单克隆抗体用于激素和免疫抑制剂治疗无效或激素依赖者或不能耐受上述药物治疗者,英夫利昔单抗仍是我国目前唯一批准用于CD治疗的生物制剂[23]。
阿达木单抗是人IgG1单克隆抗肿瘤坏死因子α抗体,国外被批准用于CD和UC[24-25]。阿达木单抗的给药方式是每2周皮下注射1次,固定剂量(不考虑体重,标准维持剂量40 mg)。
2.1.2维多珠单抗与优特克单抗 维多珠单抗是与α4β7整合素二聚体特异结合的人源性单克隆抗体。T淋巴细胞和B细胞表面的α4β7整合素二聚体通过与胃肠道或胆道细胞表面的黏液细胞黏附分子1相互作用,实现淋巴细胞向胃肠道炎症部位的迁移。维多珠单抗通过特异性靶向并阻断α4β7与黏液细胞黏附分子的结合,进而选择性阻断肠道淋巴细胞的迁移过程,从而发挥抗炎作用[26]。维多珠单抗克可用于治疗UC和CD,且对UC的疗效较CD好,均以固定剂量(不考虑体重,标准剂量300 mg)静脉输注给药[27-28]。维多珠单抗具有良好的安全性,长期随访证实,由于其肠道特异性,鼻咽炎和鼻窦炎的不良事件极少[29]。
优特克单抗为全人源抗白细胞介素(interleukin,IL)12和IL-23的单克隆抗体。IL-12和IL-23在树突状细胞表达,分别诱导Th1细胞和Th17细胞的分化,从而实现细胞炎症反应。在IBD患者中,IL-12和IL-23的表达均上调。IL-12和IL-23均含有p40亚单位,优特克单抗是人源抗p40 IgG1单克隆抗体,可拮抗IL-12和IL-23与相应受体的结合,从而发挥炎症反应[30]。
2.2小分子抑制剂
2.2.1托法替尼与菲尔替尼 JAK激酶(Janus kinase,JAK)是细胞内非受体型酪氨酸激酶家族,通过信号传递调节细胞生长、存活、分化、增殖和迁移等。托法替尼主要抑制JAK1和JAK3,菲尔替尼则主要抑制JAK1,从而阻断下游的促炎因子,包括IL-2、IL-3、IL-4、IL-5、IL-6、IL-12、IL-15、IL-21和γ干扰素[31]。在Ⅲ期临床试验中,与对照组相比,托法替尼在诱导缓解和维持治疗方面均显示出很好的疗效[32]。
2.2.2SMAD7抑制剂 转化生长因子β可通过信号通路中的SMAD2和SMAD3实现维持细胞稳态和抗炎的作用,SMAD7可阻断SMAD2和SMAD3活化,这是IBD患者转化生长因子β1表达升高但不能有效发挥抗炎作用的原因。蒙格森特异性结合SMAD7的信使RNA并促进其降解,减少SMAD7的产生和活化,从而保留转化生长因子β1的抗炎作用[33]。在治疗CD的Ⅱ期双盲、随机对照临床试验中,SMAD7组显示出明显高于安慰剂的临床反应和缓解率[34]。
2.2.3磷酸二酯酶4抑制剂 环腺苷酸可产生多种细胞因子来调节免疫细胞反应,磷酸二酯酶4是一种降解环腺苷酸的细胞内酶。磷酸二酯酶4抑制剂通过引起细胞内环腺苷酸水平增加,下调促炎细胞因子(如γ干扰素、肿瘤坏死因子、IL-12、IL-17、IL-23)水平。阿普斯特是一种磷酸二酯酶4抑制剂,目前被批准用于银屑病和银屑病关节炎[35]。一项治疗UC的Ⅱ期临床研究发现,与安慰剂相比,阿普斯特可促进患者临床症状缓解、生物标志物水平恢复正常和黏膜愈合[36]。
3 粪菌移植治疗
IBD由免疫系统、宿主基因和肠道生态之间失衡引起。肠道能容纳万亿细菌,即肠道微生物群。有研究表明,IBD的肠道微生物群多样性减少,即“肠道微生态失调”[37]。已有证据支持粪菌移植(faecal microbiota transplantation,FMT)在复发性梭状芽孢杆菌感染性结肠炎管理中的应用[38]。目前,FMT对治疗IBD的研究,尤其是对UC的治疗效果研究正在进行[39]。肠道菌群在IBD的发病机制中发挥关键作用,通过FMT可以改善IBD患者症状,Moayyedi等[40]的研究指出,FMT可诱导缓解活动性UC。Paramsothy等[41]的一项随机对照研究指出,FMT可以治疗活动性UC。Rossen等[42]随机对照研究报道,FMT对轻至中度IBD可能更为安全有效,但对结肠损伤严重患者不良反应风险较高,需慎用。
欧洲、美国、中国陆续发布了关于FMT临床应用的共识意见或指南[43-46]。在临床实践FMT的欧洲共识大会中指出,FMT对于IBD、肥胖、代谢综合征和糖尿病有治疗潜力,但需要更多实验研究的支持[44]。
4 心理治疗方案
IBD患者往往合并心理障碍,包括焦虑、抑郁、睡眠障碍等。肠道渗漏导致细菌及其抗原移位,继而引起肠道屏障失调的潜在神经精神症状。Regueiro等[47]提出了认知行为治疗方法,可用于治疗IBD慢性疼痛的情感、认知、行为和生理。IBD患者心理问题管理方式见表1。
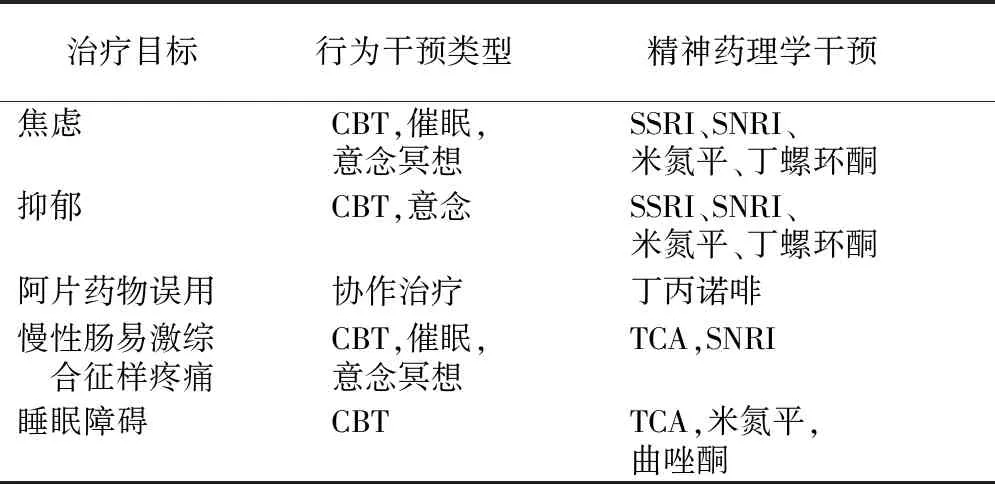
表1 IBD患者心理问题管理
IBD:炎症性肠病;CBT:认知行为治疗;SNRI:5-羟色胺-去甲肾上腺素再摄取抑制剂;SSRI:选择性5-羟色胺再摄取抑制剂;TCA:三环类抗抑郁药
5 小 结
目前IBD的治疗水平较以往有很大进步,但由于疾病本身的特性,治疗效果仍有待进一步提高。目前的医疗方式是一种药物用于所有患者,未来的医疗应是个体化诊断和治疗,未来的研究方向应基于组学的IBD系统生物学研究,即借助于生物信息工具,由IBD研究者和生物信息学家共同努力,提升药物研发水平。此外,可借助于人工智能技术,发挥其在IBD诊治中的作用。总之,IBD是一种终身性疾病,该病的追踪和随访均非常重要,仍需要更多的努力。在诊断、治疗、管理方面,主张多学科协作,参与制订IBD患者的治疗方案,包括传统中医药治疗,患者健康教育和管理。未来将有更多符合成本-效益的临床治疗方案和更适合中国疾病人群的治疗手段应用于临床。

