保育和育肥猪舍气溶胶微生物组成和四环素类抗性基因丰度研究
许铭洙,杨 勇,郭振东,严鸿林,*,张宏福,刘静波,
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.军事科学院军事医学研究院军事兽医研究所,吉林长春1301222;3.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193)
在封闭式猪舍中,猪排泄物和饲料等雾化形成的气溶胶可导致饲养人员和动物呼吸道发生疾病,而气溶胶中的微生物被认为是引起上述问题的主要原因[1-2]。前人研究表明,猪舍气溶胶中的微生物主要来源于猪粪便[3],且猪舍气溶胶和猪粪便的微生物组成具有极大的相似性[4-5]。因此,猪舍气溶胶的微生物组成可能由猪粪便微生物决定。
猪的粪便微生物组成受诸多因素影响,特别是生长阶段。Kim 等[6]和Niu 等[7]研究表明,猪粪便微生物结构随猪生长阶段变化而变化,保育猪和育肥猪粪便微生物组成差异极大。基于猪粪便和猪舍气溶胶微生物组成的相似性,因而推测保育猪舍和育肥猪舍气溶胶微生物组成可能存在差异。此外,Hong 等[8]研究发现,猪舍、鸡舍及火鸡舍气溶胶中四环素类抗性基因丰度存在显著差异,与抗生素的使用量和频次有关。在养猪生产中,保育猪抗生素使用量和频次远远高于育肥猪。因此,本研究采用RT-qPCR 方法比较保育舍和育肥舍特定微生物和四环素类抗性基因丰度,旨在探明2 个生长阶段猪舍气溶胶微生物组成和抗性基因丰度差异,将为进一步探明畜禽舍气溶胶的形成机制提供参考和积累资料。
1 材料与方法
1.1 猪舍空气样品采集与处理 试验于贵州省某猪场选择8 个保育舍和8 个育肥舍进行采样,猪舍大小均为36 m×9 m×3.5m(长×宽×高),采用隧道式通风,安有2 个换气风扇,舍内通风良好,湿度在60% 左右。保育舍内2 列共24 个猪栏饲养480 头左右杜×长×大仔猪,育肥舍2 列共24 个猪栏饲养200 头左右杜×长×大育肥猪。猪只自由采食和饮水,饲料为普通粉状料,人工清粪早晚各1 次。将大容量空气采样器(华瑞核安,HRHA01-LFS120D/A)置于2 列猪栏中间走廊中央离地1 m 处,采集所有保育舍和育肥舍的空气样品。每个猪舍的空气样品于08:00 和18:00 分别采集2 次。采样滤膜为石英膜,采样后将膜置于冰上并及时运送到实验室。将每个猪舍采集空气样品的滤膜剪碎并混合后转入离心管中,加入无菌的超纯水,置于冰上震荡20 min,使膜上的气溶胶颗粒充分洗脱溶解。将得到的洗脱液于21 000 ×g 低温离心10 min,弃掉上清液,剩余的气溶胶颗粒置于-20℃保存待测。
1.2 猪舍气溶胶DNA 提取 采用UltraClean®Soil DNA Isolation Kit(MoBio Labratories, Carlsbad,CA)提 取猪舍气溶胶颗粒的总DNA。所有提取步骤按照说明书进行。总DNA 的浓度和纯度采用NanoDrop ND-1000(Nanodrop Technologies, Thermo Scientific,Wilmington,DE,USA)测定。本试验中16 个猪舍气溶胶颗粒总DNA 的OD260/OD280在1.85~1.97。样品总DNA 的质量采用2% 琼脂糖凝胶电泳进行检测。
1.3 RT-qPCR 测定微生物组成 参照Bergström 等[9]和Liu 等[10]的方法,检测8 个保育舍和8 个育肥舍的气溶胶中特定微生物类群的丰度。本试验测定了猪舍气溶胶中总菌(Universe)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭菌纲(Clostridia)、乳杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)、拟杆菌属(Bacteroides)、瘤胃球菌属(Ruminococcus)、罗氏菌属(Roseburia)、罗伊氏乳杆菌(Lactobacillus reuteri)、约翰逊氏乳杆菌(Lactobacillus johnsonii)、植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)的丰度。引物序列见表1。采用11 μL 荧光定量PCR 反应体系: 2 μL DNA,2.7 μL无核酸酶水,上、下游引物各0.4 μL(10 μmol/L)和5.5 μL 2×KAPA SYBR FAST qPCR Kit Master Mix。反 应条 件 :50℃2min,95℃10min,40 个循环变性/退火(95℃ 15 s,60℃1 min)和熔解曲线过程(70℃至90℃,每5 s 上升0.5℃)。荧光定量反应在ABI7600 仪器上进行。从ABI7600 的数据软件SDS 中导出每个孔ΔRn 的数据,导入LinregPCR 软件,分析每个样品目的微生物的扩增效率,并计算目的微生物的平均扩增效率。结合每个目的扩增产物的响应阈值和平均扩增效率,计算样品中该目的微生物的起始浓度(N0,specific)。根据总菌的起始浓度,计算目的微生物在菌群中的相对比例(N0,specific/N0,universe)。
1.4 猪舍气溶胶四环素类抗性基因的测定 土霉素等四环素类抗生素在养猪生产中广泛使用,因而本研究参照Hong 等[8]的方法测定猪舍气溶胶中四环素类抗性基因TetB、TetH、TetZ、TetO、TetQ 和TetW 的绝对丰度。本试验构建了这些抗性基因的标准质粒DNA,并以重组质粒为标准品采用10 倍稀释梯度(108拷贝数到100拷贝数)建立每个抗性基因的标准曲线。引物序列见表2。PCR反应体系:2 μL DNA,0.5 μL上、下游引物(5 μmol/L),5 μL 2×KAPA SYBR FAST qPCR Kit Master Mix 和2 μL无核酸酶水;反应条件:95℃ 10 min,40 个循环变性/退火(95℃ 10 s,60℃ 1 min)和熔解曲线过程(60℃至95℃,每5 s 上升0.5℃)。气溶胶样品中抗性基因的测定同样按照上述反应体系和条件进行。将样品某一抗性基因的Cq 值带入到相应的标准曲线中计算出拷贝数,并计算每纳克 DNA 中该基因的拷贝数。

表1 荧光定量微生物引物序列

表2 荧光定量四环素类抗性基因引物序列
1.5 统计分析 首先采用SAS 9.0 对微生物相对丰度数据进行正态性和方差齐性检验,符合正态分布的变量采用非配对t 检验分析保育舍和育肥舍间的差异显著性(n=8);不符合正态分布的变量采用Mann Whitney U检验分析保育舍和育肥舍间的差异显著性(n=8)。
首先对四环素类抗性基因绝对丰度数据进行Log10转化,采用SAS 9.0 中非配对t 检验分析保育舍和育肥舍间的差异显著性(n=8)。
采用R 软件对微生物相对丰度和四环素类抗性基因绝对丰度数据进行主成分分析(PCA),采用prcomp 函数计算各主成分的贡献率,以PC1 和PC2 的坐标值并采用ggplot2 功能包作图。
2 结果与分析
2.1 保育和育肥猪舍气溶胶微生物的组成 由图1 可知,不同猪舍类型气溶胶微生物组成存在显著差异。与保育舍相比,育肥舍气溶胶微生物组中Firmicutes、Lactobacillus、Lactobacillus reuteri 和Lactobacillus johnsonii 丰度显著提高(P<0.05),而Bacteroidetes、Clostridia 和Prevotella 丰度显著降低(P<0.05)。PCA分析结果显示,保育舍和育肥舍的样品可根据微生物丰度数据进行聚类。在整体水平上,保育舍的微生物组成和育肥舍存在明显差异(图2)。
2.2 保育和育肥猪舍气溶胶四环素类抗性基因的丰度 由图3 可知,不同猪舍类型气溶胶四环素类抗性基因的绝对丰度存在差异。与保育舍相比,育肥舍气溶胶TetB、TetH、TetZ、TetO、TetQ 和TetW 的绝对丰度均显著降低(P<0.05)。基于抗药基因拷贝数的PCA 分析显示,保育舍气溶胶中抗性基因分布变异性大于育肥舍,不同类型猪舍气溶胶抗性基因分布存在差异(图4)。
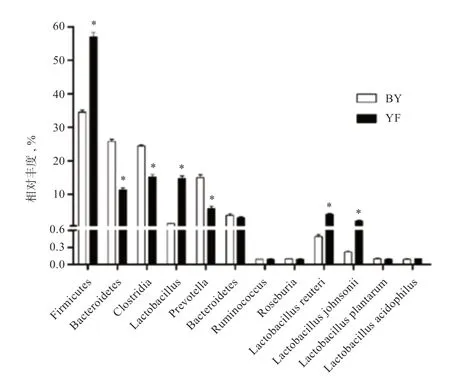
图1 生长阶段对猪舍气溶胶微生物组成的影响
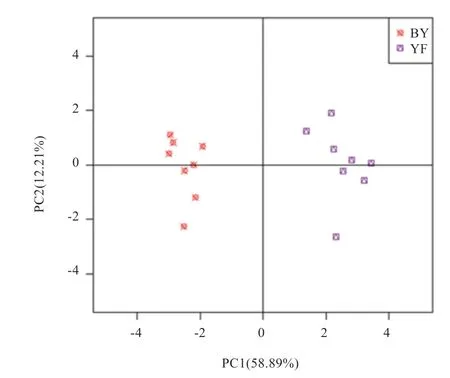
图2 基于猪舍气溶胶微生物丰度的主成分分析
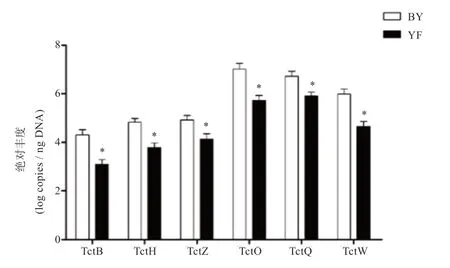
图3 生长阶段对猪舍气溶胶四环素类抗性基因丰度的影响
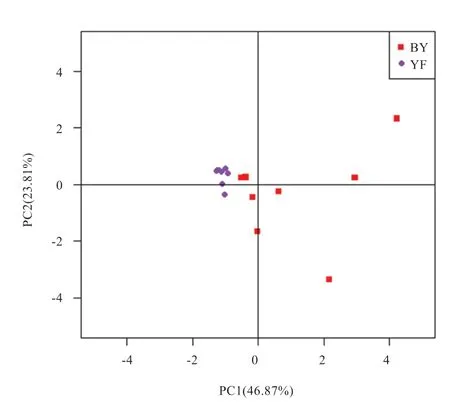
图4 基于猪舍气溶胶抗性基因丰度的主成分分析
3 讨 论
由于全封闭式猪舍气溶胶直径小且质量低,易从猪舍转运至公共区域,因而猪舍气溶胶不仅对养殖从业人员健康存在危害,同时对公共卫生也是一大挑战。猪粪便中的养分给微生物的繁殖和传播提供了基础,是猪舍气溶胶微生物的主要来源之一[3-5]。本研究对微生物丰度进行PCA 分析发现,保育舍和育肥舍气溶胶微生物组成存在明显差异,在门上,保育舍气溶胶中Firmicutes低于育肥舍,而Bacteroidetes 高于育肥舍,这与前人研究日龄对猪粪便微生物影响的结果一致,即随着日龄增加Bacteroidetes 逐渐被Firmicutes 取代[6-7];在属上,保育舍气溶胶Prevotella 丰度低于育肥舍,这也与前人研究猪粪便微生物组成的结果一致[6-7]。前人研究发现,猪粪便微生物中Lactobacillus 的丰度与日龄和体重正相关[7,11]。本研究也发现,育肥舍气溶胶中Lactobacillus 丰度显著高于保育舍。此外,本试验比较4 种乳杆菌在保育舍和育肥舍气溶胶中的丰度差异,发现Lactobacillus reuteri 和Lactobacillus johnsonii 丰 度在育肥舍气溶胶中较高。前人研究发现,Lactobacillus reuteri 和Lactobacillus johnsonii 与动物肌肉合成能力正相关[12]。这2 种菌在育肥舍中丰度较高的原因可能在于育肥猪的肌肉合成能力和肌纤维增长速率大于保育猪。
不同畜禽舍类型对气溶胶四环素类抗性基因丰度有显著的影响,猪舍中TeH、TeZ 和TeW 的拷贝数高于蛋鸡舍和火鸡舍,这与抗生素的使用量和频次多有关[8]。养猪生产中,断奶是仔猪面临的最大应激之一,因而在这一阶段抗生素被大量使用[11]。本试验发现,保育舍气溶胶所有6 种四环素类抗性基因的拷贝数均高于育肥舍,这可能与较多的抗生素用于保育阶段有关。
综上所述,保育舍和育肥舍气溶胶微生物在特定门和属的丰度上存在显著差异,且保育舍6 种四环素类抗性基因丰度高于育肥舍。

