微生物驱油过程中配气对菌群结构及驱油效果的影响*
刘 涛,汪庐山,胡 婧,巴 燕,刘 方,曹嫣镔
(1.中国石化胜利油田分公司石油工程技术研究院,山东 东营 257000;2.中国石化胜利油田分公司,山东 东营 257001)
微生物驱油技术经过近20年的发展,目前已从室内研究逐渐扩大到现场应用,并且现场应用规模不断扩大,试验效果也得到有效证明[1-4]。按照微生物驱油作用方式的不同分为内源微生物驱油和外源微生物驱油。现场实施过程中主要以内源微生物驱油为主,因为内源微生物驱油直接利用油藏微生物为激活对象,相对成本较低,省去了外源微生物菌种的发酵及对油藏条件的不适应性[5-6]。内源微生物驱油激活油藏中近井地带的好氧微生物作为主要驱油微生物的一部分,因此,供给好氧微生物生长需要的氧气是有效激活好氧微生物的前提和基础。宋永亭[7]研究了不同配气量条件下微生物群落的变化,发现不同液气比条件下微生物群落结构组成存在差异;随着培养时间的延长(30 d),氧气逐渐消耗,微生物群落趋向一致。孔祥平[8]研究了氧的生物学消耗和非生物消耗的影响因素,发现配注氧气对微生物驱油能产生明显的促进作用。针对油藏条件下微生物驱油过程中配气时菌群的变化及对驱替效果的影响还没有相关的详细报道。笔者利用岩心驱替模拟实验,研究了不同配气量条件下微生物驱油的效果及驱替过程中微生物群落的动态变化,为现场试验时有效配气量的选择提供理论依据。
1 实验部分
1.1 实验材料
实验模拟油藏为胜利油田沾3 区块油藏条件,物理模拟所用原油样品为沾3 区块脱水脱气原油,地面原油在50℃下的黏度为1885 mPa·s;实验水样为沾3 区块注入水,矿化度为9880 mg/L,离子组成(单位mg/L)为:Cl-4568、HCO3-855、SO42-106、Mg2+104、Ca2+165、Na++K+4083;按照石油天然气行业标准SY/T 6888—2012《微生物驱油技术规范》,沾3区块油藏条件在微生物生长耐受范围之内;葡萄糖、磷酸氢二钾、硫酸、乙酸,分析纯,天津市科密欧化学试剂开发中心;蛋白胨,北京奥博星生物技术责任有限公司;微量元素液,自制;物理模拟所用激活剂体系为:0.25%葡萄糖、0.2%磷酸氢二钾、0.05%蛋白胨、0.05%微量元素液;石英砂,淄博中隆石油化工科技有限公司;DNA 提取试剂盒,宝生物工程有限公司。
岩心驱替模拟实验装置,海安石油科研仪器有限公司;GC-14B 型气相色谱仪,日本岛津公司;BX50型相差显微镜,奥林巴斯株式会社;高通量测序仪,美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 物理模拟驱油实验
(1)按表1配比用石英砂填装岩心,测定岩心渗透率;(2)抽真空饱和地层水,计算岩心孔隙体积和孔隙度;(3)饱和原油造束缚水,计算岩心的原始含水饱和度;(4)岩心60℃老化放置7 d 后,一次水驱驱替3 PV,记录驱替过程中产出油量、产出水量及驱替压力的变化;(5)分别将微生物营养液0.3 PV及其与空气按不同体积比(1∶1、1∶5、1∶10)配气后注入岩心管,培养15 d;(6)二次水驱3 PV,记录驱替过程中产出油量、产出水量及驱替压力的变化,计算驱油效率和含水率。岩心驱替模拟实验装置示意图见图1。
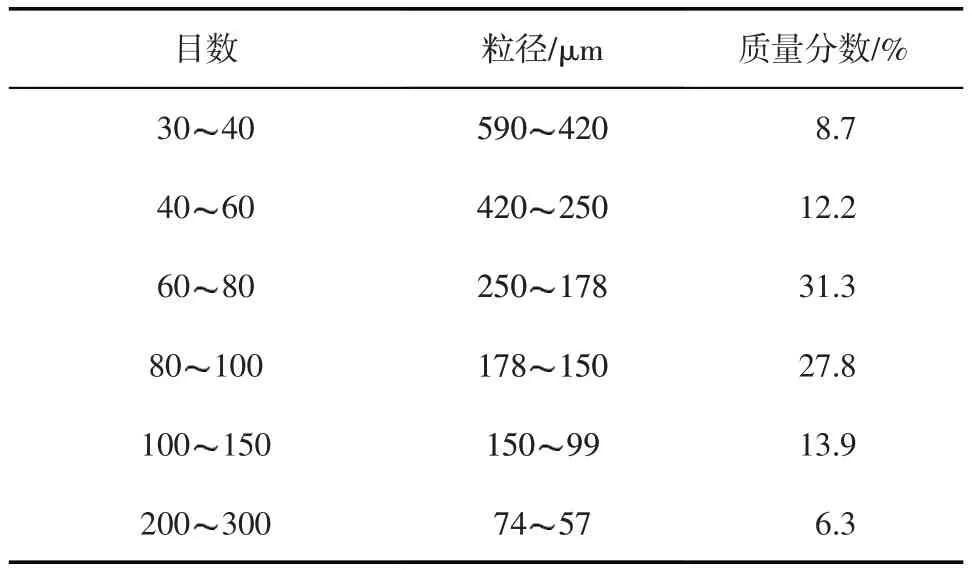
表1 填砂岩心石英砂配比
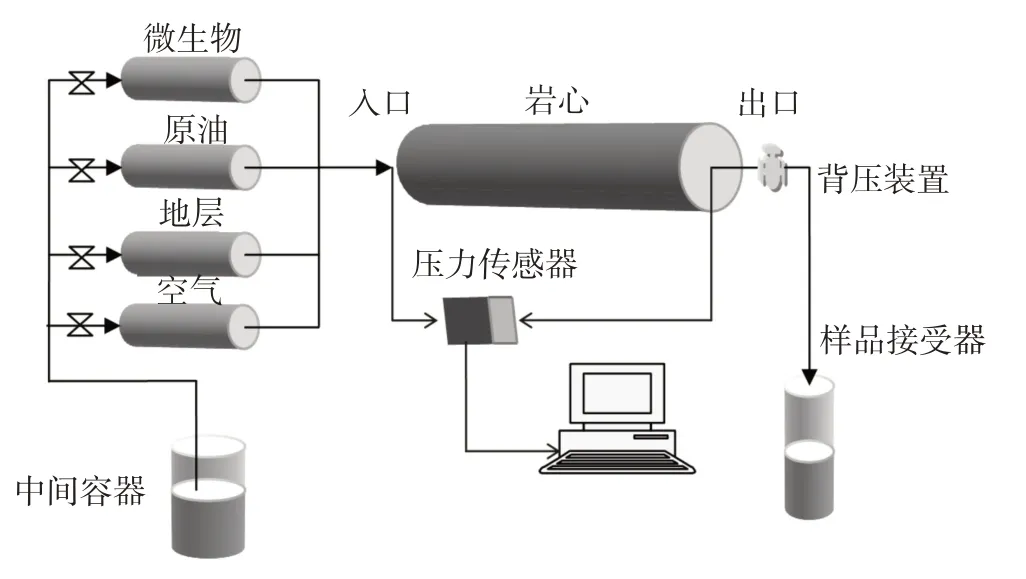
图1 岩心驱替模拟实验装置示意图
1.2.2 不同配气量的实现
按照岩心孔隙体积计算0.3 PV 条件需要的营养液体积,根据设计的液气比,计算常压下需要的空气量,按照不同岩心液气比的设计计算的空气量,通过中间容器配气,下面为营养液,上面为按设计量计算的空气,然后混合注入岩心管实现不同液气比的配注。
1.2.3 产出液分子生物学分析测定
取物理模拟岩心管驱替时产出液的样品20 mL置于离心管中,在4℃、10000 r/min 下离心10 min,收集菌体,弃去上清液,用DNA 提取试剂盒提取菌体DNA后用无菌去离子水溶解。DNA样品经电泳检测确保足量后再进行高通量测序[9-10]。
1.2.4 产出液小分子酸的测定
采用外标法[11]将待测样品与标准样品分别进行气相色谱分析,得到小分子酸浓度。(1)标样的配制:将乙酸标准品和蒸馏水混合,配制不同浓度小分子酸溶液;(2)产出液样品的预处理:取10 mL产出液样品静置,待油水分离后取上层清液,用0.45 μm 微孔滤膜过滤,滤液滴加5滴1∶1 硫酸后冷藏24 h;(3)色谱分析:包括标样色谱分析和测试样色谱分析,将色谱分析得到的测试样品谱图打开,加载已经建立的标准样品测定谱图,得到小分子酸浓度。
2 结果与讨论
2.1 不同配气量物理模拟驱替效果
由不同液气比物理模拟驱油效果(表2)可见,配注不同体积的空气以后,激活微生物作用产生了明显的驱替效果。随着配注空气量的增加微生物驱替效率增大,表明增加空气的注入量有利于激活岩心中的好氧微生物,促进好氧微生物的生长代谢作用。随着配注空气量的增加,驱替效率增幅逐渐降低,液气比为1∶5时的驱替效率最高(8.77%)。另外,不配气和液气比为1∶1、1∶5、1∶10 条件下,对应的含水降幅最大值分别为1.53%、2.67%、7.31%、6.98%。配气量增加含水最大降幅逐渐增大,液气比为1∶5时的含水降幅最大。这表明合适的配气量能有效激活油藏中的好氧微生物并与油藏深部的兼性厌氧、厌氧微生物有效作用原油,从而提高驱替效率。
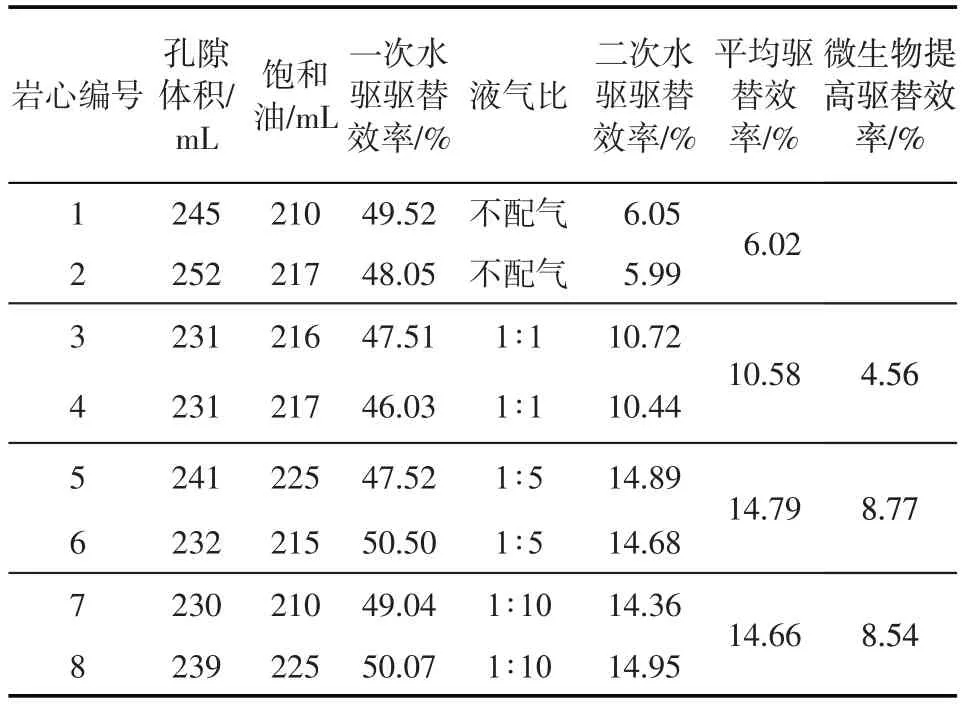
表2 不同液气比物理模拟驱油效果
2.2 物理模拟驱替过程岩心产出液菌群变化
2.2.1 产出液镜检菌数变化
由岩心驱替过程中不同液气比岩心产出液镜检菌数变化(图2)可见,岩心产出液中菌数大于107个/mL,表明岩心中微生物被有效激活,这是产生驱油效果的前提和基础。配气量不同产出液中菌数有一定差异,配气量增加产出液中菌数相对较高,这与岩心驱替结果基本一致。当配气比为1∶10时,好氧菌被激活,而兼性及厌氧菌有效激活数量比好氧菌低2数3个数量级,导致整体菌数降低。随着岩心驱替的进行产出液中菌数呈现了先升高后降低,反映了微生物在岩心中逐渐向前推进的过程。驱替1数2 PV时菌数达到最高,菌数升高表明微生物被有效激活生长代谢,与原油接触作用提高了驱替效果。
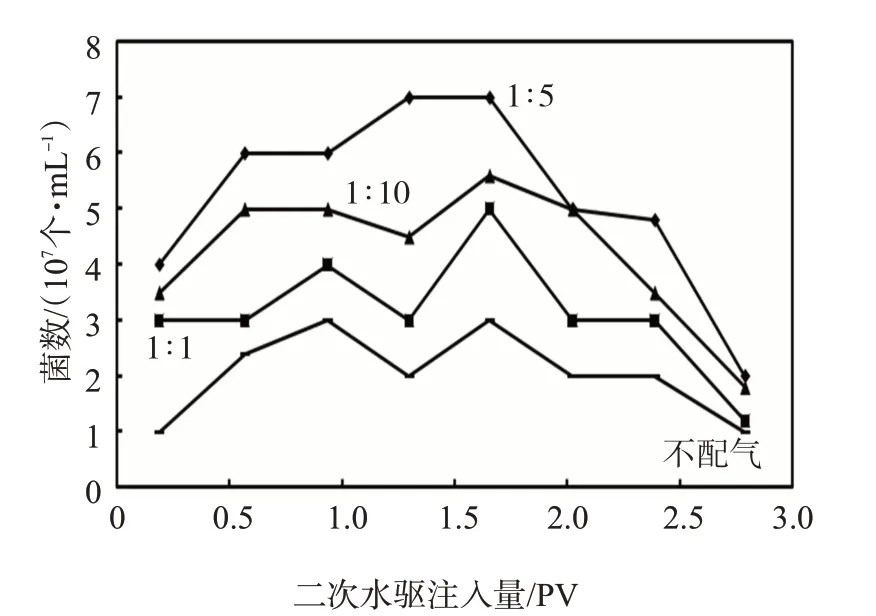
图2 不同液气比岩心产出液镜检菌浓变化
2.2.2 产出液菌群
不同配气条件下微生物群落结构存在明显差异,配气量不同时激活了不同类型的功能微生物,主要优势功能菌占到了整个菌群比例的67%以上。由不同液气比条件下微生物激活以后的主要4类功能菌(表3)可见,芽孢杆菌(Bacillus)[12]是一类产表面活性剂与产酸的好氧、兼性厌氧微生物,在不同配气比条件下所占比例均较高,这也是产生微生物驱油作用的主要菌属。从激活后不同液气比时该菌属所占比例可见,液气比为1∶5 时的比例最高(50.1%),这与其驱油效果最高对应。脱铁杆菌属(Deferribacter)[13]是兼性及厌氧类微生物,具有硝酸盐还原和降解原油的特性,从菌群所占比例可见不配气时其比例最高为47.14%,配气量增加所占比例降低,这与菌属自身的生长代谢特性对应。假单胞菌属(Pseudomonas)[14]属于兼性好氧类微生物,可代谢产生乳化剂降解原油,不同液气比条件下所占比例均在10%以上,并且随着配气量的增加所占比例增大,说明该菌属对氧气具有较好的响应。共生小体菌(Symbiobacterium)[15]是一类与其他菌属共生的微生物(产酸产气、兼性好氧类),对于维持微生物群落的多样性具有重要作用,液气比为1∶10的条件下所占比例大幅提高,表明氧气对该类菌具有明显的激活促进作用。
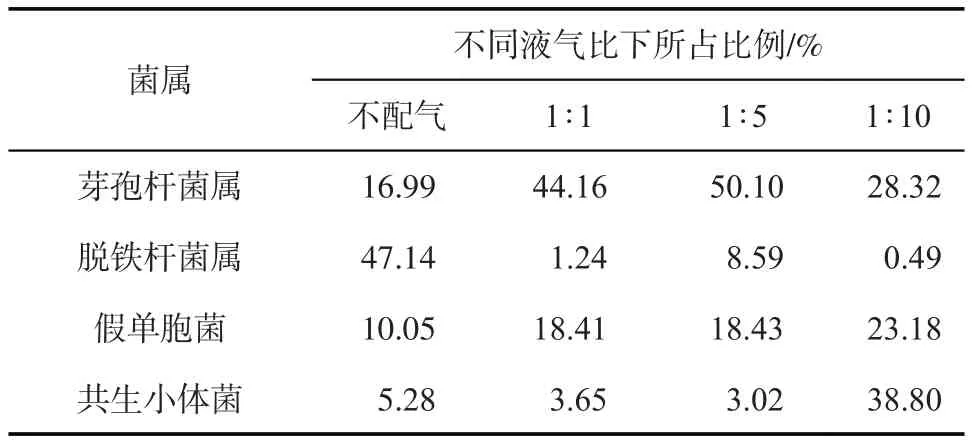
表3 不同液气比条件下微生物激活后的主要功能菌所占总菌数的比例
不配气和液气比为1∶1、1∶5、1∶10的条件下,微生物 shannon 多样性指数[16-17]分别为 1.95、2.19、2.22、1.66。随着配气量的增加,shannon 多样性指数升高,氧气对促进群落中微生物的整体激活起到了促进作用。但当配气量达到液气比1∶10时,shannon 多样性指数降低,这反映了进一步增加氧气的条件下群落中好氧到兼性好氧的微生物逐渐增加,多样性降低[18]。从整理趋势分析,配气量为液气比1∶5 时微生物群落多样性最佳,而且此条件下功能微生物主要以产表面活性剂和乳化剂的芽孢杆菌和假单胞菌为主,驱替效果最佳。分子生物学分析结果进一步说明配注一定量的空气对驱油效果具有促进作用。
2.3 物理模拟驱替过程中产出液小分子酸的变化
物模驱替过程中不同液气比产出液中小分子酸浓度见图3。配气后小分子酸浓度明显升高,并且随着岩心驱替的进行,小分子酸浓度呈现了先升高后降低的变化规律。配气后好氧微生物得到激活,促进了小分子酸的产生,驱替过程中小分子酸和微生物一起被不断驱出,因此,小分子酸可作为微生物驱油见效的重要指标。配气量不同时产生的小分子酸差异明显,配气量增加小分子酸浓度升高。氧气的增加促进了好氧微生物的激活,好氧微生物的生长代谢产生了更多的小分子酸代谢产物。马波等[19]的研究已表明小分子酸作为微生物生长代谢的标志性产物,小分子酸浓度的变化与微生物的生长代谢密切对应。不配气和液气比为1∶1、1∶5、1∶10的条件下,产出液中小分子酸的平均质量浓度分别为5、23、38、41 mg/L。配气量增加小分子酸代谢浓度升高,液气比大于1∶5 时的小分子酸浓度增幅较大,微生物代谢活性高。
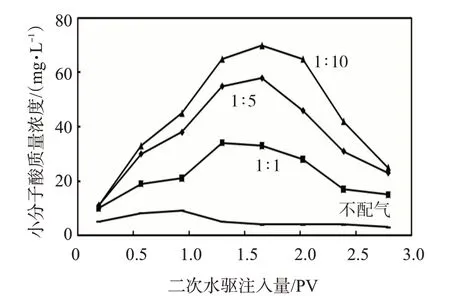
图3 不同液气比产出液中的小分子酸浓度
3 结论
微生物驱油过程中,配注空气量对菌群结构及驱油效果的影响显著。配注不同体积的空气后,不同类型的功能微生物得到了激活,主要优势功能菌占整个菌群比例的67%以上,功能微生物主要以产表面活性剂和乳化剂的芽孢杆菌和假单胞菌为主。配气后小分子酸浓度明显增加,氧气促进了好氧微生物的激活,液气比大于1∶5 时小分子酸浓度增幅明显,微生物代谢活性高。随着配注空气量的增加,微生物驱驱替效率增加并逐渐稳定,液气比为1∶5时的驱替效率最佳(8.77%)。

