经基因分析确诊的儿童原发性红斑肢痛症一例报告
李妍涵,金颖,刘怡,康路路,宋金青,杨艳玲△
原发性红斑性肢痛症(primary erythromelalgia,PEM,OMIM# 133020)是一种罕见的常染色体显性遗传病,以不同程度的阵发性肢端灼烧样疼痛和对温度敏感为主要特征,伴肢端皮肤发红,予患肢降温如浸冷水等可缓解症状[1]。红斑性肢痛症可分为原发性及继发性两种,全球发病率分别约为1.1/10 万和0.2/10万[2],两种类型的红斑性肢痛症在中国均有数例报道[3-6],具体发病率不详。本文就1例基因诊断明确的原发性红斑性肢痛症的诊疗经过、SCN9A基因突变特点进行研究和分析。
1 病例报告
患儿 男,11岁。主因双下肢端疼痛3年,阵发性加剧1年,于2017年5月9日就诊于北京大学第一医院儿科。患儿于入院前3年无明显诱因出现双下肢端疼痛,为灼烧痛,每天约发作十余次,每次约数分钟至数十分钟。发作与环境温度及活动相关,静息时也可发作,患处浸入冷水可略缓解。患儿于入院前1年疼痛阵发性加剧,症状持续不缓解。入院查体:患儿神志清楚,精神状态差。身高140 cm,体质量42 kg,体温36.7 ℃,呼吸 21 次/min,脉搏 88 次/min,血压101/75 mmHg(1 mmHg=0.133 kPa)。患儿全身皮肤、黏膜未见黄染及皮疹,毛发无明显异常。浅表淋巴结未触及肿大,口唇无发绀,甲状腺无肿大。双肺未闻及干湿性啰音。心界不大,心率88 次/min,律齐,未及杂音。腹平软,肝脾肋下未触及,移动性浊音(-),肠鸣音3 次/min。脊柱未见明显异常,双下肢无水肿。睡眠差,大小便未见明显异常。血尿便常规、肝肾功能、电解质、血糖、血脂、C 反应蛋白、降钙素原、风湿抗体、免疫全项等检查未见明显异常。双膝以下皮肤呈红色,皮温较其他部位高,触痛明显(图1),双侧乳头内陷(图2)。患儿既往背部皮肤活检示表皮轻度角化过度,萎缩变薄,基底层黑色素颗粒增多,毛囊数量减少,可见小汗腺结构,较正常形态小,提示先天性外胚叶发育不良样改变,患儿父母健康,无亲缘关系,父母家族中未有类似家族史。患儿为第1胎,足月顺产,围生期未见明显异常。
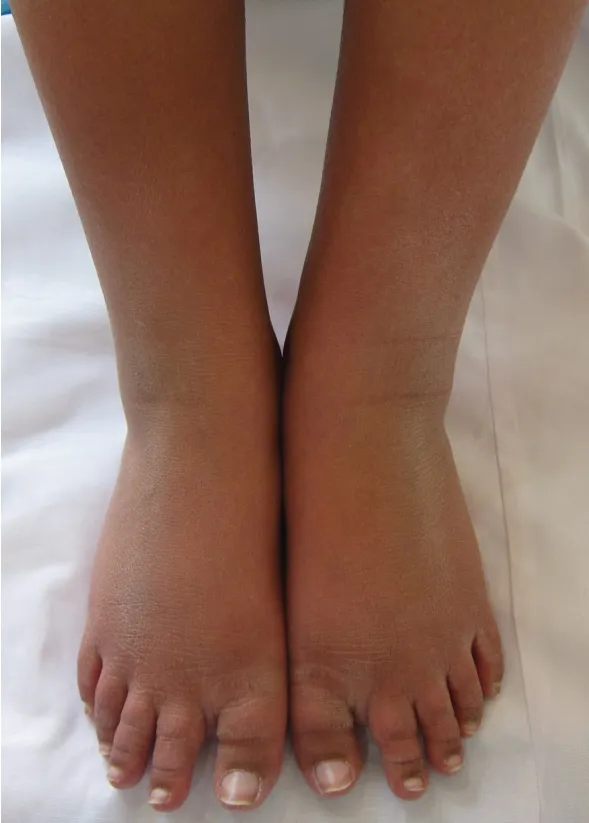
Fig.1 The patient's both lower extremities were inflamed with rough nails图1 患儿双下肢形态:双下肢红肿,趾甲粗糙

Fig.2 The patient's chest:bilateral crater nipples were found图2 患儿胸部形态:双侧乳头内陷
在知情同意的情况下,留取患儿及其父母静脉血各2 mL,使用TIANGEN 血液基因组DNA 提取试剂盒(北京天根生化科技有限公司,离心柱型)提取患儿及父母外周血白细胞DNA。予患儿全外显子测序检查(安捷伦V6),检出SCN9A基因突变后,由 NCBI 网站下载SCN9A基因 DNA 全序列(NM_002977)。采用Primer 5软件针对全外显子测序检出的突变序列设计聚合酶链反应引物进行扩增。胶回收以及纯化后,采用双向测序法进行基因序列分析,然后与标准序列进行比对分析。确认患儿存在SCN9A基因c.2566G>C(p.G856R)杂合新发突变,家系分析示父母均为野生型(图3),符合原发性红斑肢痛症诊断。该突变在正常对照(500人)中均未检出。因患儿存在外胚叶发育不全表型,课题组对全外显子测序数据进行重分析,未检出外胚叶发育不全相关致病突变。

Fig.3 Pedigree study:a heterozygous c.2566G>C(p.G856R)mutation was identified in the patient's SCN9A gene,which was not detected from his parents图3 家系桑格尔测序结果:患儿存在SCN9A基因c.2566G>C(p.G856R)新发杂合突变,患儿父母均为野生型
利用NCBI蛋白数据库和Bioedit软件进行人类和不同物种的Nav 1.7 蛋白同源序列比较,并运用Mutationtaster 软件(http://www.mutationtaster.org)及 Polyphen-2 软件(http://genetics.bwh.harvard.edu/pph2)进行突变的致病性预测。经SIFT 和Polyphen-2 软件致病性预测,该位点可能致病,经多物种同源性分析示p.G856在多物种间高度保守(表1),可明确诊断。

Tab.1 Amino acid alignment in Nav1.7 subunits表1 Nav1.7蛋白同源序列对比
患儿双下肢端疼痛3年,患处皮温增高,红斑肢痛症临床症状典型且分子诊断明确。患儿双侧乳头内陷,皮肤活检示外胚叶发育不全,但外显子层面未检出相关基因异常。予患儿“原发性红斑肢痛症、外胚叶发育不全?”诊断。确诊后,建议患儿以风扇代替冷水浸泡,予非甾体抗炎药等药物治疗后疼痛缓解不明显,遂于解放军总医院行腰交感神经节阻滞术,术后双下肢疼痛缓解,目前仍在随访中。
2 讨论
2.1 疾病分型 红斑肢痛症可分为原发性及继发性[7],原发性红斑肢痛症多于儿童期及青春期发病,无性别受累倾向,疼痛可持续终身。继发性红斑肢痛症多发于存在基础病的中老年患者,如继发于骨髓增殖性疾病、免疫性疾病、糖尿病、炎症性肠病、病毒感染、蘑菇及汞中毒等[1]。
2.2 症状及体征 原发性红斑肢痛症主要表现为肢端阵发性灼烧样疼痛,患处皮肤发红、肿胀、温度升高,疼痛可持续数分钟至数小时,有时存在昼夜节律,于清晨疼痛可缓解,将患处浸入冷水或环境温度降低可一定程度缓解疼痛;该病通常为双侧肢端疼痛,主要为下肢受累,但约有1/3~1/4患者存在上肢疼痛;也有机体其余部位受累的报道,如颈部、耳朵、脸颊、阴囊或外阴等[1]。偶见嗅觉敏感[8]及低体温[9]等症状。部分患者在疼痛发作间期可存在雷诺现象[1]。患处常破溃,长时间冷水浸泡可加重感染,引发溃疡、坏疽甚至截肢。合并症在具有SCN9A基因突变的患儿中更为常见[10]。
2.3 分子病因 原发性肢痛症与SCN9A、SCN10A及SCN11A基因相关[1,11-12],上述基因分别编码NaV1.7,NaV1.8及NaV1.9蛋白,其中以SCN9A基因突变最为常见。SCN9A基因位于2q24,目前已发现该基因至少与3 种遗传性疾病相关:原发性红斑肢痛症(primary erythermalgia,IEM)、阵发性剧痛症(paroxysmal extreme pain disorder,PEPD)和先天性无痛觉症(congenital indifference to pain,CIP)。Yang等[13]首次明确该基因与原发性红斑肢痛症的相关性。SCN9A基因编码Nav1.7 蛋白,该蛋白是钠离子通道的成员之一,由1 977 个氨基酸组成,多于外周神经系统表达,以背根神经和交感神经为主,这些神经元多数为伤害感受器,故Nav1.7 蛋白和与痛觉感受相关。突变的SCN9A基因在活化和钝化的转化过程中可出现超极化,这导致对小的亚门阈值的去极化的放大,进一步证实了SCN9A基因与遗传性神经性疼痛有关,提示SCN9A基因突变可导致外周神经及交感神经过度兴奋,引发原发性红斑肢痛症发生。
遗传学方面,目前已有128 个SCN9A基因致病突变被报道(http://www.hgmd.cf.ac.uk/ac/)。因本例患儿父母未检出c.2566G>C(p.G856R)突变,故该患儿为新发突变,可解释父母未患病的原因。也有研究发现对于非新发突变,该病的发生与SCN9A基因突变的嵌合率相关,如已知致病突变c.2573T>A(p.L858H)同时于临床症状典型的患儿及其无症状的母亲中检出,母亲无症状不除外与该突变位点低嵌合率相关,即推测患儿母亲SCN9A基因野生型单倍体剂量充足,由突变基因所表达的不正常α 亚单位量少,不足以产生兴奋性阈值的降低,所以表型正常[14]。
2.4 诊断与鉴别诊断 原发性红斑肢痛症可经典型临床症状、生化及遗传学异常诊断,本例患儿临床症状典型,以双下肢疼痛起病,且患处皮肤发红,皮温升高,触痛严重,将患肢浸入冷水可缓解疼痛,且存在SCN9A基因致病突变,符合原发性红斑肢痛症诊断。另外,电压钳(Voltage-clamp)技术可通过分析神经纤维动作电位进而辅助诊断,如Wu 等[15]通过电压钳明确了1例中国患者因c.2477T>A(p.F826Y)突变影响了离子通道超极化和去极化过程,从而引发疾病发生。
本例患儿存在趾甲粗糙,乳头内陷,皮肤活检示外胚叶发育不全,患儿毛发、牙齿发育、听力及排汗等未见明显异常,现考虑先天性外胚叶发育不良,为除外患儿同时存在多种罕见基因突变引发的多种疾病,笔者对本例患儿已报道的外胚叶发育不全基因再次进行分析,包括(KDF1、EDAR、MSX1、ECTD5、KRT85、HOXC13等十余种基因),并行SNP-ARRAY检测排除大片段缺失重复,未检出疑似致病的突变,且CNV 未见明显异常。现不除外该患者同时存在两种基因异常引发的罕见疾病的可能(先天性外胚叶发育不良的致病突变位点因检测技术及分析手段的局限性未明确),及SCN9A基因 c.2566G>C(p.G856R)突变可能与外胚叶发育不全相关的可能。
在既往研究中,Tanaka 等[16]报道了一对该突变受累的兄妹,有典型的红斑性肢痛症表现,且姐姐(17 岁)存在身材矮小、原发性闭经且没有第二性征,但性激素水平无明显异常;行功能学检查示:与野生型相比,突变型增强了离子通道超极化的激活并减缓了失活,但不会使离子通道失活。另一项针对同一突变位点但不同氨基酸改变(p.G856D)的研究示,受累患儿存在典型红斑性肢痛症症状及肢体发育不良,功能研究示离子通道超极化激活,去极化快速失活和斜坡电流增加[17]。Tanaka 等[16]考虑存在该突变相关钠离子通道障碍可能引发人体肢体发育异常,也有可能上述患儿存在其他肢体发育相关基因的突变。目前尚鲜有SCN9A基因其他突变引发肢体发育不良的报道。本文患儿肢体长度及生长发育无明显异常,但不除外该钠离子通道缺陷与外胚叶发育有一定相关性的可能。
2.5 治疗 原发性红斑肢痛症的治疗以镇痛为主,可运用药物镇痛及手术或药物注射阻断治疗。药物包括非甾体抗炎药、非选择性单胺摄取抑制剂、血管扩张剂、抗抑郁药、抗惊厥药、抗组胺药、钠离子通道阻滞剂以及前列腺素等[1,14]。但常存在难治性疼痛,且易反复[10]。其次,可通过手术治疗缓解症状,包括硬膜外阻滞、交感神经节阻滞、交感神经切除术以及臂丛阻滞等,但仍有疗效欠佳、症状加重及复发的报道[18]。如在国内一项13例患者的研究中,69.2%患者经化学性腰交感神经切除术后完全缓解,但其中部分SCN9A基因突变的患者术后仍复发[19]。在日常生活中,建议尽量减少冰水及冷水浸泡时间和频率,以吹冷风代替,减少皮肤溃疡、感染的可能性。在家系中有相关患者的前提下,家庭成员应及时进行基因检测明确是否携带相关突变,对有阳性家族史的家系可通过下一胎产前诊断避免再次生育原发性红斑肢痛症患儿。本文患儿经腰交感神经节阻滞术后疼痛缓解,治疗有效。

