琴叶风吹楠的化学成分研究
邝 芳,吴 伟,杨雯新,李 饶,詹 睿
(云南师范大学 化学化工学院,云南 昆明 650500)
琴叶风吹楠(Horsfieldiapandurifolia),乔木,是云南特有植物[1-2],属于肉豆蔻科(Myristicaceae)风吹楠属(Horsfieldia)植物.生于海拔500~800 m的沟谷坡地或山坡密林中,是典型的热带季节性雨林成分.其木材略轻柔致密,刨面光滑,可作高级家具、装饰、箱板等材料.琴叶风吹楠是一种重要的能源植物和油料作物,其种子含油量高达57.39%,以十四碳酸的固体油为主[3-4].同时它也是重要的工业原料,广泛用于合成化妆品、医药、香料、杀虫剂等[5].由于该植物数量少,热带雨林过度毁坏,雌株为数不多,天然繁殖较差,又因商业部门收购种子,群众伐树收果,因此植株日渐减少,已作为渐危种列为保护植物[6].
国内外学者对琴叶风吹楠的研究较少,且主要集中于其种子上,而对该属其他种的研究渐渐增加[7-8].为了支持该种植物资源的深入研究与开发利用,得到更多的天然次生代谢产物,我们对采自西双版纳的琴叶风吹楠枝叶部分展开深入研究,从70%丙酮提取物中共分离纯化得到5个异黄酮、2个二氢黄酮、1个黄酮醇,共8个化合物.
1 实验部分
1.1 主要仪器与试剂
ZF-Ⅱ型紫外分析仪(上海市安亭电子仪器厂);Bruker Avance 500型核磁( 瑞士Bruker公司);EYELA N-1100旋转蒸发仪(日本东京理化有限公司);层析硅胶(100~200目,200~300目)(青岛海洋化工厂);高效薄层层析硅胶板(5 cm×10 cm, 烟台化工研究院);Sephadex LH-20( 20~80 μm, Pharmacia Fine Chemical Co.,Ltd);CHP-20 MCI(日本三菱公司);丙酮、氯仿、乙酸乙酯、甲醇、石油醚等柱层析溶剂(工业纯, 昆明福海达有限公司);HPLC使用溶剂甲醇、乙腈(色谱纯, 北京迈瑞达科技有限公司).
实验所用植物采于云南省西双版纳勐腊县,由中国科学院植物学家周仕顺先生鉴定为琴叶风吹楠(H.pandurifolia).
1.2 提取和分离
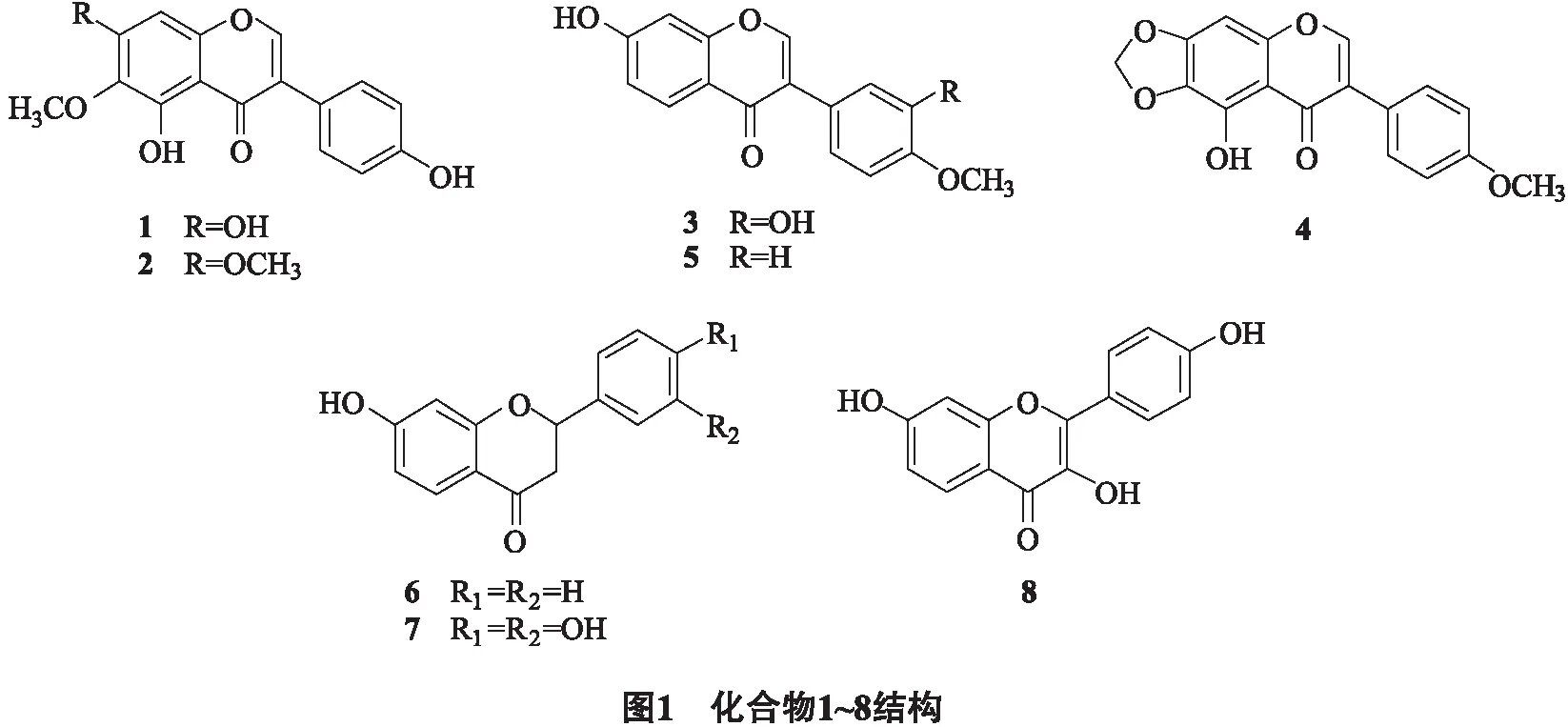
干燥的琴叶风吹楠枝叶共11 kg,粉碎后用25 L体积分数为70%的丙酮浸泡5次,每次浸泡2天.室温下过滤、减压蒸馏除去溶剂,提取物合并,分散悬浮于7 L水中,用乙酸乙酯萃取得到185 g浸膏.再经硅胶柱层析,石油醚-丙酮梯度洗脱,用TLC检测合并,得到4个部分(A~D).A部分(14.6 g)经过Sephadex LH-20V(氯仿)∶V(甲醇)=3∶2洗脱,得到3个部分(A1-3).其中A2再经过硅胶柱层析,以V(氯仿)∶V(丙酮)=(50∶1→20∶1→10∶1→5∶1→2∶1→1∶1)梯度洗脱,得到化合物1(4.8 mg).A3经过硅胶柱层析,以V(氯仿)∶V(丙酮)=(20∶1→10∶1→5∶1→2∶1)梯度洗脱,得到化合物4(5.27 mg).B部分(18.5 g)经过Sephadex LH-20V(氯仿)∶V(甲醇)=3∶2洗脱,得到3个部分(B1-3).其中B1经过硅胶柱层析,以V(氯仿)∶V(丙酮)=(50∶1 → 20∶1 → 10∶1 → 5∶1 → 2∶1 → 1∶1)梯度洗脱,再经过反复硅胶柱层析得到化合物3(4.46 mg).C部分(27.6 g)经过Sephadex LH-20柱层析V(氯仿)∶V(甲醇)=3∶2除去大量色素和脂肪酸,其余部分(641 mg)经过硅胶柱层析V(氯仿)∶V(甲醇)=100∶ 1得到化合物2(6.3 mg)和C2组分(77 mg),C2经过Sephadex LH-20柱层析V(氯仿)∶V(甲醇)=3∶2得到化合物6(6.84 mg).D部分(25.8 g)经过Sephadex LH-20柱层析V(氯仿)∶V(甲醇)=3∶2,薄层层析检测分为5个组分(D1~D5).D2(59.4 mg)经过硅胶柱层析V(氯仿)∶V(丙酮)=30∶1分为2个亚组分(D2~1~D2-2),D2-1(139 mg)经过硅胶柱层析V(氯仿)∶V(丙酮)=10∶1和Sephadex LH-20柱层析(甲醇)得到化合物7(12.5 mg).D2-2有针状晶体析出,用V(石油醚)∶V(丙酮)=5∶ 1洗涤4次并重结晶,得到无色针状晶体化合物5(10 mg).D3(490 mg)经过硅胶柱层析V(氯仿)∶V(甲醇)=60∶1并用薄层层析检验分为3个部分(D3-1~D3-3),其中D3-2(44 mg)经过硅胶柱层析V(石油醚)∶V(丙酮)=5∶1和Sephadex LH-20柱层析V(氯仿)∶V(甲醇)=3∶2得到化合物8(7.5 mg). 化合物结构见图1.
2结构鉴定
化合物1淡黄色粉末.1H NMR (500 MHz, CD3COCD3)δ:8.04 (1H, s, H-2), 7.35 (2H, d,J= 8.2 Hz, H-2′, H-6′), 6.82 (2H, d,J= 8.2 Hz, H-3′, H-5′), 6.42 (1H, s, H-8),3.85(3H,s,6-OMe).13C NMR (125 MHz, CD3COCD3)δ:182.5 (s, C-4), 158.8 (s, C-4′), 158.6 (s, C-7), 155.1 (s, C-9), 155.0 (d, C-2), 154.6 (s, C-5), 132.8 (s, C-6), 131.3 (d, C-2′, C-6′), 124.2 (s, C-1′), 123.2 (s, C-3), 116.2 (d, C-3′, C-5′), 106.6 (s, C-10), 95.0 (d, C-8), 60.9 (q, 6-OMe). 以上光谱数据与文献[9]报道的基本一致,因此化合物1鉴定为tectorigenin.
化合物2黄色粉末.1H NMR (500 MHz, CD3COCD3)δ:8.26 (1H, s, H-2), 7.47 (2H, d,J= 8.5 Hz, H-2′, H-6′), 6.93 (2H, d,J=8.5 Hz, H-3′, H-5′), 6.73 (1H,s, H-8), 3.99 (3H,s, 7-OMe), 3.81 (3H, s, 6-OMe).13C NMR (125 MHz, CD3COCD3)δ:182.0 (s,C-4),160.2(s,C-5),158.5 (s,C-7),156.4(s,C-4′),154.6(d,C-2), 154.4 (s,C-9), 133.4 (s, C-6), 131.1 (d,C-2′, C-6′), 123.8 (s, C-3), 122.8 (s, C-1′), 115.9 (d, C-3′, C-5′), 107.2 (s, C-10), 91.5 (d, C-8), 60.5 (q, 6-OMe), 56.8 (q, 7-OMe). 以上光谱数据与文献[10]报道的基本一致,因此化合物2鉴定为7-O-methyltectorigenin.
化合物3白色粉末.1H NMR (500 MHz, CD3COCD3)δ:8.15 (1H, s, H-2), 8.06 (1H, d,J= 8.8 Hz, H-5), 7.16 (1H, d,J= 2.0 Hz, H-2′), 7.05 (1H, dd,J= 8.3, 2.0 Hz, H-6′), 6.98 (1H,dd,J= 8.8, 2.1 Hz, H-6), 6.97 (1H,d,J= 8.3 Hz, H-5′), 6.90 (1H,d,J= 2.1 Hz, H-8), 3.87 (3H, s, 4′-OMe).13C NMR (125 MHz, CD3COCD3)δ:175.6 (s, C-4), 163.2 (s, C-7), 158.7 (s, C-9), 153.4 (d, C-2), 148.3 (s, C-4′), 147.0 (s, C-3′), 128.4 (d, C-5), 126.3 (s, C-1′), 125.0 (s, C-3), 121.0 (d, C-6′), 118.5 (s, C-10), 116.9 (d, C-2′), 115.6 (d, C-6), 112.1 (d, C-5′), 103.1 (d, C-8), 56.2 (q, 4-OMe). 以上光谱数据与文献[11]报道的基本一致,因此化合物3鉴定为calycosin.
化合物4淡黄色针晶.1H NMR (500 MHz, CD3COCD3)δ:8.24 (1H, s, H-2), 7.45 (2H, d,J= 8.6 Hz, H-2′, H-6′), 6.90 (2H, d,J=8.6 Hz, H-3′, H-5′), 6.68 (1H, s, H-8), 6.17 (2H, s, 6,7-OCH2O-).13C NMR (125 MHz, CD3COCD3)δ:182.3 (s, C-4), 158.5 (s, C-4′), 155.3 (s, C-5), 154.7 (d, C-2), 154.4 (s, C-9), 143.3 (s, C-7), 131.2 (d, C-2′, C-6′), 130.9 (s, C-6), 123.9 (s, C-1′), 122.6 (s, C-3), 115.9 (d, C-3′, C-5′), 108.7 (s, C-10), 103.8 (t, -OCH2O-), 89.9 (d, C-8). 以上光谱数据与文献[12]报道的基本一致,因此化合物4鉴定为irilone .
化合物5无色针状晶体.1H NMR (500 MHz, Pyr)δ:8.45 (1H, d,J= 8.5 Hz, H-5), 8.16 (1H, s, H-2), 7.78 (2H, d,J= 8.5 Hz, H-2′, 6′), 7.23 (1H, dd,J= 8.5, 2.0 Hz, H-6), 7.13 (1H, d,J= 2.0 Hz, H-8), 7.07 (2H, d,J= 8.5 Hz, H-3′, 5′), 3.69 (3H, s, 4′-OMe).13C NMR (125 MHz, Pyr)δ: 175.4 (s, C-4), 163.9 (s, C-7), 159.8 (s, C-4′), 158.3 (s, C-9), 152.5 (d, C-2), 130.6 (d, C-2′, 6′), 128.0 (d, C-5), 125.1 (s, C-1′), 124.4 (s, C-3), 117.7 (s, C-10), 115.7 (d, C-6), 114.0 (d, C-3′, 5′), 102.9 (d, C-8), 55.0 (q, 4′-OMe). 以上光谱数据与文献[13]报道的基本一致,因此化合物5鉴定为formononetin.
化合物6为淡黄色晶体.1H NMR (500 MHz, CD3COCD3)δ:7.75 (1H, d,J= 8.5 Hz, H-5), 7.60~7.40 (5H, m, H-2′~6′), 6.61 (1H, dd, J = 8.5, 2.5 Hz, H-6), 6.48 (1H, d,J= 2.5 Hz, H-8), 5.58 (1H, dd,J= 13.0, 3.0 Hz, H-2), 3.05 (1H, dd,J=17.0, 13.0 Hz, H-3a), 2.77 (1H, dd,J= 17.0, 3.0 Hz, H-3b).13C NMR (125 MHz, CD3COCD3)δ:189.2 (s, C-4), 164.5 (s, C-7), 163.4 (s, C-9), 139.6 (s, C-1′), 128.6 (d, C-4′), 128.4 (d, C-3′, 5′), 128.3 (d, C-5), 126.5 (d, C-2′, 6′), 114.5 (s, C-10), 110.4 (d, C-6), 102.8 (d, C-8), 79.8 (d, C-2), 43.9 (t, C-3). 以上光谱数据与文献[14]报道的基本一致,因此化合物6鉴定为7-hydroxyflavonone.
化合物7淡黄色晶体.1H NMR (500 MHz, CD3COCD3)δ:7.73 (1H,d,J=8.5 Hz, H-5), 7.06 (1H, d,J= 1.5 Hz, H-2′), 6.89 (1H, dd,J=8.5, 1.5 Hz, H-6′),6.88 (1H, d,J= 8.5 Hz, H-5′), 6.58 (1H, dd,J= 8.5, 2.2 Hz, H-6), 6.43 (1H, d,J=2.2 Hz, H-8), 5.39 (1H, dd,J= 13.0, 3.0 Hz, H-2), 3.02 (1H, dd,J= 16.5, 13.0 Hz, H-3a), 2.68 (1H, dd,J=16.5, 3.0 Hz, H-3b).13C NMR (125 MHz, CD3COCD3)δ:190.0 (s, C-4), 164.7 (s, C-7), 163.7 (s, C-9), 145.4 (s, C-3’), 145.1 (s, C-4’), 131.1 (s, C-1’), 128.6(d, C-5), 118.3 (d, C-6’), 115.1 (d, C-5’), 114.1(s, C-10), 113.8 (d, C-2’), 110.4 (d, C-6), 102.8 (d, C-8), 79.7 (d, C-2), 43.8 (t, C-3). 以上光谱数据与文献[15]报道的基本一致,因此化合物7鉴定为butin.
化合8物淡黄色针晶.1H NMR (500 MHz, CD3COCD3)δ:8.17 (2H, d,J= 9.0 Hz, H-2′, 6′), 8.02(1H,d,J= 9.0 Hz, H-5), 7.05 (1H, d,J=2.0 Hz, H-8), 7.02 (1H, d,J= 9.0 Hz, H-3′, 5′), 7.01 (1H, dd,J= 9.0, 2.0 Hz, H-6).13C NMR (125 MHz, CD3COCD3)δ:172.2 (s, C-4), 162.5 (s, C-9), 159.0 (s, C-4′), 157.1 (s, C-7), 144.6 (s, C-2), 137.1 (s, C-3), 129.3 (d, C-2′, 6′), 126.6 (d, C-5), 122.9 (s, C-1′), 115.4 (d, C-3′, 5′), 114.7 (d, C-6), 114.3 (s, C-10), 102.3 (d, C-8). 以上光谱数据与文献[16]报道的基本一致,因此化合物8鉴定为3,7,4′-trihydroxyflavone.
3 结语
对琴叶风吹楠枝叶开展了化学成分研究,从中共分离鉴定了8个黄酮类化合物,分别为tectorigenin (1), 7-O-methyltectorigenin (2), calycosin (3), irilone (4), formononetin (5), 7-hydroxyflavonone (6), butin (7), 3,7,4′-trihydroxyflavone (8).其中1~5为异黄酮,6,7为二氢黄酮,8为黄酮醇,化合物2~4为首次从该种植物中分离得到.上述研究进一步加深了对琴叶风吹楠化学成分的认识,对开发该属植物提供了一定的研究基础.

