猪支原体肺炎弱毒活疫苗与灭活疫苗联合免疫的免疫效果评估
彭 涛,马梓承,王宏宇,孟凡亮,刘照虎,肖一红,刘思当,2,3*
(1.山东农业大学 动物科技学院,山东 泰安 271018;2.山东省动物生物工程与疾病防治重点实验室,山东 泰安 271018;3.山东省畜禽疫病防制工程技术研究中心,山东 泰安 271018)
猪支原体肺炎(Mycoplasma pneumonia of swine,MPS),俗称猪气喘病、猪地方流行性肺炎,其病原是猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)。MPS 是一种以气喘和咳嗽为主要症状的猪呼吸系统慢性传染病,其感染率高,全球猪场均存在不同程度的MPS[1]。MPS 的剖检病变特征为肺脏尖叶和心叶呈“ 肉样”或“ 虾肉样”实变,也称之为“ 胰腺样变”[2]。哺乳仔猪、保育猪、育肥猪、公猪以及母猪均能够感染 Mhp[3]。据调查统计,全球猪群MPS 感染阳性率约为70 %~80 %,发病率为40 %以上[4]。患病猪生长发育不良,料肉比高[5-7],极大的增加了养殖成本并降低了猪肉的品质。因此,研究如何对该病进行有效防控具有重要的现实意义。
对于该病的防治措施主要是使用抗菌药物以及疫苗免疫,但由于Mhp 易产生耐药性,所以疫苗免疫是目前防控该病的主要发展方向[6]。目前商品化MPS 疫苗的种类繁多,免疫方式或免疫程序多样,如何制定科学合理的免疫程序,使猪群既能够获得良好的免疫效果又不至于造成严重的应激反应,是每个猪场急需解决的问题[8]。本研究选取市场上较为常用的MPS 灭活苗和弱毒活疫苗单独或联合免疫,对免疫猪群的应激反应及免疫效果进行检测评估,为猪场MPS 免疫程序的制定以及疫苗的开发生产提供参考依据。
1 材料与方法
1.1 疫苗及实验猪来源 MPS 灭活苗和弱毒活疫苗(厂家试验证明该疫苗株不能水平传播)购自某公司生产的市售产品(公司已批准该试验);实验猪购自山东省兴岳绿源养殖场,该猪场经产母猪产后10 d经MPS 活疫苗滴鼻同时灭活苗联合免疫,猪群常规免疫猪瘟、猪伪狂犬病及猪圆环病毒病疫苗。
1.2 主要试剂 肌酸激酶及乳酸脱氢酶检测试剂盒购自南京建成生物工程研究所;皮质醇放射免疫分析药盒购自北京北方生物技术研究所;MPS 抗体ELISA 检测试剂盒购自IDEXX 公司;猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)及猪圆环病毒2 型(PCV2)抗体检测试剂盒购自韩国金诺公司。
1.3 实验猪的疫苗免疫 本实验选取40 头10日呈阴性龄仔猪,实验猪经鼻拭子采样PCR 检测无Mhp感染,引物如表1 所示[9]。将实验猪随机平均分为4组,编号为 A、B、C、D组,每组 10 头,每头猪打耳号后仍由原母猪哺乳饲养,断奶后,将4组猪混合大群同栏饲养,保证生长环境、饲养方式以及营养状况等因素完全相同。A组肌肉注射免疫灭活疫苗,2 mL/ 头份;B组弱毒活疫苗喷鼻免疫,1 mL/ 头份;C组每头肌肉注射灭活疫苗2 mL 同时活疫苗1 mL 喷鼻免疫;D组为空白对照(不免疫)。
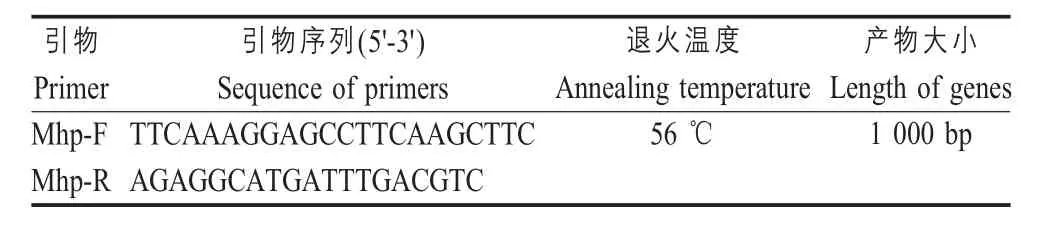
表1 Mhp 特异性引物Table 1 Mhp specific primers
1.4 应激相关指标检测 疫苗免疫后1 d~3 d,每天仔细观察并记录仔猪的各种临床表现,如采食、饮水和精神状态等。疫苗免疫后第3 d,每组随机选取5 头猪经前腔静脉采血,分离血清后置-80 ℃冻存,进行血清肌酸激酶(CK)活力、乳酸脱氢酶(LDH)活力、皮质醇激素(Cor)以及血清应激相关指标检测,检测方法严格按照说明书进行。
1.5 Mhp 病原检测 猪在疫苗免疫180 d 后出栏屠宰,分别从每组猪的肺尖叶和心叶取少量肺组织,将每头猪肺组织样品混合,加入灭菌PBS 研磨成匀浆,-80 ℃反复冻融 3 次,9 000 r/min 离心 5 min,取上清 200 μL,提取核酸,-20 ℃冻存备用。按表1 退火温度,30 个循环后,PCR 产物经 1.0 %琼脂糖凝胶电泳检测。
1.6 Mhp 抗体检测 分别在免疫后 3 d、30 d、90 d、180 d,经前腔静脉采血,分离血清,利用 ELISA 抗体检测试剂盒检测免疫猪Mhp 抗体水平。
1.7 免疫猪群体重的变化 疫苗免疫时对各组猪只称重,计算每组猪的平均初始体重;免疫后180 d各组猪屠宰时再次称重,计算各组猪的平均出栏重,计算平均增重。
1.8 肺脏眼观病变评分 将饲养180 d 的猪屠宰后,摘取各组猪的完整肺脏,采用100 分制评估猪肺脏病变程度(表2),计算各肺叶体积占整肺体积的比例对各个肺叶进行评级[10](左尖叶5 %、右尖叶6 %、左心叶 7 %、右心叶 9 %、左隔叶 32 %、右隔叶36 %、副叶5 %),并根据肺脏表面肉眼可见病变面积占该肺叶表面积的比例,计算统计将各肺叶病变比例相加求和评定肺脏病变等级。
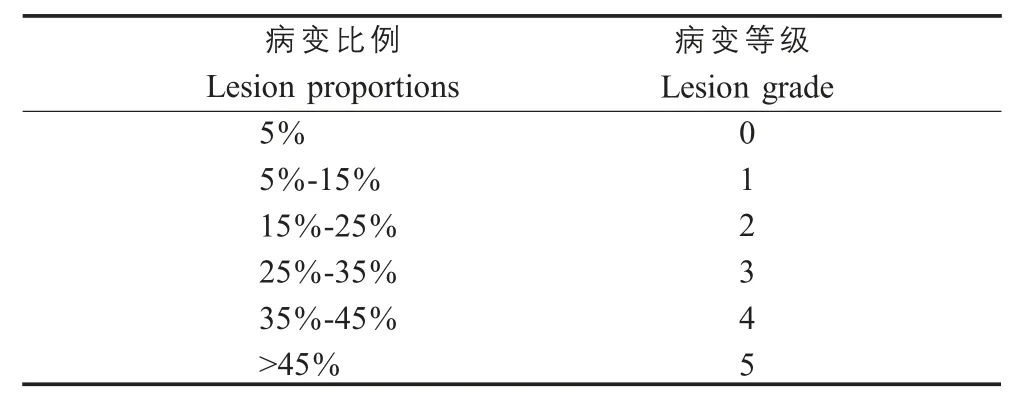
表2 肺脏病变比例与等级判定Table 2 The proportion of lung lesions and the degree
1.9 肺脏镜检病变评分 将每组猪肺脏的7 个肺叶单独取样,常规方法制作石蜡切片,HE 染色,镜检肺组织间质性肺炎病变,据病变程度分为无病变、轻度、中度、重度间质性肺炎 4 个等级,分别计 0 分、1 分、2 分、3 分,将每组猪肺脏的 7 个肺叶病变分数相加,统计肺脏总体病变程度,最后计算出每组猪的肺脏平均病变程度。
1.10 常见病毒病的抗体水平检测 取免疫后30 d、90 d、180 d 采集的血清,采用 ELISA 试剂盒对 CSFV、PRRSV、PRV gE、PCV2 抗体水平进行检测,分析不同的MPS 疫苗免疫对常见病毒病疫苗免疫或感染产生的影响。
2 结 果
2.1 疫苗免疫后各组猪应激相关指标检测
2.1.1 CK 活力值检测 经试剂盒检测结果显示,A组、B组、C组猪CK活力值分别为0.303 U/mgprot、0.43 U/mgprot、0.673 U/mgprot,均比对照组猪CK活力值 0.282 U/mgprot 高;其中 A组猪 CK活力值最低,C组猪CK 活力值明显高于其他组,差异极显著(p<0.01) (图1),表明 A组疫苗免疫对猪群应激反应较小,C组疫苗免疫对猪群应激反应相对较大。
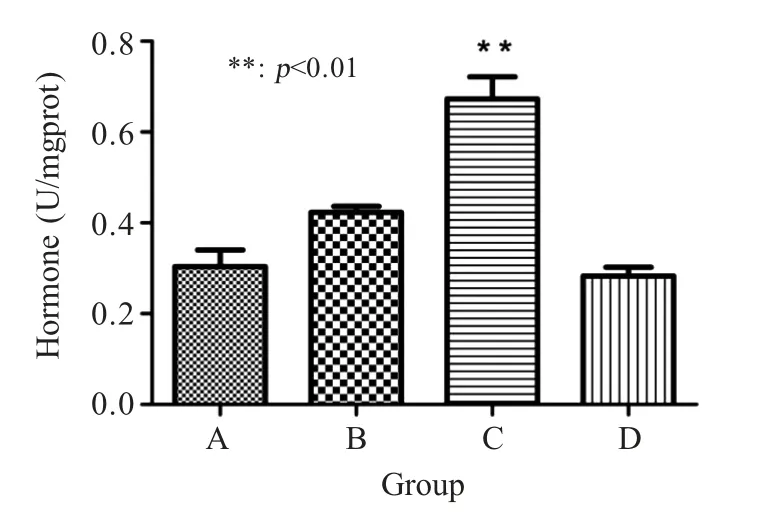
图1 各组猪平均CK 活力值检测结果Fig.1 Average CK activity values of pigs in each group
2.1.2 LDH 活力值检测 经试剂盒检测结果显示,A组、B组、C组猪 LDH 活力值分别为 3981.699 U/L、4339.869 U/L、4094.118 U/L,与对照组猪 3688.889 U/L相比,有升高的趋势,其中A组猪 LDH 活力值最低,B组猪LDH 活力值最高,但统计分析差异不显著(p>0.05) (图2),表明各组疫苗免疫猪后,对 LDH水平影响不显著。

图2 各组猪平均LDH 活力值检测结果Fig.2 Average LDH activity values of pigs in each group
2.1.3 Cor 活力值的检测 经试剂盒检测结果显示,A组、B组、C组猪 Cor 活力值分别为 89.85 pg/mL、92.91 pg/mL、150.05 pg/mL,与对照组猪 81.61 pg/mL比较有明显的升高,其中 A组猪 Cor 最低,C组Cor 高于其它组,差异极显著(p<0.01) (图3),表明A组疫苗免疫对猪群应激反应较小,C组疫苗对猪群应激反应较大。
2.1.4 应激相关指标整体分析 疫苗免疫后,应激相关指标检测结果显示,A组疫苗免疫对猪应激反应较小,C组疫苗免疫对猪应激反应相对较大。但从猪整体情况来看:各组疫苗免疫后,对猪的精神状态、采食量、饮水量均未见明显影响,表明各组疫苗免疫均未对猪造成严重的应激反应。
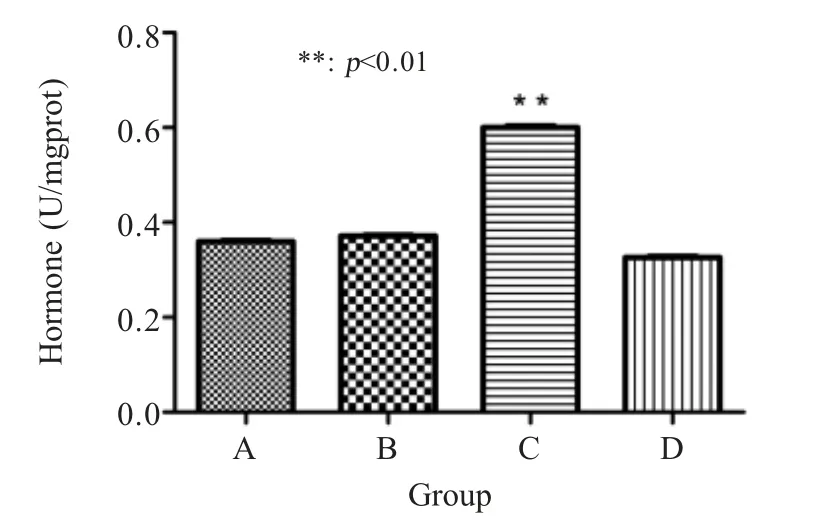
图3 各组猪平均Cor 活力值检测结果Fig.3 Average Cor activity values of pigs in each group
2.2 各组猪Mhp 病原检测 180 d 屠宰后取各组猪的肺脏进行 PCR 检测,结果显示:对照组 Mph 猪阳性率最高,为 50 % (5/10);A组、B组、C组猪同样存在Mhp 感染,但阳性率较低,3组猪阳性率分别为 :A组 40 % (4/10);B组 30 % (3/10);C组30 % (3/10),表明 A、B、C组经疫苗免疫后,均有效降低了猪群Mhp 的感染率。
2.3 各组猪Mhp 抗体水平检测 免疫后不同时间各组猪抗体检测结果显示,B、C组猪Mhp 抗体阳性率明显高于 A组。在疫苗免疫后 30 d,B、C组猪抗体阳性率均为 80 %,A组仅为 40 %。S/P 值A、B、C组分别为0.452、0.641、0.782,C组 最高,B组次之,B、C组均达到了较高的抗体水平;疫苗免疫后90 d,虽然抗体水平虽然有所降低,3个免疫组猪抗体阳性率均为 60 %,B、C组猪 S/P值分别为0.790、0.773,但仍维持在较高的抗体水平,A组抗体水平较低,维持在 0.48 左右,表明 A组疫苗免疫后,机体未产生良好的免疫应答反应;在免疫后 30 d 与 90 d 时,对照组猪的抗体阳性率为0。根据相关资料查阅得知母源抗体一般维持3~4 周,对照组猪免疫后 3 d (13日龄),Mhp 抗体阳性率高达100 %,而免疫后30 d 其抗体阳性率为0,表明母源抗体存在时间 <40日龄,这一实验数据符合母源抗体消减规律;结合免疫后180 d 迫杀时各组猪 Mhp 病原检测均为阳性(表3,图4),表明各疫苗免疫组后期均未能阻止Mhp 感染。
2.4 免疫猪平均增重结果 A组、B组、C组猪与对照组相比,平均增重分别提高了1.37 %、13.38 %和21.53 % (图5);C组猪平均日增重明显高于其它组,差异显著(p<0.05)。表明 C组疫苗免疫对猪产生了较好保护,提高了其生产性能。

表3 免疫后不同时间各组猪平均抗体阳性率检测结果Table 3 The average positive antibody rate of each group at each stage
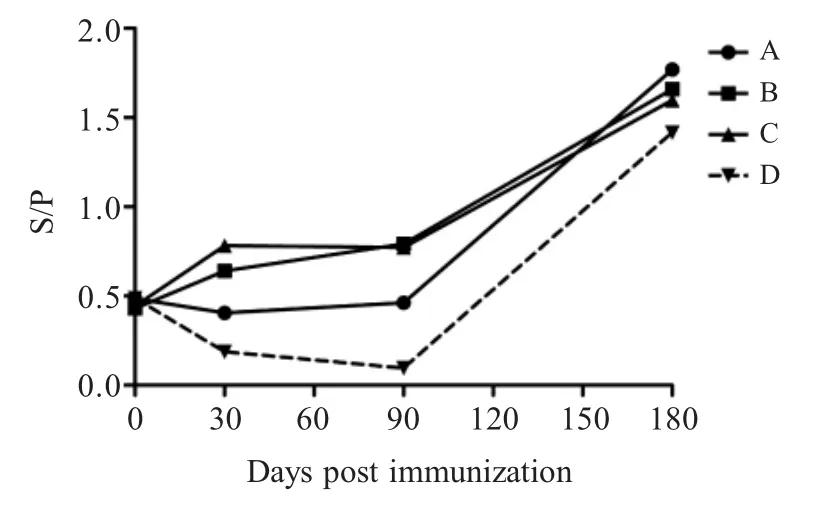
图4 各阶段每组猪抗体平均水平Fig.4 Levels of antibody in each group at each stage
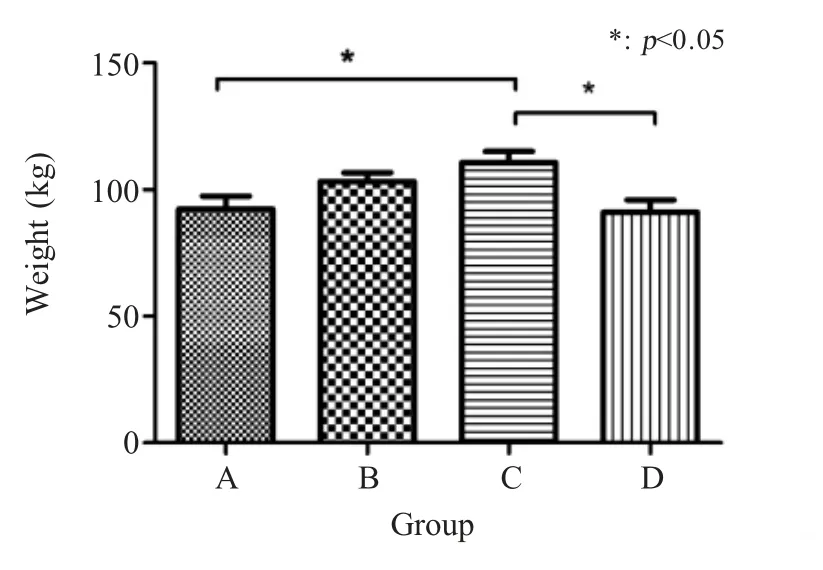
图5 各组猪免疫后的平均增重水平Fig.5 The average body weight-gain of the pigs in each group
2.5 免疫猪肺脏病变评分
2.5.1 肺脏眼观病变评分 对各组猪肺脏眼观病变测量及计算,结果显示,A组、B组、C组、D组猪肺脏总体病变比例分别为35.71 %、37.67 %、32.49 %、47.25 %,病变程度D组>B组>A组 >C组,对照组猪病变程度最高,与其它组相比差异显著(p<0.05),C组病变程度最轻。表明,疫苗免疫后,均可以减少肺脏的病变程度,其中C组疫苗免疫效果最好,更加有效的减轻了肺脏的病变程度。
2.5.2 免疫猪肺脏镜检病变评分 为了进一步判定Mhp 对不同免疫程序的猪肺脏感染程度,将肺脏镜检评分标准设立如下(表4)。结果显示:A组、B组、C组、D组肺脏病变分数分别为:50、45、38、59。其中D组和A组肺脏镜检病变最严重,肺泡壁增厚,支气管周围淋巴细胞浸润,呈严重的间质性肺炎病变,C组肺脏镜检病变程度较轻。表明A组疫苗免疫后,未对猪肺脏产生较好的保护;B组对猪肺脏的保护也较差;C组疫苗免疫后,有效减少了肺脏病变的产生,获得了较好的免疫保护。
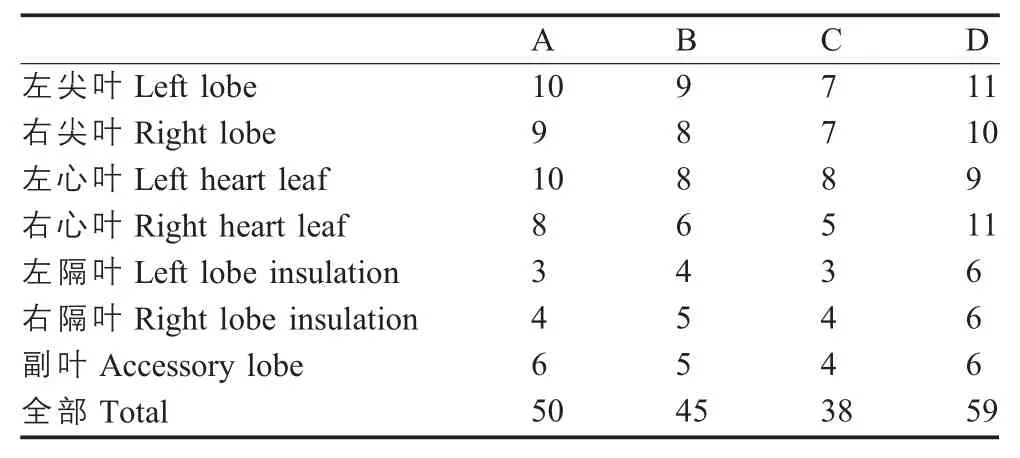
表4 各组猪肺脏镜检评分Table 4 The pulmonary microscopy scores
2.6 常见病毒病抗体水平检测 将免疫后不同时间各组猪的血清进行 CSFV、PRRSV、PRV gE、PCV2抗体水平检测,结果显示各组之间抗体平均OD450nm值未见明显差异(p>0.05) (图6),表明各组猪经MPS疫苗免疫后未对 CSFV、PRRSV、PRVgE、PCV2 的血清抗体水平产生显著影响。各组猪免疫后具体指标如表5所示。
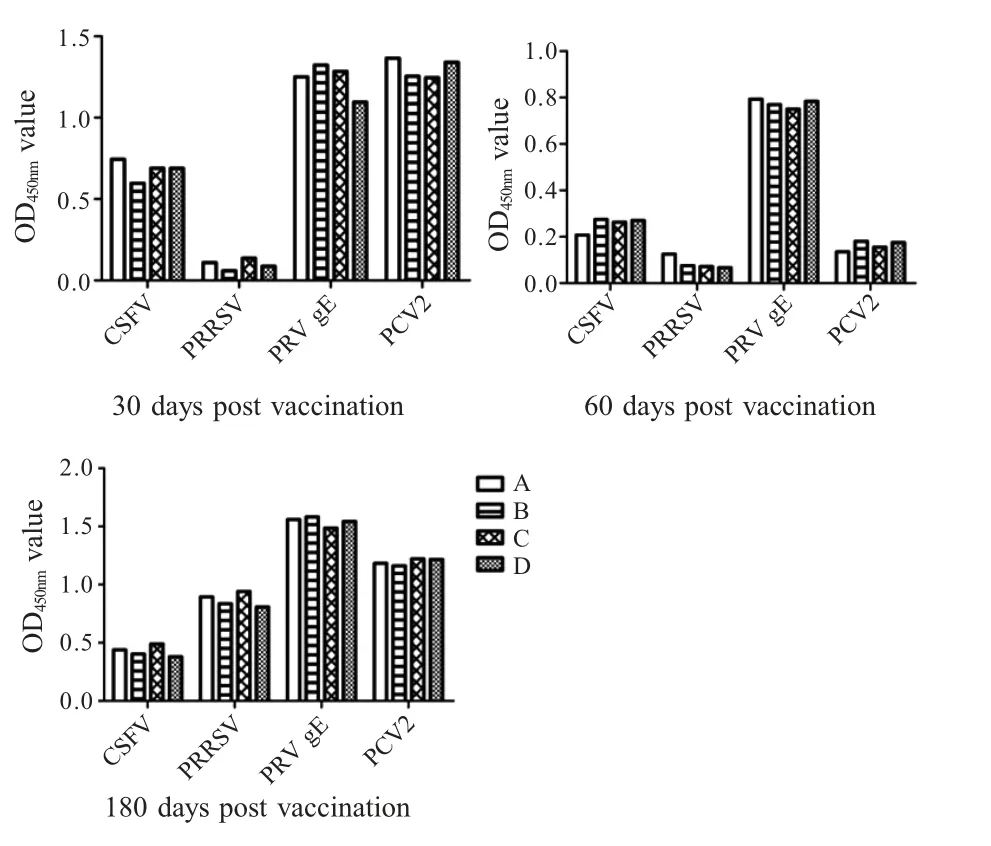
图6 免疫后不同时间各组猪常见病毒抗体水平的比较Fig.6 Comparison of antibody levels at different days post vaccinations

表5 各组猪综合指标Table 5 Comprehensive indicators of each group
3 讨 论
MPS 是造成猪场严重经济损失的重要疫病之一,如何有效防控Mhp 感染是每个猪场急需解决的问题。本研究采用MPS 灭活疫苗以及弱毒活疫苗可单独或联合免疫,进行Mph 病原、应激相关指标以及有关疾病的抗体检测,计算平均增重并进行肺脏病变评分,为MPS 免疫程序的科学制定提供实验依据,达到有效控制MPS 的目的。
疫苗免疫后血清应激相关指标检测显示,灭活苗免疫组猪血清 CK、LDH 以及 Cor 的含量较低,而活苗免疫组猪含量较高,表明灭活苗免疫应激反应小于活疫苗免疫,尤其是弱毒苗与灭活苗联合免疫会产生更加明显的应激反应。但从猪整体情况来看,各疫苗免疫后未见明显的异常表现,表明各组疫苗免疫均未对猪产生严重的应激反应。
对肺组织的Mhp 病原检测结果显示,对照组猪阳性率最高,3 个免疫组猪后期同样存在Mhp 感染,但阳性率较低,表明疫苗免疫虽然不能完全阻断 Mhp 感染,但能有效降低猪 Mhp 的感染率。Villarreal 等比较了田间条件下疫苗免疫对仔猪Mhp 感染的影响,免疫组和对照组猪的Mhp 检出率分别为14 %和 36 %[11],这表明 MPS 疫苗不能完全阻止Mhp 的感染定植,部分猪被感染,但与对照组相比,疫苗免疫降低了猪的病原检出率,本研究结果与该报道一致。
对疫苗免疫后各组Mhp 抗体水平检测结果表明,活苗免疫组和联合免疫组具有更高的抗体阳性率,两者阳性率相同。但联合免疫组免疫后30 d 检测抗体S/P 值明显高于活疫苗免疫组,灭活苗免疫组抗体水平较低。表明采用MPS 灭活疫苗和弱毒活疫苗联合免疫,更能刺激机体产生免疫反应。同时,对照组猪抗体水平趋势显示,40日龄时母源抗体已消失;在疫苗免疫后180 d 各组猪抗体水平急剧上升,抗体阳性率均为100 %,表明猪在100日龄后全部发生了Mhp 感染,这是否意味着早期一次疫苗免疫,在免疫后90 d~180 d 时,疫苗保护力有所下降已不足以保护猪免受Mhp 的感染,一免后间隔一段时间加强免疫是否会取得更好的免疫效果,有待于试验验证。
对猪平均增重对比结果显示C组猪平均日增重明显高于A、B 两组,表明灭活苗和活苗联合免疫对猪产生了较好保护,提高了其生产性能。Maes 等对不同商品猪经MPS 疫苗免疫对其平均日增重的影响进行了研究,发现免疫可以使猪的平均日增重提2 %~8 %[12],与本研究结果一致。
对肺脏眼观以及镜检病变评分,总体来看,疫苗免疫后各组猪肺脏病变程度均小于空白对照组,表明疫苗免疫后能对猪肺脏产生免疫保护。但镜检显示灭活苗免疫组猪的肺脏MPS 的特征性病变仍然较明显,病变较重,其对猪肺脏的保护力较低;活疫苗单独免疫组猪的肺脏病变也较明显甚至眼观病变评分还不如灭活苗单独免疫组;联合免疫组猪的肺脏病变比例小,病变程度轻,对猪肺脏产生了较好保护。
各组猪 CSFV、PRRSV、PRVgE、PCV2 抗体水平差异不显著,表明各组MPS 疫苗免疫未对常见病毒病疫苗免疫或感染产生显著影响。该实验还意外发现,在猪未免疫 PRRSV 疫苗的背景下,MPS 疫苗免疫后90 d 检测时PRRSV 抗体呈阴性,免疫后180 d,PRRSV 抗体呈阳性,表明猪在育肥后期感染了 PRRSV;猪在 10日龄时免疫 PCV2,免疫后30 d 抗体水平较高,免疫后90 d 时抗体水平呈阴性,表明猪体内PCV2 抗体水平消失,出栏屠宰时PCV2 抗体水平呈强阳性,S/P 值急剧升高,表明实验猪在100日龄后也发生了PCV2 感染。
综合上述实验结果,MPS 灭活疫苗和弱毒活疫苗联合免疫的效果显著好于二者的单独免疫,联合免疫虽然应激反应较大,但对猪未产生明显的不良影响。另外,1 次免疫3 个月后免疫保护力会明显下降,存在感染风险。由于条件限制本次实验每组仅设10 只实验猪,因此结论是基于较少实验动物得出的,具有一定的误差,对于生产实际的指导作用有待于大数据的验证和支持。
基于试验结果,自繁自养场MPS 的免疫可参考如下免疫程序:(1)商品猪免疫程序:7日龄~10 龄活疫苗1 倍量滴鼻,同时灭活苗1 倍量肌肉注射;若猪场感染压力大建议二次加强免疫,即28日龄左右灭活苗1 倍量肌肉注射。(2)种猪:前期按商品仔猪免疫;后备猪配种前两次灭活苗肌肉注射,间隔4 周;经产母猪产后21 d 灭活苗肌肉注射。

