PDR患者PPV术前行雷珠单抗注射对手术效果及并发症的影响
胡海涛,孙 涛,王 红,吴华新,郝兰香
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病较为常见的并发症之一,近年来发病率呈现升高趋势,发生原因是由糖尿病导致的微血管病变导致的,严重的DR是目前导致糖尿病患者失明的重要原因。糖尿病会造成患者视网膜微血管改变、眼内新生血管形成等严重并发症,因此临床需要积极开展干预治疗[1]。以往临床主张对DR合并玻璃体积血采取玻璃体切割手术治疗,但是部分患者术后视力恢复仍较差,而且手术过程中要将增殖膜完全切割干净以缓解其对视网膜牵拉作用,而增殖膜表面存在大量的新生血管,剥除过程中会出血,甚至会造成视网膜损伤,因此增加了手术治疗难度。雷珠单抗属于人源化的重组单克隆抗体片段,近年来研究发现其具有靶向性作用,能够抑制人血管内皮生长因子的表达,能有效地抑制新生血管的发生[2]。本研究观察了增生型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者行玻璃体切割术(PPV)前玻璃体内注射雷珠单抗对手术效果的影响,以期为临床提供指导和依据,现汇报如下。

表1 两组患者的基线资料对比
注:对照组:仅给予玻璃体切割手术治疗;观察组:术前玻璃体腔注射雷珠单抗联合玻璃体切割手术治疗。

表2 术前术后两组患者的视力比较眼(%)
注:对照组:仅给予玻璃体切割手术治疗;观察组:术前玻璃体腔注射雷珠单抗联合玻璃体切割手术治疗。
1对象和方法
1.1对象采用前瞻性研究方法,选取我院2016-01/2018-01拟实施PPV手术的PDR患者84例106眼,采用随机数字表法分为观察组和对照组,各42例。两组研究对象的年龄、性别、糖尿病病程、术前BCVA比较,差异均无统计学意义(P>0.05),见表1。
1.1.1纳入标准(1)糖尿病的诊断标准参考中华医学会内分泌学分会制定的诊断标准;(2)PDR的诊断标准参考美国眼科协会临床指南《糖尿病视网膜病变2014年版》,处于增殖期;(3)均为首次治疗的患者,所有患者均由我院一位具有10a手术经验的医生完成;(4)本研究经医学伦理委员会批准,术前与患者签署知情同意书。
1.1.2排除标准(1)青光眼;(2)眼部感染;(3)白内障;(4)高血压患者;(5)凝血系统疾病;(6)伴有其他禁忌证。
1.2.1治疗方法观察组:手术前7d玻璃体腔注射雷珠单抗,常规消毒后采用奥布卡因表面麻醉,使用碘伏对结膜囊进行冲洗,使用1mL注射器抽取雷珠单抗0.05mL(0.5mg)在颞下距离角巩膜缘4mm注入玻璃体腔。7d后给予患者23G玻璃体切割手术,常规巩膜三切口,全视网膜镜下切除中轴部和周边部玻璃体,使用23G玻璃体切割头及眼内镊对增殖膜进行剥离及切除,解除增殖膜对视网膜的牵拉,手术过程中对出血点给予电凝止血,行全视网膜光凝,手术结束时如有必要时可以行硅油填充。对照组:仅给予玻璃体切割手术治疗,方法同观察组。两组手术操作均由同一技术成熟医师开展操作。
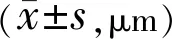
表3 两组患者的黄斑中心凹厚度比较
注:对照组:仅给予玻璃体切割手术治疗;观察组:术前玻璃体腔注射雷珠单抗联合玻璃体切割手术治疗。
1.2.2观察指标及其检测方法检测对比两组患者手术前后的最佳矫正视力(BCVA)、黄斑中心凹厚度、血清血管内皮生长因子(VEGF)、人生长停滞特异性蛋白6(GAS6)、人基质细胞衍生因子-1(SDF-1)、手术并发症,患者定期到我院门诊接受医生检查及眼底相关检查(包括对术后再出血的观察、医源性裂孔观察及眼底光学断层扫描)。抽取空腹静脉血5mL离心分离上清液待检,采用酶联免疫吸附法测定VEGF浓度,采用双抗体夹心法测定GAS6、SDF-1浓度变化,所有试剂盒均由南京建成生物制品有限公司提供,严格按照试剂盒说明书进行操作。
2结果
2.1两组患者视力比较术前,观察组和对照组的BCVA差异无统计学意义(Z=-0.411,P=0.681);术后3mo,观察组的BCVA显著优于对照组,差异有统计学意义(Z=-2.239,P=0.025),见表2。
2.2两组患者黄斑中心凹厚度比较术后1wk,观察组的黄斑中心凹厚度测定值低于对照组,差异有统计学意义(P<0.01);术后3mo,观察组和对照组的黄斑中心凹厚度差异无统计学意义(P>0.05),见表3。
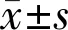
表4 两组患者手术前后血清VEGF、GAS6、SDF-1水平比较
注:对照组:仅给予玻璃体切割手术治疗;观察组:术前玻璃体腔注射雷珠单抗联合玻璃体切割手术治疗。

表5 两组患者手术并发症情况比较眼
注:对照组:仅给予玻璃体切割手术治疗;观察组:术前玻璃体腔注射雷珠单抗联合玻璃体切割手术治疗。
2.3两组患者手术前后血清VEGF、GAS6、SDF-1水平比较术前,两组患者的血清VEGF、GAS6、SDF-1水平差异均无统计学意义(P>0.05);术后1wk,观察组的血清VEGF、GAS6、SDF-1水平均低于对照组,差异均有统计学意义(P<0.01),见表4。
2.4两组患者手术并发症发生率比较观察组的并发症发生率为5.9%,低于对照组的20.0%,差异有统计学意义(P<0.05),见表5。
3讨论
糖尿病视网膜病变是糖尿病极为常见的并发症,发病率呈现逐年升高的趋势,也是临床导致患者致盲的重要原因,其造成患者视力损伤的重要原因是由于黄斑部位出现水肿以及新生血管形成和毛细血管发生闭塞[3]。研究发现糖尿病视网膜病变的发生同糖尿病病程具有明显相关性,随着病程延长,DR的发生率呈现明显升高趋势,其病变的基础为微血管病变,人体视网膜毛细血管包括了内皮细胞、基底膜与周细胞,发生DR后患者周细胞出现选择性丢失,基底膜变厚,形成了局部的微血管瘤,而且内皮细胞增生,毛细血管的代偿功能弱化,内皮细胞屏障功能下降,血液成分发生外渗后导致毛细血管的闭塞,最终导致视网膜缺血[4]。研究还显示糖尿病患者体内存在大量的糖基化终产物,一方面可导致细胞与组织功能受到影响形成慢性并发症,包括视网膜血液供应无法维持视网膜正常结构与起到维持营养视网膜神经上皮细胞功能作用[5];另一方面可以同特异性受体相结合并改变蛋白质与细胞功能,造成了内皮细胞通透性升高,产生较多炎性介质并吸引激活其他炎性效应细胞,引发了血管壁结构的改变[6-7]。目前认为增生型糖尿病视网膜病变为糖尿病视网膜病变的终末期,临床主要通过玻璃体切除手术进行治疗,对新生血管造成的玻璃体腔出血进行清除,同时解除增殖膜的牵拉作用以恢复视网膜正常位置,减少血管内皮细胞生长因子水平以达到挽救患者视力的目的。由于国人中采取激光治疗尚未能普及,而开展玻璃体切割手术术中可能由于牵拉造成新生血管发生破裂导致手术视野模糊,增加手术难度[8]。另一方面相关研究还发现玻璃体切割手术还容易诱发玻璃体再出血,部分患者体内凝血因子发生失衡导致血液不容易凝固,不利于手术进行[9-10]。此外手术后也容易发生眼压升高,主要是由于手术应激产生的炎症反应以及手术结束时使用的眼内填充物导致。近年来研究发现在手术过程中联合使用抗血管药物可以消退新生血管形成,对于减少术中出血效果显著,便于医师开展手术操作,减少了手术并发症发生。为了提高玻璃体切割手术的治疗效果并减少并发症,本研究联合雷珠单抗注射辅助治疗,该药物属于重组人源抗血管内皮生长因子单克隆抗体片段,可以和机体血管内皮生长因子的亚型进行结合,使新生血管消退,减少血管渗漏的发生[11]。雷珠单抗可以穿透内界膜进入视网膜下的间隙,减少了内皮细胞增生,使新生血管萎缩,减少术中出血,降低手术难度,便于手术开展,同时缩短了手术时间从而减少手术并发症的发生[12]。郭翠玲等[2]报道采用雷珠单抗玻璃体腔注射对增生型糖尿病视网膜病变患者血糖影响不明显,但能有效抑制血清VEGF的生物学特性,效果更明显,同本研究结果相似。本研究观察了多种相关细胞因子水平在围手术期的变化,其中血管内皮生长因子是最为常用的指标,其水平升高表明患者体内有新生血管形成,因此抑制血管内皮生长因子提示了新生血管形成减少[13]。GAS6则具有参与血小板糖蛋白结合的作用,进而促进纤维蛋白原和血小板发生交联,减少新生血管出血的发生。而SDF-1属于细胞趋化因子,通过与相应受体结合诱导了内皮祖细胞朝向病灶进行集聚,而且现代研究证实了其水平同视网膜新生血管数量具有正相关性[14]。本研究发现术后1wk,观察组的血清VEGF、GAS6、SDF-1水平低于对照组,说明PPV前玻璃体内注射雷珠单抗应用在PDR患者中可以抑制新生血管生成,改善病情并在一定程度上降低手术难度,也表明注射雷珠单抗对抑制患者血管形成具有重要作用,能够提升手术治疗的效果。
本研究显示,术后3mo,观察组的BCVA显著优于对照组,说明PPV前玻璃体内注射雷珠单抗应用在PDR患者中可以显著恢复视力。术后1wk,观察组的黄斑中心凹厚度测定值低于对照组;术后3mo,观察组和对照组的黄斑中心凹厚度差异无统计学意义(P>0.05),说明PPV前玻璃体内注射雷珠单抗应用在PDR患者能够降低黄斑中心凹厚度。观察组的并发症发生率(5.9%)低于对照组的20.0%,说明PPV前玻璃体内注射雷珠单抗应用在PDR患者中可以减少手术并发症发生。本研究的优势在于证实了术前应用雷珠单抗玻璃体腔注射提高了PPV手术对PDR患者的治疗作用,为临床寻求合理的更为可靠的治疗PDR的综合方案奠定了基础,但是本研究纳入患者数量有限,随访时间较短,因此还需要进一步开展多中心、大样本量、随机性试验深入论证。
2郭翠玲,赵仲平,何琼敏,等. 雷珠单抗玻璃体腔注射对增生性糖尿病视网膜病变患者血清血管内皮生长因子的影响.医学综述2016;22(10):1984-1987
3朱丽,陈晓,宋艳萍,等. 玻璃体腔注射雷珠单抗联合25G玻璃体视网膜手术治疗增生型糖尿病视网膜病变的临床观察. 中华眼底病杂志2016;32(1):22-25
- 国际眼科杂志的其它文章
- Correlations among macular pigment optical density, central macular thickness and body mass index
- 超乳联合房角分离或小梁切除对PACG合并白内障患者血流动力学的影响
- 飞秒激光辅助白内障手术在硬核白内障患者中的应用
- Differences in pain and inflammation between Diclofenac 0.1% and Nepafenac 0.1% after cataract surgery
- 利用577nm阈值下微脉冲激光治疗糖尿病性黄斑水肿
- 隐形遮盖镜与压抑膜疗法治疗大龄单眼弱视的疗效比较

