超乳联合房角分离或小梁切除对PACG合并白内障患者血流动力学的影响
张伽雨,彭 娜,李 磊
0引言
原发性闭角型青光眼(PACG)、白内障均为常见眼科疾病,前者发生与瞳孔阻滞密切相关,后者典型特征为晶状体混浊,年龄、遗传等多种因素均可致病[1-2]。PACG与白内障可相互影响,且可同时发生,增加治疗难度[3]。既往针对PACG合并白内障,多采取Ⅰ期抗青光眼滤过手术、Ⅱ期白内障手术治疗,创伤大,并发症多,患者痛苦大。
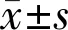
表1 两组患者手术前后OA血流动力学指标比较
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。aP<0.05vs同组术前;cP<0.05vs对照组。
近年来随着眼科手术的进步,白内障超声乳化联合术式成为PACG合并白内障治疗的重要手段[4-6]。其中白内障超声乳化能有效解除瞳孔阻滞,改善因晶状体膨胀引发的眼前段拥挤[7]。但关于白内障超声乳化联合何种术式治疗PACG合并白内障仍存在一定的争议。本研究主要比较分析超声乳化白内障吸除分别联合房角分离术与小梁切除术治疗PACG合并白内障的效果,现报道如下。
1对象和方法
1.1对象选择巴中市中心医院2015-01/2017-06收治的PACG合并白内障患者94例94眼。入选标准:(1)符合PACG相关诊断标准[8],房角镜检查显示房角狭窄或关闭,前房角粘连闭合≤270°;(2)裂隙灯检查显示晶状体混浊,晶状体核硬度Ⅱ~Ⅲ级;(3)均首次发病,术前最佳矫正视力(BCVA)≤0.5;(4)术前均获知手术相关情况,知情并签订手术同意书。排除标准:(1)继发性青光眼、创伤性白内障;(2)合并剥脱综合征等其他眼部疾病;(3)合并高血压病等全身系统性疾病;(4)手术禁忌证、手术不耐受者;(5)相关资料不全者。随机数字表格法将患者分为超声乳化白内障吸除联合房角分离术(观察组)与超声乳化白内障吸除联合小梁切除术(对照组),各47例。观察组中男19例,女28例;年龄52~80(平均60.82±6.31)岁;粘连性房角闭合180°~270° 24例,90°~<180° 23例。对照组中男21例,女26例;年龄50~81(平均61.05±6.28)岁;粘连性房角闭合180°~270° 22例,90°~<180° 25例。两组性别、年龄比较,差异无统计学意义(P>0.05)。本次研究经医院伦理委员会批准。
1.2方法
1.2.1术前准备所有患者术前均接受视力、裂隙灯、前房角镜、眼压等检查,且术前均接受降眼压药物干预,控制眼压<25mmHg。
1.2.2手术操作(1)白内障超声乳化吸除联合前房分离术:手术操作前充分散瞳,选择仰卧位,常规消毒铺巾,开睑,盐酸丙美卡因表面麻醉;在3∶00方向行透明角膜缘辅助切口,对颞上象限行透明角膜切口,大小2.8mm左右,黏弹剂注入前房,连续环形撕囊,对晶状体皮质和核水分离,超声乳化将晶状体核吸除,皮质彻底抽吸后将黏弹剂360°注入虹膜根部,房角撑开,一边推注一边往下对虹膜根部压迫,完全分离房角粘连处,随后将人工晶状体植入囊袋;I/A头进入前房,慢慢靠近周围房角,灌注液对房角进一步冲刷,术前粘连严重者可对周边虹膜吸引牵拉,以较好地分离房角;最后对残留黏弹剂清理;手术结束时妥布霉素地塞米松眼膏涂患眼,无菌包扎。(2)白内障超声乳化吸除联合小梁切除术:表面麻醉及之前操作同观察组;于11∶00~1∶00方向制作结膜瓣(基底为穹窿部),巩膜面制作1/2虹膜厚度的巩膜瓣,大小3mm×3mm,分离到透明角膜内约1mm,于角膜缘3∶00方向行透明角膜缘辅助切口,黏弹剂注入前房,连续环形撕囊,超声乳化操作同观察组;人工晶状体植入后对残留黏弹剂清理,之后经由侧切口对前房深度调整,卡巴胆碱注入以缩瞳,将2mm×1mm小梁组织及虹膜周边切除,巩膜瓣与结膜缝合;前房恢复,手术结束时妥布霉素地塞米松眼膏涂患眼,无菌包扎。
2结果
2.1视网膜中央动脉血流动力学变化两组PSV、EDV组间、不同时间点比较差异有统计学意义(PSV:F组间=17.483,P组间<0.01;F时间=18.087,P时间<0.01;EDV:F组间=8.433,P组间=0.006;F时间=19.357,P时间<0.01)。两组RI组间比较差异无统计学意义(F组间=0.510,P组间=0.479),RI不同时间点比较差异有统计学意义(F时间=6.462,P时间=0.014);PSV、EDV、RI组间与时间交互均无统计学意义(F交互=3.498、1.092、0.025,P交互=0.068、0.302、0.875)。观察组术后1、3mo PSV、EDV均明显大于对照组,术后3mo RI明显小于对照组(P<0.05),见表1。
2.2 BCVA变化术前,两组BCVA比较差异无统计学意义(Z=0.980,P=0.322);术后3mo,观察组和对照组BCVA比术前均明显改善,差异均有统计学意义(Z=7.712、7.480,均P<0.001);两组术后BCVA比较差异无统计学意义(Z=0.280,P=0.597),见表2。

表2 两组患者手术前后BCVA比较眼(%)
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。
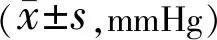
表3 两组患者手术前后眼压比较
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。

表4 两组患者手术前后前房深度比较
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。
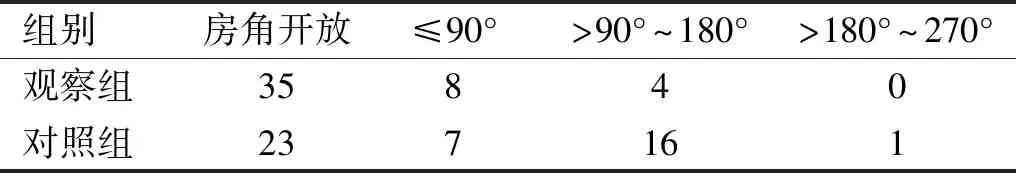
表5 两组患者术后3mo房角情况比较眼
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。
2.3手术前后眼压变化术前,两组眼压比较差异无统计学意义(P>0.05);术后3mo,两组眼压比术前均明显下降,差异均有统计学意义(P<0.001);两组术后眼压比较差异无统计学意义(P>0.05),见表3。
2.4手术前后前房深度变化术前,两组前房深度比较差异无统计学意义(P>0.05);术后3mo,两组前房深度比术前均明显增加,差异均有统计学意义(P<0.01);观察组术后前房深度明显大于对照组,差异有统计学意义(P<0.05),见表4。
2.5术后3mo房角情况观察组术后3mo房角开放程度明显优于对照组,差异有统计学意义(Z=8.693,P=0.003),见表5。
2.6并发症情况观察组术后并发症总发生率6%,较对照组的30%差异有统计学意义(χ2=8.689,P=0.03),见表6。
3讨论
本研究结果显示白内障超声乳化吸除联合房角分离术或小梁切除术均能明显改善PACG合并白内障患者视力,有效控制眼压,与苟文军等[16]研究结果相符,这可能与白内障超声乳化可从发病机制上阻断闭角型青光眼发生有关。而前房深度方面,超声乳化白内障吸除联合房角分离术相比小梁切除术有优势,与李自圆[17]研究结果一致,这可能与房角分离相对开放粘连房角成功率高有关,本研究观察组术后3mo房角开放程度比对照组优证实这一点。另外本研究发现联合房角分离术相比小梁切除术并发症总发生率显著低,特别是低眼压,这可能与小梁切除术滤过过强、刺激房水生成减少有关。
眼压上升被认为是青光眼患者视力损伤的根本因素,但其并非唯一要素,血流动力学变化等均可单独导致视力损伤,也能和眼压共同致病。临床关于青光眼血流动力学研究较多,但关于不同术式对闭角型青光眼合并白内障患者血流动力学的影响研究较少。彩色多普勒超声成像对血流参数能定量测定,且具有无损伤性、可重复操作等特点。前段视神经动脉血液供应均源自OA分支,为此本研究选择OA血流动力学指标观察。本研究结果显示超声乳化白内障吸除联合房角分离术相比小梁切除术能更好地改善患者OA血管血流动力学指标,眼动脉血管血流速度加快,阻力指数明显下降,有利于患者视力恢复。分析其原因:球动脉血液灌注与眼压、前房深度等相关因素有关,PACG发病与瞳孔阻滞、晶状体等密切相关[18]。白内障发生过程中表现出晶状体膨胀、晶状体虹膜隔前移现象,会加快瞳孔阻滞速度,增加房角闭合风险[19],即白内障进展会加剧闭角型青光眼发生,对此白内障摘除理论上能从发病机制上对闭角型青光眼发生阻断[20]。同时PACG大部分患者小梁网结构还比较健全,通过房角分离术分开房角,可保持小梁滤过功能。受研究时间限制,本研究未对两种联合术式远期疗效进行分析为本研究不足,有待日后通过延长观察时间进一步分析。

表6 两组患者并发症发生率比较眼(%)
注:观察组:超声乳化白内障吸除联合房角分离术;对照组:超声乳化白内障吸除联合小梁切除术。
综上,超声乳化白内障吸除联合房角分离术或小梁切除术均能有效控制PACG合并白内障患者眼压,促进视力恢复;其中联合房角分离术相对在增强患者视神经血液供应、增加前房深度上有明显优势,且术后并发症发生率显著低。
4裴锦云, 林羽, 杨海燕, 等. 超声乳化联合房角分离术治疗闭角型青光眼合并白内障的临床效果分析. 天津医药2016;44(7):906-909
6吴怡, 秦常军. 超声乳化联合房角分离术治疗闭角型青光眼合并白内障疗效分析. 中国实用眼科杂志2016;34(5):433-435
- 国际眼科杂志的其它文章
- Correlations among macular pigment optical density, central macular thickness and body mass index
- 飞秒激光辅助白内障手术在硬核白内障患者中的应用
- 后Tenon囊下注射曲安奈德与静脉滴注地塞米松联合玻璃体切除治疗RD/CD
- Differences in pain and inflammation between Diclofenac 0.1% and Nepafenac 0.1% after cataract surgery
- 利用577nm阈值下微脉冲激光治疗糖尿病性黄斑水肿
- 隐形遮盖镜与压抑膜疗法治疗大龄单眼弱视的疗效比较

