胰腺浆液性囊腺瘤9例临床病理分析
唐月阳,夏 天,刘 俊,叶入裴,肖秀丽,龙汉安
(西南医科大学附属医院病理科,四川泸州 646000)
胰腺浆液性囊腺瘤(serous cystadenoma of the pancreas,SCAP)是较少见发生于胰腺外分泌部的肿瘤,好发于中老年女性,胰体尾较常见,其次为胰头部。按照WHO(2010)组织学标准分型,胰腺浆液性囊腺瘤又主要分为浆液性微囊性腺瘤(serous microcystic adenoma,SMA)、浆液性寡囊性腺瘤(serous oligocystic adenoma,SOA)2个亚型,其中SMA较常见,浆液性腺瘤在无特殊说明时即指浆液性微囊性腺瘤[1]。本文收集了9例诊断为SCAP的临床资料、病理特征、特殊染色、免疫组化结果进行分析,并结合相关文献探讨其临床病理特征及鉴别诊断要点,以增强对该病的认识,提高诊治水平。
1 资料与方法
1.1 一般资料
收集西南医科大学附属医院病理科2012年1月至2018年8月诊断为胰腺浆液性囊腺瘤的病例,均有完整的临床资料,全为本院手术送检标本。9例患者均经手术切除治疗,且预后良好。
1.2 影像学检查
患者术前行CT检查,SMA肿瘤主要表现为胰腺组织内类圆形囊实性稍低密度结节影,密度较均匀,边界较清(图1A),增强扫描未见明显强化(图1B)。SOA肿瘤胰腺组织内类圆形囊状低密度影,边界清,增强扫描后未见强化,见图1。

图1 SCAP影像学改变
1.3 方法
送检组织经10%中性福尔马林充分固定,脱水后石蜡包埋切片,切片4 μm,常规HE染色和PAS染色,光学显微镜下观察。免疫组织化学染色采用Envision二步法,特殊染色为PAS染色,免疫组化试剂:EMA、CK7、CK8、CK18、CK19、CEA、Syn、P53、CgA及Ki-67,均购自福州新迈生物科技有限公司。
2 结 果
2.1 临床资料
本组8例患者均女性,1例为男性,发病年龄为26~65岁,平均年龄为52岁。临床主要表现为不同程度的腹胀、腹痛。其中微囊型7例(占77.8%),寡囊型2例(占22.2%),见表1。
2.2 巨检
7例SMA肿瘤均为与周围胰腺组织分界清楚的单个结节,肿瘤呈圆形或卵圆形,有包膜,肿块切面呈海绵状、蜂窝状或囊实性,由多个大小不一的小囊构成,见图2,囊内均为淡黄色清亮液体;肿瘤内可见灰黄色星形纤维瘢痕灶。2例SOA肿瘤与周围胰腺组织分界尚清,呈囊性改变,囊内充满透明液体,囊壁厚0.1~0.2 cm,囊内壁光滑。

图2 胰腺浆液性囊腺瘤大体形态
2.3 镜检
9例SCAP的组织学形态均相似,7例SMA肿瘤与正常胰腺组织分界尚清,可见纤维性假包膜,肿瘤由众多大小不等、形态多样的小囊腔组成(图3A),内含清亮液体,囊壁由单层扁平或立方上皮衬覆,细胞形态一致,胞质透亮,含丰富糖原,核圆形、卵圆形,大小一致,位于中央,核仁不明显,无核分裂象和核异型(图3B)。囊内可见上皮细胞增生凸入囊腔,形成微小乳头,但中央无纤维血管轴心。囊腔之间可见粗细不等的小梁状玻璃样变的纤维组织分隔。7例均未见肿瘤向周围组织浸润。2例SOA肿瘤由单囊构成,囊壁衬覆单层立方或柱状上皮,胞质透明或嗜酸性,核相对较大,无核异型性,纤维间质透明变。
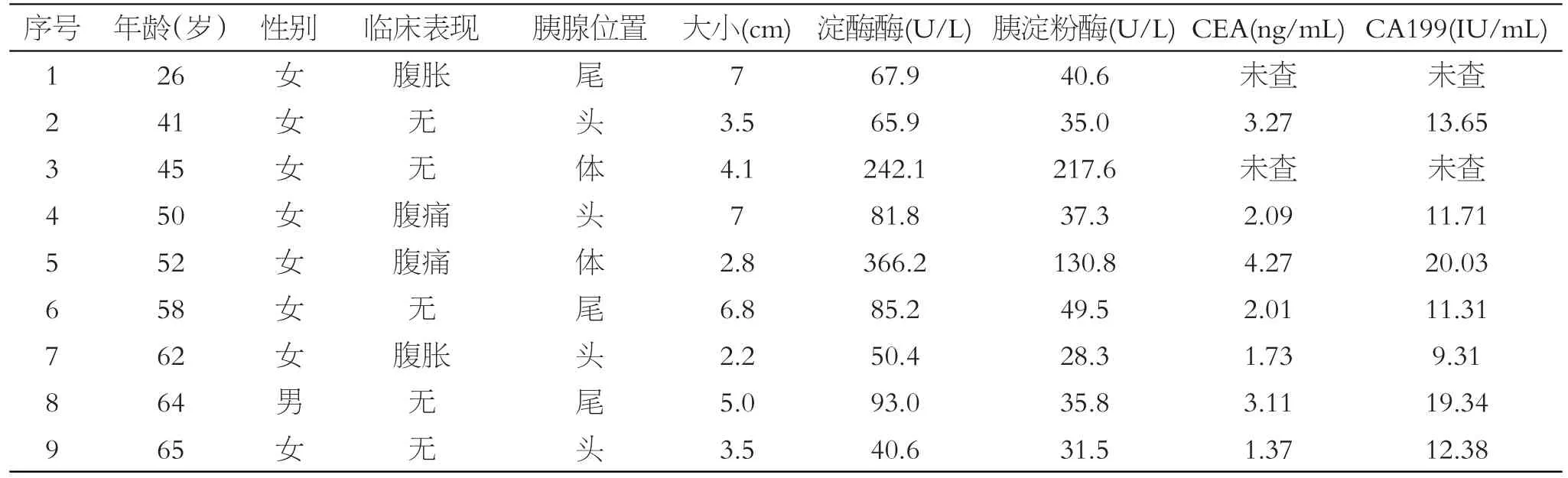
表1 9例胰腺浆液性囊腺瘤患者临床资料
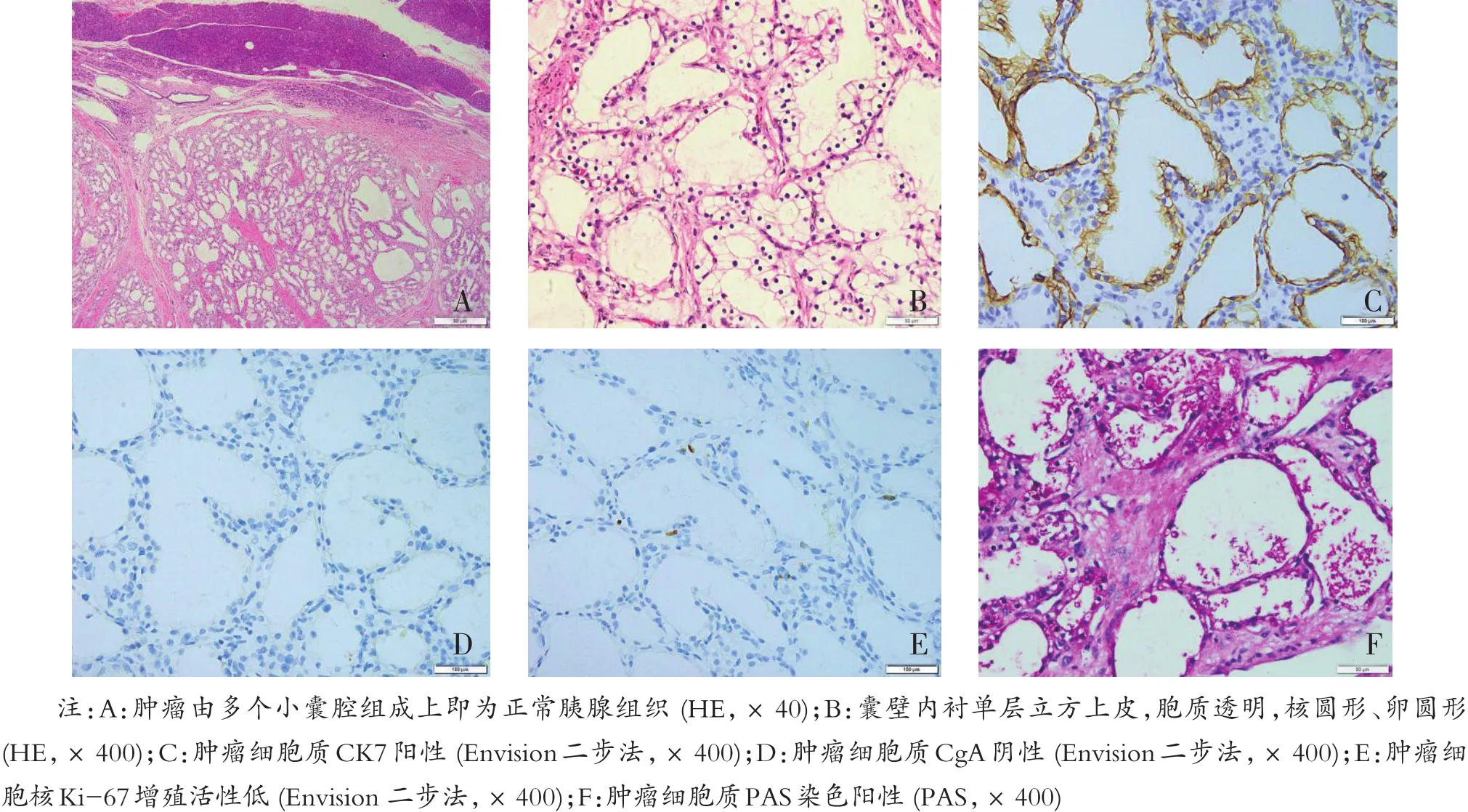
图3 胰腺浆液性囊腺瘤镜下形态
2.4 免疫组化结果
9例肿瘤细胞EMA、CK7(图3C)、CK8、CK18及CK19均 (+),CEA、Syn、P53及CgA(图3D)均 (-),肿瘤组织成分Ki-67(+,1%-3%)(图3E)。
2.5 特殊染色结果
肿瘤细胞胞质PAS染色阳性(图3F),在细胞胞质内和囊腔中都可见到红染的细小颗粒,但经淀粉酶消化后PAS染色阴性,证实囊壁内衬细胞的胞质内富含糖原颗粒。
3 讨论
1978年,胰腺浆液性囊腺瘤首次由Compagno等[2]根据病理特点提出,这是一种少见的胰腺外分泌肿瘤。在所有胰腺囊性肿瘤中约32%~39%为胰腺浆液性囊腺瘤,而在所有胰腺外分泌肿瘤中约占1%[3]。根据文献报道,胰腺浆液性囊腺瘤好发于女性,各年龄段均可发生,平均年龄约60岁,通常为单发,其最常见于胰体尾部,其次为胰头[3]。其病因被认为与激素水平、遗传因素、von Hippel-Lindau病有关。SCAP几乎都为良性病变,因此正确的诊断,对临床治疗及预后意义重大。
3.1 临床特点
胰腺浆液性囊腺瘤患者早期常无明显症状,通常在体检时偶然发现,容易出现漏诊、误诊[4]。腹胀、腹痛或腹部触及包块多为有症状患者的临床表现,也可有恶心、呕吐、体重减轻,少数患者可以出现梗阻性黄疸,多因肿块位于胰头部,产生压迫所致[2,5]。由于SCAP发病隐匿,生长缓慢,无特殊临床表现,并且实验室检查几乎正常,因此影像学检查对诊断尤为重要。B超检查中,肿瘤表现为密集的小囊肿回声,海绵状,可见散在的斑点状强回声。常规B超不能实时动态连续观察病变的血流灌注情况,而超声造影(contrast ultrasonography,CEUS)却能达到这种效果,并且在显示胰腺囊实性分隔方面可以达到等同于MR的水平,因此相比于常规B超,CEUS能明显提高胰腺囊性病变良恶性的诊断率[6-7]。病变的具体部位、囊肿直径、囊壁厚度、有无实性成分、病灶与胰管之间的关系,以及是否存在转移,都可以通过CT检查观察到,这对于诊断和鉴别诊断都具有很重要的价值[8]。同时虽然CT对钙化比较敏感,但在观测胰腺微囊结构方面,CT是稍逊于MR,因此提高该病诊断的准确率,需CEUS、MR和增强CT结合诊断[9]。
3.2 病理特点
从组织学上来看,SCAP主要分为浆液性微囊性腺瘤和浆液性寡囊性腺瘤2个亚型。SCAP还包括4种少见类型,即实性浆液性腺瘤、大囊性浆液性囊腺瘤、VHL相关性浆液性囊性肿瘤(可能与VHL肿瘤抑制基因的位点丢失和突变,该基因位于第3号染色体)和混合性浆液性神经内分泌肿瘤[1,10]。大体上,胰腺浆液性囊腺瘤多为单个体积较大的类圆形囊实性肿瘤,切面呈海绵状,部分肿瘤中央可见星形瘢痕。镜下,肿瘤与周围胰腺组织分界较清,可见纤维性假包膜,由众多小囊构成,囊腔之间可见粗细不等的小梁状玻璃样变的纤维组织分隔,微囊之间残存少量胰岛细胞和胰腺腺泡结构。囊内含清亮蛋白性质的液体,囊内壁衬以单层立方或扁平上皮。上皮细胞胞质透亮,核位于中心,圆形、卵圆形,核无异型性。部分上皮细胞凸入囊腔形成无纤维血管轴心微小乳头。免疫表型,肿瘤细胞上皮标记阳性,如EMA、CK7、8、18、19;CEA、Syn、P53及CgA均阴性。上皮性标记物阳性,而神经内分泌标记阴性,表明肿瘤细胞来源于导管上皮细胞或泡心细胞,而非腺泡细胞[11]。肿瘤组织成分Ki-67阳性约1%~3%,说明细胞增殖活性不高。肿瘤上皮细胞特殊染色胞质PAS阳性,PASD为阴性,证实肿瘤细胞胞质富含糖原颗粒。囊内清亮蛋白性质的液体分析通常显示低粘度的液体,淀粉酶和癌胚抗原(CEA)都很低[12]。综合分析临床特点、影像学检查、病理检查及免疫表型等对胰腺浆液性囊腺瘤诊断及鉴别诊断具有重要意义。
3.3 鉴别诊断
在病理组织学上,胰腺浆液性囊腺瘤还需与以下胰腺肿瘤相鉴别[13-18]:①胰腺黏液性囊性肿瘤:是胰腺上皮来源的一种少见囊性肿瘤,具有恶变倾向,所以鉴别诊断尤为重要。胰腺黏液性囊性腺瘤常为多房囊性,囊壁内衬柱状上皮,内含有大量黏液,绝大多数女性患者有紧密排列富于细胞的卵巢样间质,但在病理检查中易出现漏诊,因为这种卵巢样间质只存在极少数囊壁中,因此不能作为诊断胰腺黏液性囊腺瘤的唯一必要条件。②胰腺假性囊肿:多继发于急性或慢性胰腺炎和胰腺损伤,由局部坏死组织聚集而不能吸收形成假性囊肿,囊壁结构由肉芽、纤维组织构成,囊壁无上皮成分,常呈单房囊性。③胰腺浆液性囊腺癌:在病理组织学上,与胰腺浆液性囊腺瘤几乎完全相同,二者不易鉴别。但前者细胞增殖活跃具有异型性,具有邻近组织侵犯和远处转移的恶性生物学特征。④胰腺腺泡细胞囊腺瘤:是良性囊性腺瘤,肿瘤大多为单发,偶可见多发,边界清楚,囊内为清亮液体,囊壁内衬温和腺泡分化细胞,细胞可多层排列,胞质嗜酸性颗粒状,核仁可见但相对较小。
3.4 治疗与预后
SCAP是一种生长缓慢、预后良好、罕见恶变的胰腺肿瘤[19],目前主要的治疗方式仍为手术切除,切除肿瘤效果好,一般不会复发,但也要预防术后胰漏等严重并发症,需注重手术的个体化。并且建议尽可能保护和保存胰腺功能,保留胰岛细胞质量并降低医源性胰岛素依赖性糖尿病的风险,以获得更好的结果和生活质量[20]。尽管SCAP的肿块边缘常不规则,却很少有真正的浸润[21]。但有文献报道极少数SCAP会转变成胰腺浆液性囊腺癌从而发生远处转移[22],因此术后应注意对患者进行长期密切随访。
4 结论
SCAP是胰腺外分泌腺罕见肿瘤,临床多无明显症状,实验室检查几乎正常,常在体检中偶然发现。在B超检查中,肿瘤表现为密集的小囊肿回声,海绵状,可见散在的斑点状强回声。CT检查可以观察到病变的具体部位、囊肿直径、囊壁厚度、有无实性成分、病灶与胰管之间的关系,以及是否存在转移。然而B超、CT却难以将SCAP与胰腺其他囊实性或囊性肿瘤相鉴别,诊断该病多依靠病理组织学检查,故准确掌握该病的病理特征十分重要。

