川牛膝、麻牛膝及杂交牛膝多糖的分离、纯化和对猪小肠上皮细胞活性的比较研究
■赵 磊 冯 鑫 陈 容 李丽霞*
(1.四川省食品药品学校,四川峨眉 614201;2.四川农业大学动物医学院 天然药物研究中心,四川成都 611130)
川牛膝为苋科植物川牛膝(Cyathula officinalis Kuna)的干燥根。主产于四川雅安天全、金口河一带,为川产道地药材。具有逐瘀通经、通利关节、利尿通淋的作用,经常用于经闭癥瘕、胞衣不下、风湿痹痛、跌扑损伤、足痿筋挛、尿血血淋等疾病[1]。但在产区,还广泛分布有麻牛膝和杂交牛膝,因形态和亲缘关系与川牛膝非常相近,故常混入川牛膝入药。
麻牛膝为苋科植物头花杯苋(Cyathula capitata Moq)的根。杂交牛膝来源于C.officinalis×C.capitata,为川牛膝(Cyathula officinalis Kuan)与头花杯苋(Cyath-ula capitata Moq)的自然杂交种[2]。目前对于川牛膝研究报道较多,但对川牛膝及其混伪品的比较研究还较少,有学者对其从性状鉴别和化学成分等方面对三种牛膝进行鉴别。多糖为川牛膝的主要活性部分,具有抗肿瘤[3-4]、抗炎、抗病毒、抗凝血、降血糖、降血脂、抗疲劳、抗衰老[5-6]、提高机体免疫力[7-8]和提高红细胞免疫功能[9]等药理活性。目前对于三种牛膝多糖组分和活性的比较研究还是空白,多糖含量和组分的差异,是反映三种牛膝品质和临床疗效差异的重要指标。
全球各国养殖业快速发展,饲料的安全备受关注的问题,特别是使用饲料添加剂存在的问题尤其明显[10]。现如今酶制剂、中草药、寡糖、益生素、酸化剂等添加剂正在逐步取代抗生素作为新的饲料添加剂[11]。已有研究表明在饲料中加入中药或其活性成分作为饲料添加剂,具有促进动物生长[12-13]、改善动物生产性能[14-15]、提高免疫力[16]、增强繁殖机能[17-18]、防病抗病的功能[19]。
本文分别提取了3种牛膝的粗多糖,并采用阴离子交换柱和凝胶柱对其进行分离、纯化,比较了3中牛膝粗多糖含量、组分差异和分子量差异,测定了3种多糖对猪小肠上皮细胞的细胞活性和炎症细胞因子IL-6基因的表达情况的影响。拟为川牛膝及其混伪品的品质评价提供依据,为开发一种天然的饲料添加剂提供参考。
1 材料与方法
1.1 试验材料
川牛膝采自四川省雅安市天全县,经鉴定为苋科植物川牛膝(Cyathula officinalis Kuan);麻牛膝采自四川省雅安市天全县,经鉴定为头花杯苋(Cyathula capi-tata Moq);杂交牛膝采自四川省雅安市天全县,经鉴定为杂交牛膝(C.officinalis×C.capitata)。
1.2 主要试剂
95%乙醇、50%乙醇、蒸馏水、碳酸氢钠溶液、1 mmol/l EDTA、0.1%叠氮化钠溶液、DEAE-琼脂糖凝胶FF(北京瑞达恒辉科技发展有限公司)、琼脂糖凝胶6FF(北京瑞达恒辉科技发展有限公司)、Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500 和Dextran T-2 000(北京瑞达恒辉科技发展有限公司)、氯化钠、苯酚、硫酸,以上试剂均为分析纯,CCK-8 试剂盒(CA1210,北京索莱宝生物科技有限公司)。
1.3 主要仪器
电热鼓风干燥箱、旋转蒸发仪、离心机、中压层析柱(50 mm×40 cm,上海精科实业有限公司)、凝胶层析柱(25 mm×100 cm,上海精科实业有限公司)、电脑自动部分收集器(BSZ-160F,上海精科实业有限公司)、酶标仪(Varioskan flash,Thermo Fisher Scientific)、电子天平(JA2003B,上海越平科学仪器有限公司)、冷冻干燥机(LyoQuest-5,赛默飞世尔科技有限公司)。
1.4 粗多糖的提取
取药材粉末200 g,用95%乙醇、50%乙醇除杂。残渣再加入蒸馏水提取2 次,滤液浓缩至近干,冷冻干燥,得粗多糖。精密称重,计算得率。
1.5 洗脱曲线的制备
利用苯酚-硫酸比色法测定多糖含量[20]。按多糖洗脱液200 μl,苯酚200 μl,硫酸1 ml的反应体系,振摇使其充分反应,冷却至室温后,移取100 μl至96孔板,再用酶标仪在波长490 nm处测定其吸光度,以吸光度A值为纵坐标,洗脱液体积为横坐标,制作洗脱曲线。
1.6 阴离子交换分离纯化
精密称取粗多糖0.5 g,用50 ml 蒸馏水溶解,用透析袋(分子量为3 500 Da)透析后,3 000 r/min离心后,取上清0.45 μm滤膜过滤。样品上DEAE-琼脂糖凝胶FF 柱,用蒸馏水洗脱,流速1 ml/min,收集洗脱液,浓缩,冷冻干燥,得中性多糖。再用0~1.5 mol/ml的氯化钠溶液进行梯度洗脱,收集洗脱液,10 ml/管,苯酚-硫酸比色法测定多糖含量,制作洗脱曲线后,收集不同洗脱峰的洗脱液,浓缩,冷冻干燥,得酸性多糖和中性多糖。精密称重,计算得率。
1.7 凝胶柱层析分离纯化
将分子量分别为10 000、40 000、70 000、500 000、2 000 000 的多糖标准品和蒸馏水溶解后的中性和酸性多糖样品上琼脂糖凝胶6FF 柱,蒸馏水洗脱,用苯酚-硫酸比色法[10]测定每一管标准品洗脱液的吸光值,取5 个标准品分子量的对数为横坐标,以5 个含量曲线峰值对应的体积为纵坐标,制作标准曲线,并进行线性关系分析,得到线性方程。取酸性及中性多糖样品20 mg 溶于5 ml 蒸馏水中,上琼脂糖凝胶6FF 柱,收集洗脱液,10 ml/管,苯酚-硫酸比色法测定多糖含量,制作洗脱曲线。根据样品的洗脱曲线不同洗脱峰峰值所对应的体积,带入线性方程,得到不同洗脱峰对应的分子量。根据分子量的不同,合并样品洗脱液,浓缩至近干,冷冻干燥,计算得率。
1.8 细胞培养
将IPEC-J2 细胞接种在含10% FBS(Gibco)的DMEM(Gibco)培养基中,在37 ℃,5% CO2培养箱中进行培养。待合适密度时,将细胞接种到6孔板中(每孔含1×106个细胞);加入多糖处理12 h后,收集细胞进行基因表达检测。此外,还将细胞接种至96孔细胞培养板中(每孔5×104个细胞),多糖(5 mmol/l和10 mmol/l)处理12 h后使用CCK-8试剂盒测定细胞活性。
1.9 细胞活性分析
细胞活性使用CCK-8 试剂盒,通过试剂盒说明书中的方法测定。即在培养板中加入CCK-8溶液(每孔中每100 μl加入10 μl),然后将培养板在37 ℃孵育1 h。使用酶标仪测定每孔在450 nm处的吸光度值。
1.10 荧光定量PCR
将多糖处理完的细胞吸取培养基后,利用Trizol萃取法提取细胞总RNA,然后利用反转录试剂盒(Fermmentas)反转录得到cDNA,以GAPDH(Fr 5’-TGGAAGGACTCATGACCACA-3’;5’-AGGGGTCTA-CATGGCAACTG-3’)为内参,利用荧光定量PCR检测IL-6(Fr 5’-GGAAATCGTGGAAATGAG-3’;Rv 5’-GCTTAGGCATAACGCACT-3’)的表达情况。
2 结果
2.1 三种牛膝的粗多糖含量比较(见表1)
由表1可知,3种牛膝粗多糖含量差异很大,其中川牛膝的粗多糖含量最高,得率最高;其次是麻牛膝,最后是杂交牛膝,得率仅为0.38%。

表1 川牛膝、麻牛膝和杂交牛膝粗多糖含量比较
2.2 三种牛膝多糖组成的比较研究(见表2)
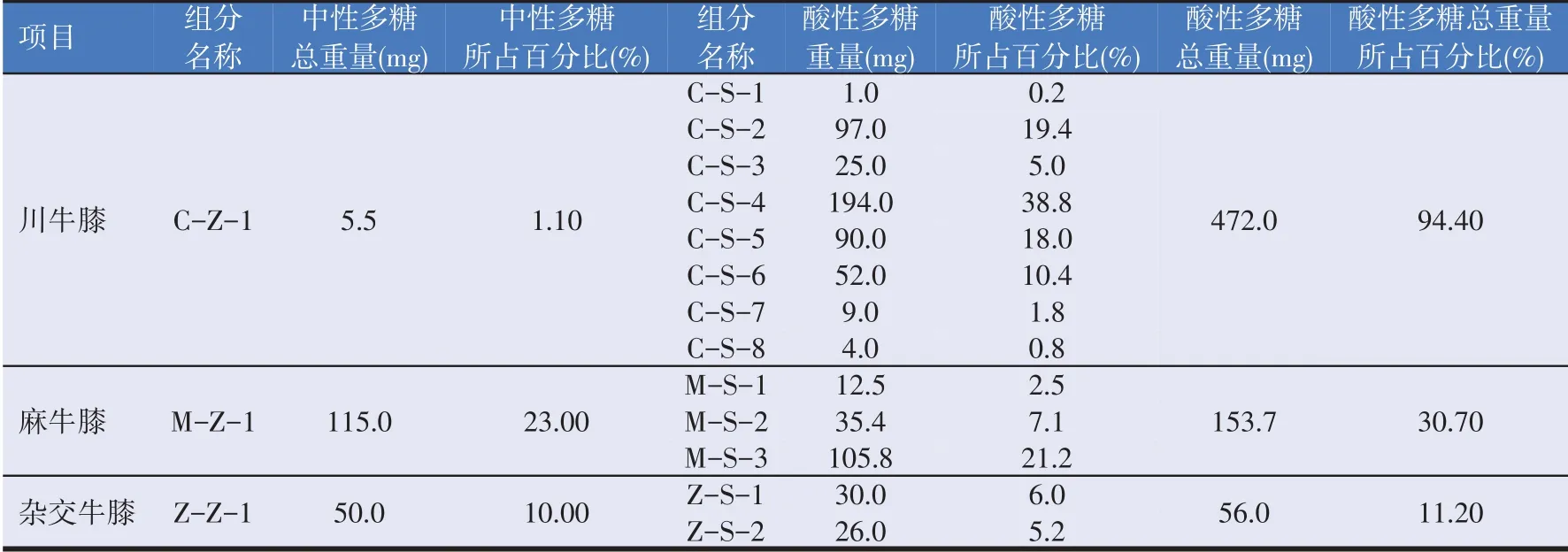
表2 川牛膝、麻牛膝和杂交牛膝多糖组成比较
由表2 可知,3 种牛膝多糖构成差异较大,其中川牛膝多糖主要为酸性多糖,麻牛膝和杂交牛膝中性多糖和酸性多糖所占比例基本相当。3 种牛膝中中性多糖含量最高的是麻牛膝,最低的是川牛膝,麻牛膝中性多糖含量比川牛膝高约21 倍,酸性多糖含量最高的为川牛膝,最低的为杂交牛膝,川牛膝酸性多糖含量为杂交牛膝的8.4倍。
2.3 3种牛膝多糖分子量分布比较
2.3.1 标准曲线的制备结果
以标准品分子量的对数为横坐标(x),以5 个含量曲线峰值对应的体积为纵坐标(y),得到线性方程为y=-102.18x+771.11,R2=0.994 7。
2.3.2 3种牛膝中性多糖的分子量分布比较
川牛膝、麻牛膝和杂交牛膝多糖分子量比较数据见表3。麻牛膝中性多糖纯化图谱见图1,麻牛膝酸性多糖分离纯化图谱见图2。
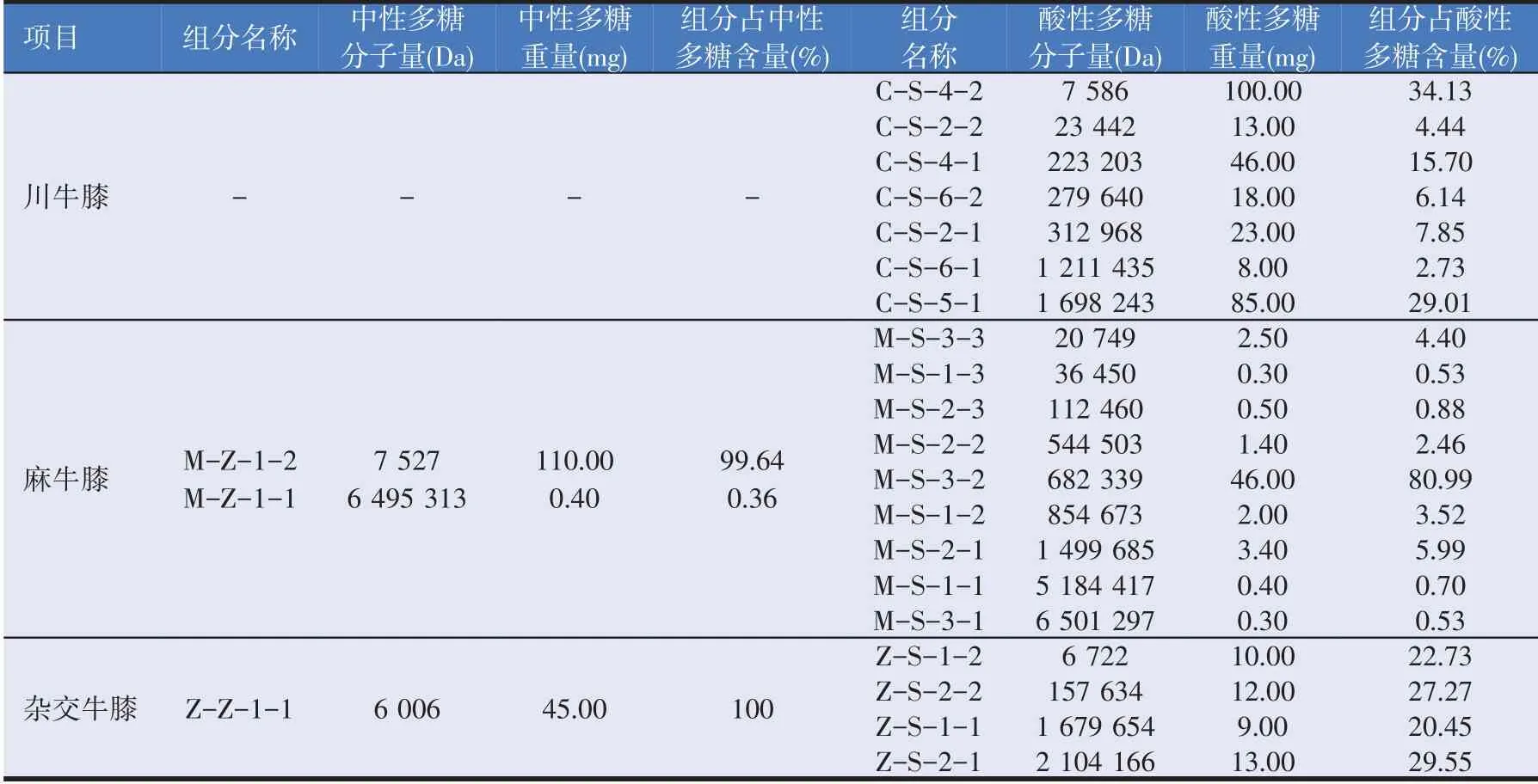
表3 川牛膝、麻牛膝和杂交牛膝多糖分子量比较

图1 麻牛膝中性多糖纯化图谱
由表3可知,川牛膝酸性多糖相对分子量分布比较广,其中分子量在10 000 Da 以下的占酸性多糖的34.13%,10 000~30 000 Da 的占酸性多糖的4.44%,200 000~400 000 Da占酸性多糖的29.69%,1 200 000~1 700 000 Da的占粗多糖的31.74%。麻牛膝中性多糖分子量主要集中在7 500 Da左右,在中性多糖中占比达99.64%;酸性多糖分子量主要是分布在680 000 Da左右,占酸性多糖的80.99%。从杂交牛膝中纯化得到一种中性多糖,其分子量主要集中在6 000 Da 左右;杂交牛膝酸性多糖分子量分布范围较广,且各分子量所占比例相差不大,分子量在6 500 Da左右的占酸性多糖的22.73%,分子量在157 000 Da 左右的占酸性多糖的27.27%,分子量在1 600 000 Da左右的占粗多糖的20.45%,分子量在2 100 000 Da左右的占酸性多糖的29.55%。
2.4 细胞活力检测结果
因杂交牛膝多糖含量较少,无法进行进一步的活性实验,所以本试验未进行后续的多糖活性试验。
0、5 μg/ml和10 μg/ml剂量川牛膝和麻牛膝多糖样品作用后测定猪小肠上皮细胞(IPEC-J2)的细胞活力,检测结果见图3。由图3可知,高剂量和低剂量的川牛膝多糖及麻牛膝多糖均对细胞活力无明显影响。
2.5 IL-6表达结果
10 mmol/l 药物作用后进行猪小肠上皮细胞IL-6基因表达检测,IL-6表达结果见图4。由图4可知,川牛膝多糖和麻牛膝多糖都可使IL-6 的表达显著降低,且川牛膝多糖效果优于麻牛膝多糖。

图2 麻牛膝酸性多糖分离纯化图谱

图3 细胞活性检测结果

图4 炎症细胞因子IL-6表达结果
3 讨论
3.1 3种牛膝多糖的组分比较
川牛膝药材品种混乱,目前市售川牛膝药材中多夹杂麻牛膝和杂交牛膝。在有的地区,出现以麻牛膝和杂交牛膝代替川牛膝使用的现象[2]。目前对于川牛膝及其混淆品的研究主要集中在原植物鉴别、原药材性状鉴别和杯腺甾酮含量差异上[21-22],未见关于川牛膝及其混淆品粗多糖含量及多糖组成差异比较的报道。本研究对此进行了比较研究,发现3种牛膝粗多糖含量差异较大。其中川牛膝粗多糖含量最高,为7.40%,杂交牛膝粗多糖含量最低,为0.38%,川牛膝粗多糖含量为麻牛膝粗多糖的4.4 倍,杂交牛膝的19.5倍。且川牛膝的多糖以酸性多糖为主,占总多糖的94.40%,麻牛膝和杂交牛膝的中性多糖和酸性多糖所占比例差异不大。3 种牛膝多糖分子量差异较大,其中川牛膝多糖分子量主要集中在7 500 Da 左右,麻牛膝的中性多糖分子量主要集中在7 500 Da,酸性多糖分子量主要集中在680 000 Da 左右,杂交牛膝的中性多糖分子量主要集中在6 000 Da,酸性多糖分子量主要集中在2 100 000 Da左右。
多糖为川牛膝的主要活性成分,具有抗氧化[23]、抗衰老[24]、提高免疫力[25]、抗肿瘤[26]的作用。因此以多糖作为评价川牛膝品质的重要指标是很有意义的。本研究结果表明以多糖为指标评价川牛膝及其混淆品的品质,则川牛膝质量最好,而麻牛膝和杂交牛膝由于多糖含量和组成差异很大,故不能替代川牛膝入药。
3.2 3种牛膝多糖对猪小肠上皮细胞活性的影响
在与多糖相关的药理活性中,3 种牛膝的疗效差异尚未见报道,本研究在获得川牛膝及其混淆品的粗多糖和纯化多糖的基础上,进一步测定了三种牛膝多糖对细胞活性及炎症细胞因子IL-6相关基因表达量的影响。结果表明川牛膝和麻牛膝多糖对猪小肠上皮细胞活性无显著影响,炎症细胞因子IL-6 的相关表达试验表明川牛膝多糖和麻牛膝多糖都可使炎症细胞因子IL-6的表达显著降低。证明川牛膝多糖和麻牛膝多糖对猪小肠上皮细胞无毒性、能抑制细胞的炎症反应,且川牛膝多糖炎症反应抑制效果更好。
全世界的饲料总产量在逐年增加,2017年中国的饲料总产量位居世界第一,国内抗生素类药物被广泛用作饲料添加剂,随着抗生素残留问题的日趋显现,使研究者们意识到必须限制抗生素的滥用[27]。中药作为代替抗生素的首选目标,其优势在于,中药来源于大自然中的药用植物[28-30]、药用菌物[31]、药用矿物[32]等广博资源,以无抗药性、低残留、不会对环境造成污染为优势和特点。本次试验已经证明了川牛膝多糖对猪小肠上皮细胞的活性没有影响,且能显著降低炎性基因的表达,这表明川牛膝、麻牛膝和杂交牛膝及其多糖具有成为一种新的饲料添加剂的潜力。
3.3 研究意义
本研究为解决川牛膝目前购销和临床应用混乱的现象提供了科学依据,对川牛膝及其混淆品的品质评价提供了思路和方法。川牛膝多糖对猪小肠上皮细胞活性无明显影响,对炎症反应良好的抑制效果,为川牛膝及其多糖作为饲料添加剂的进一步开发利用提供了新的实验证据和方向。
4 结论
3种牛膝中,川牛膝多糖含量最高,且以酸性多糖为主,麻牛膝和杂交牛膝的中性多糖和酸性多糖所占比例差异不大,3 种牛膝多糖的分子量差异较大。以多糖为指标评价川牛膝及其混淆品的品质,则川牛膝质量最好。
川牛膝多糖和麻牛膝多糖对猪小肠上皮细胞无毒性、能抑制细胞的炎症反应,且川牛膝多糖炎症反应抑制效果更好。

