血管内皮生长因子单链抗体在 大肠埃希菌中的高效表达
张冀原, 陈 羽, 林 涵, 何 晴, 徐 威
(沈阳药科大学,辽宁 沈阳 110016)
血管内皮生长因子(vascular endothelial growth factor,VEGF)是由二硫键连接的同源二聚体糖蛋白,主要通过特异性结合血管内皮生长因子受体酪氨酸激酶,被激活的酪氨酸激酶接着激活下游信号分子,比如磷脂酶C2Y、蛋白激酶C等,最终将信号传至细胞核内,通过特定的基因片段进行表达[1]。文献报道,血管内皮生长因子与肿瘤生长有着千丝万缕的联系[2]。在肿瘤的病理诊断中,常见血管内皮生长因子的广泛表达[3-4]。因此,以血管内皮生长因子及其相应的受体作为靶点来治疗癌症是当今药物研发的热门方向之一。单链抗体是由抗体的重链和轻链可变区通过一段连接肽构成的重组蛋白,具有抗原结合能力。与传统的单克隆抗体相比,组织穿透力更强,人体发生超敏反应的概率更低[5]。单链抗体不需要糖基化修饰即可在大肠埃希菌中直接进行大量制备,为临床应用提供了必要的物质基础。借助大肠埃希菌表达非自身蛋白是世界通用的蛋白生产技术[6-8],但如何高效表达小分子抗体却是摆在科研工作者面前的一道难题。本研究以血管内皮生长因子单链抗体为研究对象,考察不同培养基和培养条件对血管内皮生长因子单链抗体表达量的影响,为将该重组大肠埃希菌在发酵罐内进行扩大再培养提供前期研究基础。
1 材料与方法
1.1 材料
1.1.1 工程菌 工程菌R22-4,由质粒pET22b(+)-anti-VEGF-scFv(含His标签)转化EscherichiacoliBL21(DE3) 感受态细胞获得,本课题组保藏。
1.1.2 培养基及试剂 LB液体培养基;2×YT液体培养基(g/L,pH 7.0):胰蛋白胨16,酵母提取物10,NaCl 5;TB液体培养基(g/L):胰蛋白胨12,酵母提取物24,甘油4,KH2PO42,K2HPO412;SOB液体培养基(g/L,pH 7.0):胰蛋白胨20,酵母提取物5,NaCl 0.5,KCl 0.19,MgCl20.95;M9液体培养基(g/L,pH 7.0):Na2HPO4·12H2O 15,KH2PO43,NaCl 0.5,NH4Cl 1,甘油3,CaCl20.11,MgSO40.12;微量元素(g/L):FeCl3·6H2O 13.5,CaCl22.2,MnCl2·4H2O 1.97,ZnSO4·7H2O 2.87,CoCl2·6H2O 0.47,CuCl20.27,NiCl20.26,Na2MoO4·2H2O 0.556,Na2SeO30.35,H3BO30.12[9]。酵母提取物、胰蛋白胨购自Oxiod公司;蛋白胨、酵母膏、玉米浆、牛肉膏等购自天津冠前化工经销部;甘油、葡萄糖、蔗糖、KH2PO4、K2HPO4、NaCl等购自北京化工厂;BugBuster Master Mix蛋白抽提液、脱氧核糖核酸酶I(DNaseⅠ)购自Novagen公司;PBST洗涤液、PBS溶液、牛血清白蛋白(Albumin from bovine serum,BSA)购自上海生工生物工程有限公司;血管内皮生长因子单链抗体、Human VEGF、抗His抗体(HRP标记)、IPTG、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbenzidine,TMB)等购自Sigma公司。
1.1.3 仪器与设备 电子天平(BS223S,德国Sartorius公司),恒温振荡器(THZ-312,上海精宏实验设备有限公司),台式高速离心机(KDC-16H,安徽中科中佳科技有限公司),可见光分光光度计(VIS-723,上海第三分析仪器厂),酶标仪(ELx800uv,美国BIO-TEK公司),超净工作台(AIRTECH,苏净集团安泰公司),pH计(PB-10,德国Sartorius公司)。
1.2 方法
1.2.1 标准曲线的绘制 在酶标板中加入用PBS溶液稀释至1 μg/mL的Human VEGF溶液100 μL,4 ℃包被过夜;弃去包被液,PBST洗3次,拍干,每孔加入含2% BSA的PBS溶液200 μL,用新封板胶纸封住反应孔,37 ℃孵育120 min;PBST洗3次,拍干,每孔加入100 μL不同浓度血管内皮生长因子单链抗体稀释液(用PBS溶液稀释至62.5、125、250、500、1 000 ng/mL),置于恒温振荡箱,37 ℃振荡2 h;PBST洗3次,拍干,按1∶4 000的比例,用含1%BSA的PBS溶液稀释抗His抗体(HRP标记),每孔加入酶标抗体100 μL,37 ℃振荡2 h;PBST洗3次,再用PBS洗1次,拍干,每孔加入3,3′,5,5′-四甲基联苯胺100 μL,37 ℃避光孵育15 min;再加入50 μL的1 mol/L HCl终止反应,450 nm酶标仪检测结果。以浓度对数值为横坐标,以OD450为纵坐标,制作血管内皮生长因子单链抗体浓度标准曲线。
1.2.2 培养基类型的筛选 将工程菌R22-4以1%接种量接种至LB种子培养基中,37 ℃、220 r/min过夜培养至OD600值为3.5(菌液稀释10倍后检测,直接检测值为0.35),次日以6%接种量分别转种至LB、2×YT、TB、SOB和M9 等5种不同液体培养基中,37 ℃、220 r/min振荡培养至OD600值为0.8时,加入0.5 mmol/L IPTG,降温至30 ℃,220 r/min诱导8 h。诱导结束后,测定菌液的OD600值,将培养后的菌液于8 000 r/min离心8 min,弃上清液;取菌体0.1 g,依次加入600 μL BugBuster Master Mix蛋白抽提液、1 μL DNase Ⅰ(12.5 U/μL)中,充分混匀,将混合液置于脱色摇床上,振荡30 min使其充分裂解。于4 ℃、15 000 r/min离心10 min;取上清液,15 000 r/min再次离心10 min后,收集上清,用上清液代替血管内皮生长因子单链抗体稀释液进行ELISA检测。根据血管内皮生长因子单链抗体浓度标准曲线计算出目的蛋白表达量,进而确定适宜的培养基类型。
1.2.3 培养基成分单因素筛选 分别添加不同碳源(葡萄糖、甘油、蔗糖) 、不同氮源(用蛋白胨、酪蛋白胨、Hy-Soy、N-Z-Amine代替胰蛋白胨;用酵母膏、玉米浆、牛肉膏、Hy-Yest代替酵母提取物)、不同无机盐、微量元素、维生素到培养基中,种子培养及发酵培养条件不变,以基础培养基为对照,利用ELISA法检测抗体表达量,确定有利于目的蛋白表达的培养基成分[10]。
1.2.4 培养基优化研究 将具有正效作用的培养基成分进行优化组合,设计出不同复合培养基并用于工程菌R22-4表达,确定最优培养基。
2 结果与分析
2.1 标准曲线的绘制
在酶标板中分别加入不同浓度(62.5、125、250、500、1 000 ng/mL)血管内皮生长因子单链抗体,以浓度对数值为横坐标,以OD450为纵坐标,制作血管内皮生长因子单链抗体浓度标准曲线,见图 1。由图 1 可以看出,当血管内皮生长因子单链抗体质量浓度在62.5~1 000 ng/mL范围内,抗体浓度与吸光度之间呈现良好的线性关系,其相关系数R2= 0.999 1。

图1 血管内皮生长因子单链抗体标准曲线Fig.1 Standard curve of anti-VEGF-scFv
2.2 基础培养基的筛选
利用LB、2×YT、TB、SOB和M9等5种不同液体培养基表达目的蛋白,检测发酵液的湿菌重和单位湿重菌体目标抗体的含量,计算出蛋白表达量[4],结果见图2。从图2可以看出,工程菌R22-4在2×YT培养基中生长最好(10.52 g/L),目的蛋白表达量最高(3.95 mg/L),最终选择2×YT培养基为基础培养基。
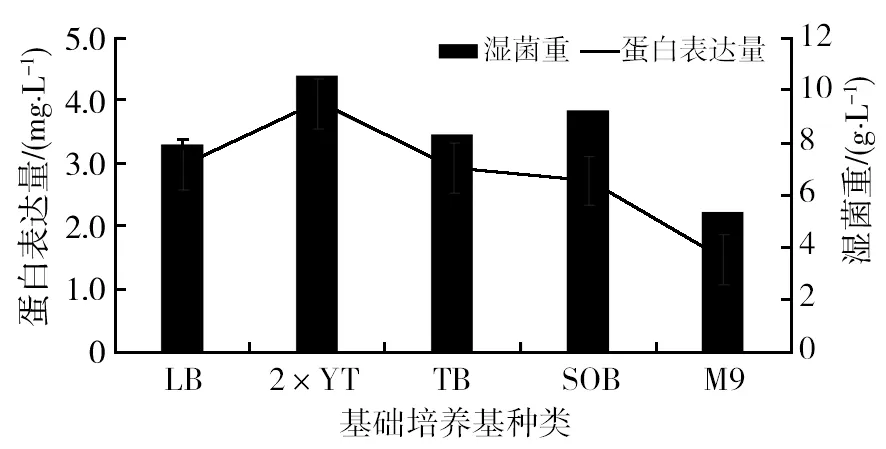
图2 培养基对目的蛋白表达的影响Fig.2 Influence of culture media on the target protein expressionv
2.3 培养基成分的筛选
2.3.1 碳源的筛选 在确定2×YT培养基的基础上,添加3种不同的碳源(葡萄糖、甘油和蔗糖),添加的碳源质量分数均为0.5%,菌体经发酵后检测,结果见图3。从图3可以看出,当加入碳源葡萄糖后,菌体生长最好(14.38 g/L),目的蛋白表达量最高(5.91 mg/L),故选择葡萄糖作为碳源。
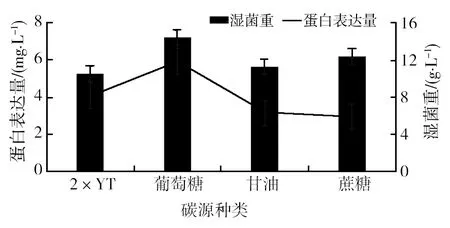
图3 碳源对目的蛋白的表达的影响Fig.3 Influence of carbon source on the target protein expression
2.3.2 氮源的筛选 在选定葡萄糖初始质量分数为0.5%,保持基础培养基其他成分不变的条件下,选取质量分数1.6%的蛋白胨、酪蛋白胨、Hy-Soy、N-Z-Amine代替胰蛋白胨;用质量分数1.0%的酵母膏、玉米浆、牛肉膏、Hy-Yest代替酵母提取物作为培养基氮源[11],结果见图4。从图4可以看出,采用不同氮源,菌体生长和目的蛋白表达的差异不明显,但加入酪蛋白胨和玉米浆却对目的蛋白表达量有促进作用,故作为替代氮源。

图4 氮源对目的蛋白表达的影响Fig.4 Influence of nitrogen source on the target protein expression
2.3.3 无机盐、微量元素和维生素的筛选 发酵过程中加入适量的无机盐、微量元素、维生素,会对目的蛋白表达量产生影响。在摇瓶实验中,以2×YT培养基为基础,分别单独添加3种常见的原核细胞无机盐溶液(无机盐①:KH2PO4∶K2HPO4∶NaCl=1∶1.2∶2;无机盐②:KH2PO4∶K2HPO4∶NaCl=1∶1.2∶4;无机盐③:KH2PO4∶K2HPO4∶NaCl=1∶1.2∶8)、微量元素和维生素B1,结果见图5。从图5可以看出,加入无机盐、微量元素和维生素后,菌体生长和目的蛋白表达均有所提高,其中无机盐②、微量元素和VB1变化相对显著,故选择它们作为发酵培养基中的微量添加物。

图5 无机盐、微量元素、维生素对目的 蛋白表达的影响Fig.5 Influence of inorganic salt,trace elements, vitamins on the target protein expression
2.4 诱导条件的选择
2.4.1 最佳诱导时间的选择 在目的蛋白的发酵过程中,诱导时间是一个重要参数。诱导时间不足,目的蛋白表达量较低;诱导时间过长,菌体进入衰亡期,副产物增加。故以2×YT培养基为基础,进行目的蛋白诱导时间的筛选,结果见图6。从图6可以看出,在发酵2 h后添加IPTG,在诱导2~8 h之间,菌体密度和目的蛋白表达量均随着诱导时间的增加而增加;在诱导8~10 h之间,菌体密度和目的蛋白表达量均趋于最大值。培养8 h后,菌体密度略有升高,说明还未进入衰亡期,但目的蛋白表达量却开始下降,故应该在培养8 h前结束诱导,即加入IPTG后,整个诱导时间不超过6 h。
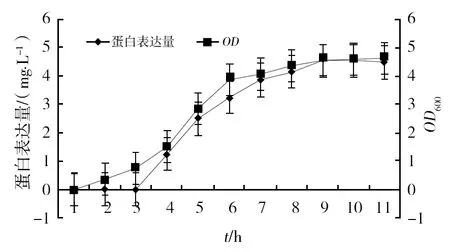
图6 诱导时间对目的蛋白表达的影响Fig.6 Influence of induction time on the target protein expression
2.4.2 诱导剂浓度的优化 以优化培养基为基础,在IPTG最佳诱导时间作用下,分别加入0、0.2、0.4、0.6、0.8 mmol/L IPTG 进行诱导表达[12],结果见图7。从图7可以看出,IPTG浓度在0~0.8 mmol/L范围内对菌体生长和目的蛋白表达均无明显的影响。考虑到试验成本,最终选择IPTG 浓度为0.1 mmol/L。
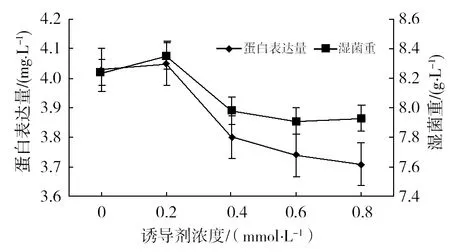
图7 IPTG浓度对目的蛋白表达的影响Fig.7 Influence of IPTG concentration on the target protein expression
2.5 均匀设计试验
根据初筛结果可知,培养基中加入适量的葡萄糖、酪蛋白胨、玉米浆、无机盐、微量元素和维生素B1,可以明显提高目的蛋白的表达量;在不同培养条件下,诱导时间对目的蛋白表达具有显著影响,IPTG浓度对目的蛋白表达影响却不明显。在30 ℃诱导温度下,以葡萄糖浓度、酪蛋白胨浓度、玉米浆浓度、无机盐含量、微量元素含量、维生素B1含量、IPTG浓度、诱导时间作为优化因子并设置5个优化水平进行均匀设计试验,结果见表1。
应用MDAS软件分析实验数据,以目的蛋白表达量为Y值,得到回归方程Y=4.532-0.832B+2.218E-0.482C+2.436D-1.622G+0.904H-0.099 1A2-0.882D2+1 039.673F2-0.112H2,相关系数R2=0.994 3,标准差S=0.046。显著性水平α=0.01,F(8,1)=1 0667.42,回归方程进行F检验后得到置信区间Y=Ym±2.53*S [9.147 51,9.436 46]。通过软件分析得到最优点:A=0.3、B=1.0、C=0.4、D=1.33、E=0.01、F=0.04、G=0.1、H=5,Ym=9.295。将均匀设计试验优化后的最佳摇瓶发酵条件与原始2×YT培养基对照实验进行对比,结果见表2。
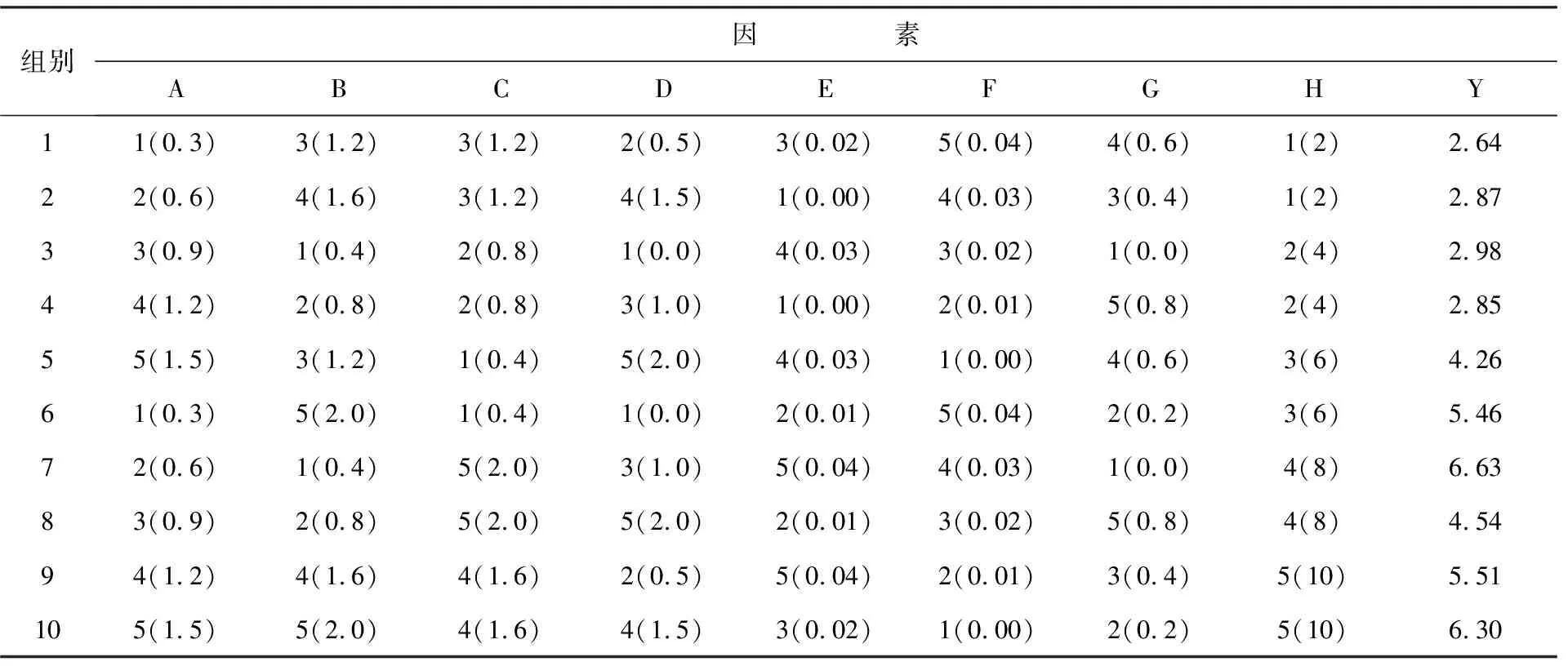
表1 均匀设计因素及水平U10(108)Table 1 Uniform design factors and levels U10(108)
注:A:葡萄糖,0.3%、0.6%、0.9%、1.2%、1.5%;B:蛋白胨,0.4%、0.8%、1.2%、1.6%、2.0%;C:酵母膏,0.4%、0.8%、1.2%、1.6%、2.0%;D:无机盐,0.0(不加无机盐)、0.5(KH2PO40.05%、K2HPO4·3H2O 0.06%、NaCl 0.2%)、1.0(KH2PO40.1%、K2HPO4·3H2O 0.12%、NaCl 0.4%)、1.5(KH2PO40.15%、K2HPO40.18%、NaCl 0.6%)、2.0(KH2PO40.2%、K2HPO40.24%、NaCl 0.8%);E:微量元素,0.00%、0.01%、0.02%、0.03%、0.04%; F:维生素B1,0.00%、0.01%、0.02%、0.03%、0.04%;G:IPTG,0、0.2、0.4、0.6、0.8 mmol/L;H:诱导时间,2、4、6、8、10 h

表2 验证试验结果Table 2 The results of verify experiment
通过验证实验,得到最佳摇瓶实验结果:在2×YT培养基基础上添加质量分数为葡萄糖0.3%、酪蛋白胨1.0%、玉米浆0.4%、KH2PO40.133%、K2HPO40.159 6%、NaCl 0.532%、微量元素0.01%、维生素B10.04%;诱导条件:30 ℃、0.1 mmol/L IPTG诱导5 h。经验证,目的蛋白表达量为9.23 mg/L,位于置信区间之间,与理论值接近。与原始对照组相比,湿菌重是对照组的1.50倍,目的蛋白表达量是对照组的2.27倍。
3 讨 论
以治疗为目的的抗体类药物,因其具有高度的靶向性、安全性和有效性,目前已成为药物研发中的热门方向之一,属于高技术含量的一类生物新药,是全世界高端药企争相竞争的主要动力,也是一个国家生物科技发展的重要指标[13-15]。本研究以血管内皮生长因子单链抗体为研究对象,考察不同培养基和培养条件对血管内皮生长因子单链抗体表达量的影响,为将该重组大肠埃希菌在发酵罐内进行扩大再培养奠定前期的实验室基础。由于血管内皮生长因子单链抗体表达量较低,在蛋白电泳中很难区分该目的条带,只能在Western图谱上看见清晰的条带,但是通过Western图谱对比各实验组表达结果误差却很大,转膜效率、封闭条件、显色时间、灰度选择(数据处理时)等都会对实验结果造成干扰,故本研究选择ELISA方法检测目的蛋白的表达结果,相比于Western图谱具有更高的灵敏度。

