小麦面粉和鲜面片色泽及 Psy-A1 与 Ppo-A1 等位变异检测
张 晓,高德荣,李 曼,刘大同,吴素兰,江 伟,吕国锋
(江苏里下河地区农业科学研究所/农业部长江中下游小麦生物学与遗传育种重点实验室,江苏扬州 225007)
小麦面粉色泽是面粉品质的重要指标,也是衡量面粉加工精度的重要指标,在很大程度上反映了面粉的质量和制粉精度[1]。长期以来我国人民有喜食高白度面食的习惯[2],面粉白度对面条、馒头、包子和饺子等食品的评分有重要影响,色泽评分一般占蒸煮类食品总评分的20%~30%[3]。市场上销售面粉的白度一般达到80以上才易被认可[4]。为提高市场竞争力,面粉厂在面粉生产过程中普遍使用化学增白剂,长期过量食用对人体有害。研究表明,小麦品种是影响面粉色泽最重要的因素[5-6]。刘建军等[5]对 4 个环境条件下 104 个小麦品种(系)的研究结果表明,气候因子、土壤条件及栽培措施和品种对小麦面粉白度均有显著作用,但品种的作用更为重要。胡瑞波等[6]研究表明,面粉白度、色泽(L*、a*、b*)的基因型方差均大于环境和环境与基因型互作方差。了解大面积推广品种面粉和面片色泽,可为小麦品质改良提供重要信息。
小麦面粉及其制品色泽主要受出粉率、硬度、蛋白质含量、多酚氧化酶(PPO)活性、黄色素含量和脂肪氧化酶活性等因素影响[7-10]。研究表明,PPO是造成面粉或面制食品颜色酶促褐变的主要原因,表型贡献率高达50%~70%[11-14]。张立平等[15]定位了分别位于2AL、2DL染色体上的PPO活性主效QTL,并认为2AL上的QTL效应较大。Sun等[16]开发了位于2AL上PPO活性主效基因的STS标记PPO18,能有效区分控制PPO活性的等位基因Ppo-A1a和Ppo-A1b。黄色素是小麦籽粒中最主要的天然色素,与面粉白度关系密切[8,17]。类胡萝卜素是黄色素的主要成分,八氢番茄红素合酶(Psy)是植物类胡萝卜素合成途径中的限速酶[18-19]。黄色素含量受多个基因位点的调控,其中位于7AL的主效QTL,在不同环境中解释12.9%~37.6%的表型变异[20]。He等[21]根据玉米的Psy1基因克隆了小麦7A染色体上的Psy-A1基因,并开发了共显性标记YP7A,能检测等位基因Psy-A1a和Psy-A1b。
付晓洁等[22]对138份陕西历史和主栽品种的PPO活性基因等位变异进行了检测。杨芳萍等[23]对157份小麦品种和新品系进行了黄色素含量和PPO相关基因的检测。张国丛等[24]对河北省主推小麦品种进行了面粉色泽状况研究。胡凤灵等[25]对221份小麦品种和新品系进行了黄色素含量和PPO活性基因的分子标记检测。王 蕾等[26]对173份小麦品种PPO活性基因等位变异及面粉白度特性进行了分析。姜小苓等[27]研究了216份不同种植区小麦品种(系)的面粉白度的变异。相吉山等[28]对182份新疆小麦品种(系)的面粉色泽及Psy-A1、Ppo-A1、Ppo-D1等基因等位变异进行了检测。
前人的研究多为小麦品种面粉色泽或者分子检测,尚未见对小麦品种(系)面粉、鲜面片色泽及其与Ppo-A1、Psy-A1等位变异关系的系统研究。本研究拟以主要麦区17个当前大面积推广品种及1个优异品系为材料,检测其面粉白度、面粉和放置不同时间鲜面片的L*值、a*值、b*值和Psy-A1、Ppo-A1基因等位变异,分析不同等位变异对面粉和鲜面片色泽的影响,以期为高白度小麦新品种选育提供理论依据。
1 材料与方法
1.1 试验材料及设计
试验材料为我国主要麦区当前大面积推广品种及优异品系共18份(表1)。2012-2013和2013-2014年度种植于江苏里下河地区农科所基地。试验采用随机区组设计,2次重复,5行区,行长1.2 m,行距0.25 m。试验施纯氮210 kg·hm-2,基肥∶分蘖肥∶拔节肥为5∶1∶4,基肥于播种前一天施用,分蘖肥于4 叶期施用,拔节肥于叶龄余数2.5 叶期施用,磷、钾肥均是105 kg·hm-2,全部基施。田间管理与大田生产一致,生长期间没受到自然灾害,正常成熟,按小区收获脱粒,晾晒除杂后统一磨粉。
1.2 方 法
1.2.1 面粉制备
用MLU-202型Buhler磨粉机磨粉,根据籽粒硬度,将小麦籽粒含水量调整至14%~15%,润麦18~20 h,参照AACC26-20方法磨粉。
1.2.2 面坯制作
称取小麦粉30 g(15%湿基),根据面粉筋力和吸水率加入小麦粉质量28%~32%的蒸馏水;用针式和面机搅拌5 min。使用实验室专用面条机将和好的坯料在压辊间距4 mm处压片成型,将面片置于醒发箱中醒发30 min之后,取出面片将厚度压为2.5 mm。用塑料封口袋将面片保存于恒温25 ℃的空调房内(用足量空气将封口袋撑开,防止封口袋与面片测试面接触)。分别于0、2、4 h取样测定面片的色泽。
1.2.3 面粉白度测定
利用国产智能白度仪(WSB-Ⅳ,杭州麦哲仪器有限公司)测定,每个样品重复2次,两次数值之差不超过0.5。
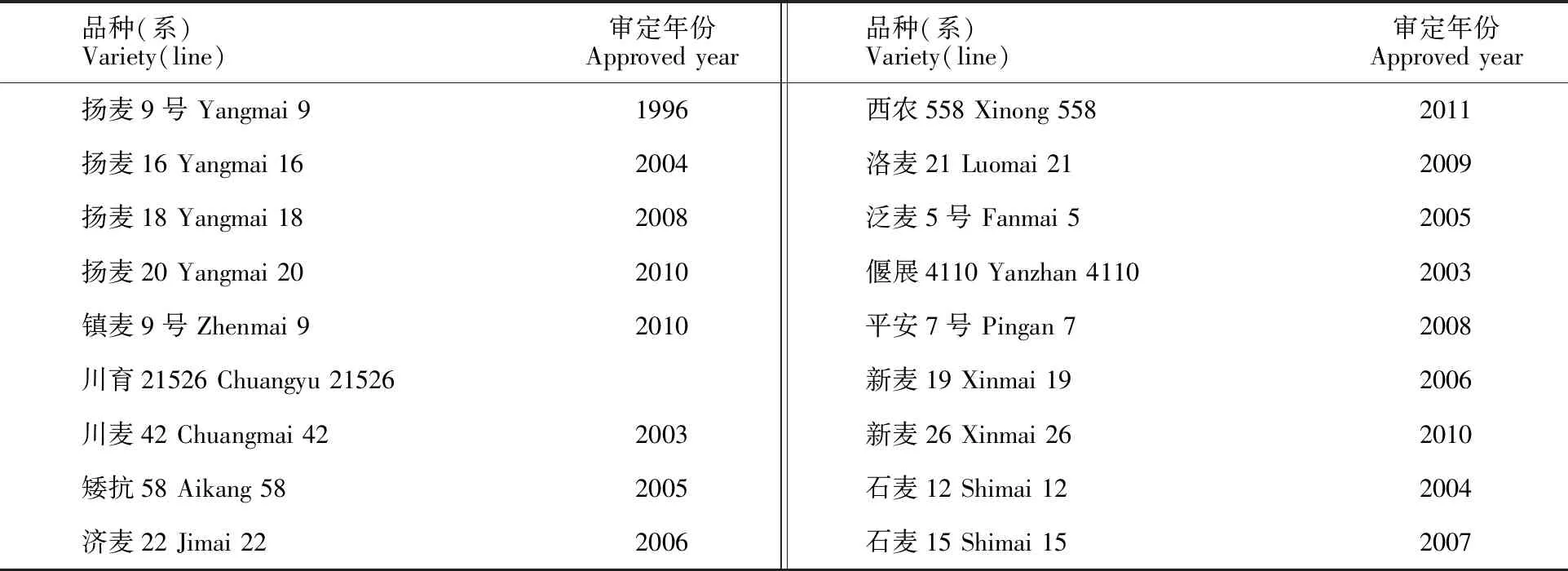
表1 参试材料基本信息Table 1 Information of wheat varieties(line) tested in this study
1.2.4 面粉及其制品色泽的测定
采用色彩色差计(CR-400,日本Konica Minolta公司)测定,以D65的CIE-L*、a*、b*色度系统表示。L*值表示亮度和白度,L*值高则白度和亮度高;a*值表示红绿度,值大则红度高;b*值表示黄蓝度,值大则黄度高。面片每个样品取面坯色泽均匀的两个不同点测量两次,取平均值。
1.2.5 分子标记鉴定
样品基因组DNA提取采用SDS法[28]。利用Sun等[16]和He等[21]开发的分子标记,检测Psy-A1、Ppo-A1的等位变异(表2)。采用10 μL的PCR反应体系,其中包含2×Taq Master Mix 5 μL,20 ng·μL-1的模板DNA 1 μL,10 μmol·L-1的上下游引物各0.2 μL。PCR扩增程序为94 ℃ 3 min;94 ℃ 30 s,55/52 ℃ 30 s,72 ℃ 65 s,35个循环;72 ℃ 10 min。扩增产物采用6%聚丙烯酰胺凝胶电泳分析。
1.3 统计方法
采用Excel 2013进行数据整理,采用SPSS进行数据统计、分析。

表2 分子标记PCR引物序列Table 2 PCR primers of molecular markers used in the study
2 结果与分析
2.1 不同材料面粉和面片色泽分析
由表3可看出,不同小麦品种(系)间面粉白度差异程度不同,泛麦5号白度最高,且与其他品种(系)差异均显著;其次是川麦42和扬麦18;济麦22最低;泛麦5号、川麦42、扬麦18、扬麦20、扬麦9号、平安7号、新麦19和偃展4110面粉白度均大于80。不同品种(系)间面粉L*值的差异程度不尽相同,以泛麦5号最高,且与扬麦18以外的其他品种(系)差异均显著;其次是新麦19和川育21526;济麦22最低。就面粉a*值而言,扬麦20最高,且显著高于其他品种(系);其次是石麦15;川育21526最低。对面粉b*值,以济麦22最高,且与其他品种(系)差异均显著;其次是矮抗58;川麦42最低。放置0 h鲜面片L*值,以扬麦18、泛麦5号、扬麦9号和平安7号较高,4个品种间无显著差异;其次是扬麦20;济麦22最低。放置0 h鲜面片a*值,以川麦42最高;其次是扬麦16、济麦22、石麦15和扬麦20;矮抗58最低。放置0 h鲜面片b*值,以矮抗58最高,且与其他品种(系)差异均显著;其次是济麦22;川麦42最低。供试材料放置2和4 h鲜面片的色泽差异与0 h的表现基本一致。
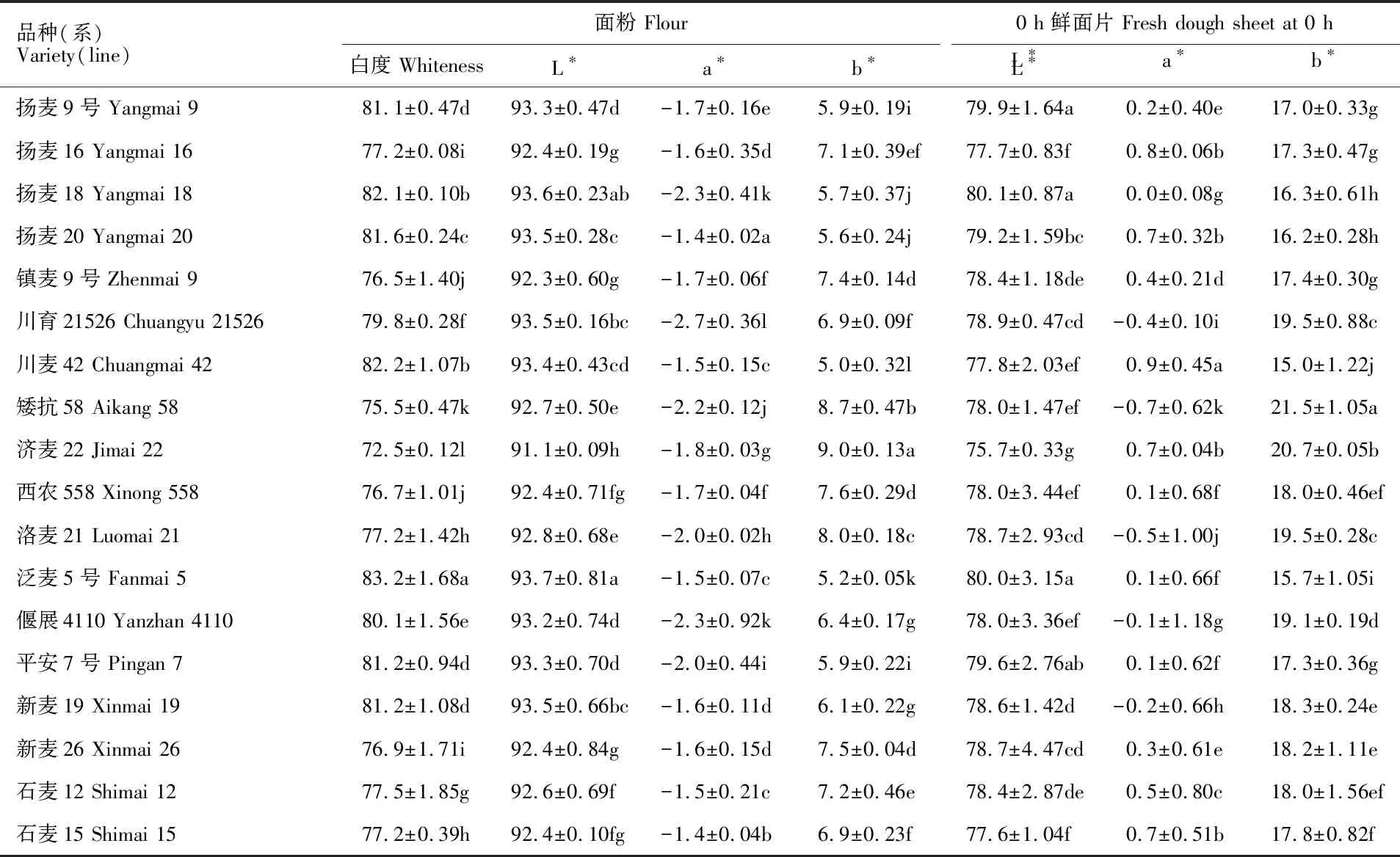
表3 不同材料面粉和0 h鲜面片色泽比较Table 3 Flour and fresh dough sheet color at 0 hour of different wheat materials
同列数据后不同小写字母表示不同材料间在0.05水平上差异显著。
Different small letters in same column mean significant difference among the materials at 0.05 level.
2.2 面粉和不同静置时间面片色泽的相关性
相关分析(表4)表明,面粉白度与面粉L*值呈极显著正相关,与面粉b*值呈极显著负相关,但与面粉a*值相关不显著。面粉白度与放置不同时间鲜面片的L*值呈极显著正相关,与鲜面片的a*值和b*值呈极显著负相关。面粉与放置不同时间鲜面片的L*值、a*值、b*值间均呈极显著正相关。面粉及放置不同时间鲜面片的L*值与其a*、b*值呈极显著负相关,a*值和b*值间无显著相关性。
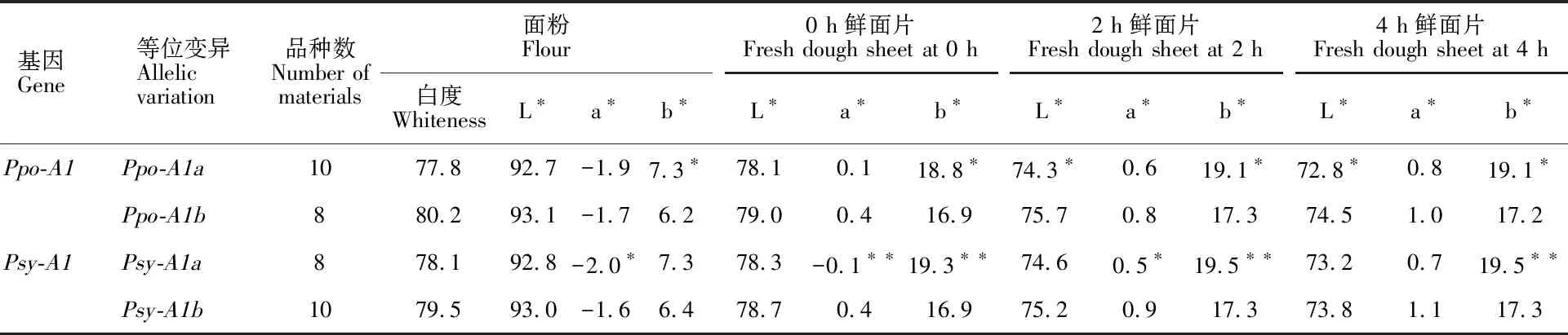
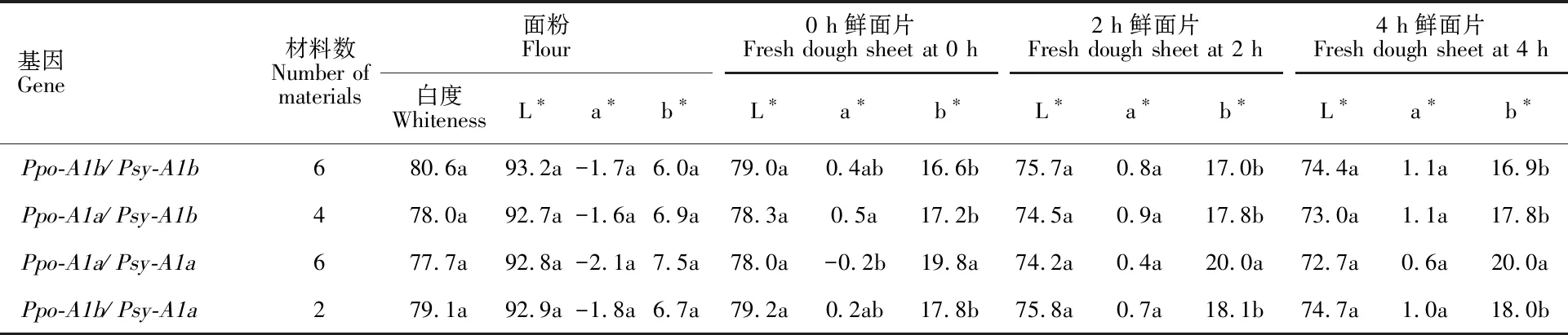
2.3 Psy-A1、 Ppo-A1基因等位变异对面粉和面片色泽影响
2个基因位点各检测到2种等位变异(表5),均对面粉白度、L*值、0 h鲜面片L*值、4 h鲜面片a*值无显著效应(表6)。Ppo-A1对面粉及鲜面片b*值、鲜面片放置2 h和4 h的L*值有显著影响;对b*值效应表现为Ppo-A1b 表4 面粉和面片色泽的相关性Table 4 Correlation between flour and fresh dough sheet color *:P<0.05;**:P<0.01. 共检测到Psy-A1、Ppo-A1基因等位变异组合4种(表7),4种基因型面粉白度差异不显著,但基因型组合Ppo-A1b/Psy-A1b面粉白度值最高,平均80.6,其次是Ppo-A1b/Psy-A1a和Ppo-A1a/Psy-A1b,Ppo-A1a/Psy-A1a最低。对鲜面片b*值,以Ppo-A1a/Psy-A1a基因型组合最高,其他三种基因型组合差异不显著;其他面粉或面片被测色泽指标间差异均不显著。 表5 不同材料的 Ppo-A1和 Psy-A1基因型Table 5 Allelic gene at Ppo-A1 and Psy-A1 loci in different wheat materials 表6 2个基因不同等位变异对面粉和面片色泽的影响Table 6 Effect of alleles of two genes on flour and fresh dough sheet color *:P<0.05;**:P<0.01. 表7 2个基因不同等位变异组合对面粉和面片色泽影响Table 7 Flour and dough sheet color of different allelic combination at Ppo-A1 and Psy-A1 loci 同列数值后不同字母表示不同组合间差异显著(P<0.05)。 Different letters after the values in the same columns mean significant differences among the four allelie combinations at 0.05 level. L*值是表示面粉亮度和白度的指标,L*值=0表示黑色,L*值=100表示白色。a*值、b*值构成一个直角坐标,决定色调,也称彩度系数,其中,+a*值越大颜色越接近纯红色,-a*值越大,颜色接近纯绿色;+b*值越大黄色增加,-b*值越大,蓝色增加。本研究结果表明,泛麦5号、川麦42、扬麦18、扬麦20、平安7号、新麦19、扬麦9号、偃展4110、川育21526面粉白度均达80,L*值均高于93,b*值均低于6.5,面粉色泽好。制成鲜面片后,L*值较高的品种依次是扬麦18、泛麦5号、扬麦9号、平安7号、扬麦20,b*值较低的品种依次是川麦42、泛麦5号、扬麦20、扬麦18、扬麦9号、平安7号。由此可见,扬麦18、泛麦5号、扬麦9号、平安7号、扬麦20面粉色泽较好,鲜面片L*值高,b*值较低,面粉和面片色泽均比较好。前人研究表明,川麦42和偃展4110面粉白度均较高[26-27],这与本研究结果一致。制成鲜面片后,川麦42的b*值虽最低,但L*值仅高于济麦22、石麦15和扬麦16,说明川麦42只能作为优异低黄度的种质资源;偃展4110的鲜面片L*值较面粉显著降低,b*值显著升高,说明这两个品种面粉色泽好,但不适于制作高白度面制食品。 本研究结果表明,面粉白度与面粉及鲜面片L*值呈极显著正相关,与面粉和鲜面片b*值呈极显著负相关;面粉及放置不同时间鲜面片的L*值与其a*、b*值呈极显著负相关。说明面粉的白度与面粉的色泽显著相关,面粉的色泽与面片色泽显著相关,这与王 蕾等[26]研究结果一致。但面粉色泽和面片色泽的表现不尽相同,如川麦42和偃展4110,可能由于面粉加水后PPO活性存在差异,因此,小麦育种中,尤其是高世代材料需加强鲜面片色泽筛选鉴定,提高选择的准确度和效率。 对影响面粉色泽的基因,2AL染色体上基因位点的效应相对更大,可解释表型的37.2%~50.1%,而2DL染色体上的基因仅解释表型的25.1~29.1%,本研究仅对2AL染色体上的基因进行了检测。本研究结果表明,Psy-A1位点主要引起鲜面片a*值和b*值显著变化,Psy-A1a的面片黄度显著高于Psy-A1b,Psy-A1a的面粉和面片红度显著低于Psy-A1b。相吉山等[28]研究表明,Psy-A1基因对面粉黄度的影响与本研究一致,但Psy-A1a的面粉红度和黄度极显著高于Psy-A1b。Ppo-A1基因对面粉及鲜面片b*值、鲜面片放置2 h和4 h的L*值有显著影响,对b*值效应表现为Ppo-A1b 18份材料的4种Psy-A1、Ppo-A1基因等位变异组合,面粉白度差异虽不显著,但基因型Ppo-A1b/Psy-A1b面粉白度值最高;4种基因型鲜面片b*值,以Ppo-A1a/Psy-A1a基因型最高,其他三种基因型差异不显著;其他面粉或面片色泽指标差异不大。说明通过这2个基因等位变异能在一定程度上改良面粉和面片色泽。 扬麦18、泛麦5号、扬麦9号、平安7号、扬麦20具有优良的基因型和面粉及鲜面片色泽。Psy-A1基因主要引起鲜面片a*值和b*值显著变化,Ppo-A1基因对面粉及鲜面片b*值、放置2 h和4 h的鲜面片L*值有显著影响。Psy-A1、Ppo-A1等位变异组合对鲜面片b*值存在极显著影响,Ppo-A1a/Psy-A1a基因型最高,其他三种基因型差异不显著。面粉的白度与面粉的色泽显著相关,面粉的色泽与面片色泽显著相关。但Ppo-A1、Psy-A1主要引起了鲜面片色泽的差异。因此,需通过对面粉和面制品色泽进行共同鉴定,以提高选择的准确度和效率。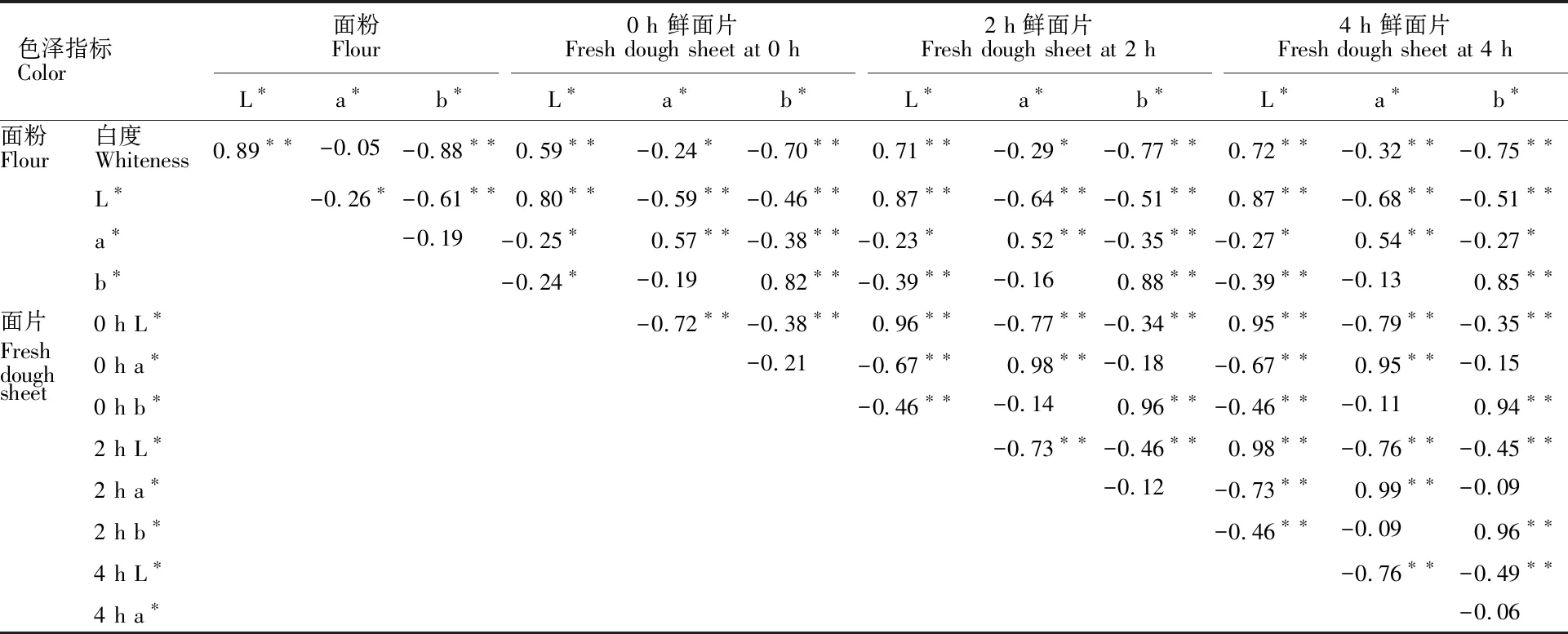
2.4 Psy-A1、 Ppo-A1基因等位变异组合对面粉和面片色泽的影响

3 讨 论
4 结 论

