对虾养殖环境中乳酸菌的筛选及其发酵工艺的研究
陈蕾蕾 邓淑怡 刘唤明 邓楚津

摘要[目的]对虾养殖环境中乳酸菌进行筛选并对其发酵工艺进行研究。[方法]首先利用含碳酸钙的MRS固体培养基从虾养殖环境中的海水和底泥中筛选出有溶钙圈的菌株M5;接着根据16SrDNA基因序列系统发育树分析对菌株M5进行鉴定,最后在单因子实验的基础上,通过正交试验对发酵工艺进行优化。[结果]初步鉴定菌株M5为粪肠球菌,该菌株的最佳发酵工艺为:甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵0.5%,磷酸氢二钾的浓度为0.5%,发酵温度为30℃,发酵时间为48h。在以上工艺下,发酵液中乳酸菌的活菌数高达4.97×108CFU/mL。[结论]本研究对对虾养殖所用乳酸菌的发酵生产具有一定的参考价值。
关键词对虾养殖环境;乳酸菌;筛选;发酵工艺
中图分类号S968.22文献标识码A
文章编号0517-6611(2019)01-0087-03
doi:10.3969/j.issn.0517-6611.2019.01.027
开放科学(资源服务)标识码(OSID):
在水产养殖中,抗生素由于具有高效、快速和廉价等优点而被广泛使用。在对虾的养殖中,常用的抗生素有恩诺沙星、土霉素、头孢、呋喃烯酮酸等。研究表明,传统的抗生素等抗菌化学药物的大量使用甚至滥用不仅扰乱了对虾肠道正常的菌群,引起耐药菌株的产生,而且造成环境中药物的残留,最终威胁着人类的健康和安全,这些问题已引起了人们广泛的关注与焦虑[3],因此,尋找抗生素类化学药物的替代品成为对虾养殖业可持续发展的关键和热点[4]。
乳酸菌可代替抗生素在水质改良、治疗水产动物疾病以及水产动物免疫等方面的应用[5]。有研究表明采用乳酸菌拌料投喂凡纳滨对虾6周后,对虾的免疫力增强,成活率以及弧菌的抵抗力均增强[6];乳酸菌可以抑制对虾养殖过程中副溶血性弧菌的生长[7];张玲等[8]研究结果表明,通过口服与浸浴的方式对中国明对虾和日本囊对虾施用乳酸菌,能有效调节肠道微生物菌群组成,改善养殖水质,提高对虾的成活率,提高对白斑综合症和副溶血弧菌病的抗病力。因此科学施用益生菌是替代当前对虾养殖中的化学药物疗法、构建环境友好型对虾养殖模式的必由之路[9]。
另外从对虾养殖环境中筛选乳酸菌报道较少,且从对虾养殖环境中筛选的乳酸菌应用于对虾养殖有更好的适应性。本研究将从对虾养殖环境筛选乳酸菌,对其发酵工艺进行优化,为对虾养殖中乳酸菌的应用提供技术支撑。
1材料与方法
1.1材料
1.1.1试验原料。
菌株筛选样品:对虾养殖环境中的海水和底泥。
1.1.2培养基。
乳酸菌初筛培养基:蛋白胨15g,牛肉膏5g,氯化钠5g,葡萄糖20g,琼脂粉10g,碳酸钙10g,水1000mL,pH6.2~6.6,121℃灭菌20min,灭菌后放置水浴52℃备用。
乳酸菌计数培养基:MRS固体培养基。
1.1.3试验仪器。
SPX-150B-Z型生化培养箱,MJX-160B-Z型霉菌培养箱,SW-CJ-2F型洁净工作台,均由上海博讯实业有限公司医疗设备厂生产;GZX-9240MBE型电热鼓风干燥箱,由上海精密科技有限公司生产;LS-B50L型立式压力蒸汽灭菌锅,由上海华线医用核子仪器有限公司生产。
1.2试验方法
1.2.1乳酸菌的筛选。
将对虾养殖环境中的水和底泥梯度稀释后,涂布于初筛培养基上,将平板置于37℃培养48h。根据菌落是否具有溶钙圈,以及其颜色、大小、光泽等,挑取疑似乳酸菌的单菌落,进行革兰氏染色检验。凡是革兰氏染色阳性的菌落,在MRS培养基上平板划线分离纯化培养2次,斜面保存。
1.2.2乳酸菌的鉴定。
将筛选出的菌株的16SrDNA进行扩增,扩增成功后的PCR产物送到上海生工公司测序,测序成功后得到的结果递交GenBank数据库中进行Blast比对,再进行相似同源性分析,然后用Maximumlikelihood法绘制系统发育树、BOOTSTRAP分析法分析,最后选取重复1000来评估树的准确性[10-13]。
1.2.3乳酸菌的计数方法
乳酸菌的计数使用MRS培养基,将需要计数的样品进行梯度稀释后,涂布于MRS培养基,选取菌落数在30~300之间平板计数,1个稀释度选择两个平板。
1.2.4单因素实验优化发酵工艺。
①糖蜜浓度的优化。选取5%、10%、15%、20%、25%甘蔗糖蜜浓度作为碳源,37℃发酵培养48h,测定发酵液中乳酸菌活菌数。②蛋白胨浓度的优化。甘蔗糖蜜浓度为5%,添加蛋白胨作为有机氮源,6组的添加量分别为0%、0.25%、0.5%、0.75%、1%、1.25%,37℃发酵培养48h,测定发酵液中乳酸菌活菌数。③硫酸铵浓度的优化。甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,添加硫酸铵作为无机氮源,6组的添加量分别为0%、0.1%、0.2%、0.3%、0.4%、0.5%,37℃发酵培养48h,测定发酵液中乳酸菌活菌数。④磷酸氢二钾浓度的优化。甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵浓度为0.5%,添加磷酸氢二钾作为磷源,6组的添加量分别为0.1%、0.2%、0.3%、0.4%、0.5%,测定发酵液中乳酸菌活菌数。⑤发酵温度的优化。甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵0.5%,磷酸氢二钾的浓度为0.5%,接种。分别在30℃、33℃以及37℃培养24h,测定发酵液中乳酸菌活菌数。⑥发酵时间的优化。蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵0.5%,磷酸氢二钾的浓度为0.5%,配制发酵培养基,接种。在37℃下培养6h、12h、18h、24h、48h、72h,分别测定发酵液中乳酸菌活菌数。
1.2.5正交实验优化发酵工艺。
在单因素实验的基础上,选取糖蜜浓度、蛋白胨浓度、硫酸铵浓度及磷酸氢二钾浓度进行正交实验,正交实验因素和水平如表1所示
2结果与分析
2.1乳酸菌16SrDNA鉴定
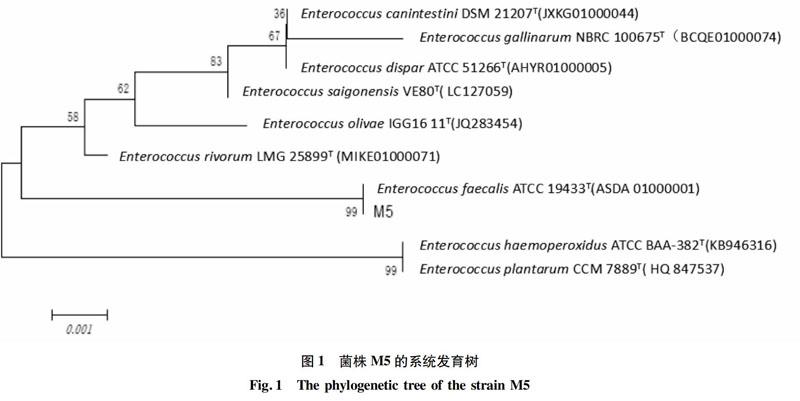
将菌株M5的测序结果,通过NCBI进行16SrDNA数据库BLAST,M5与标准菌株EnterococcusfaecalisATCC19433的相似性最高,高达99.8%。选取序列相似度达99%的部分菌种,采用软件Mega5.05,Maximumlikelihood法制作系統发育树,结果见图1。由图1结果可知,菌株M5在系统发育树上与EnterococcusfaecalisATCC19433在同一支系。综合以上分析,可初步鉴定菌株M5为粪肠球菌。
2.2乳酸菌发酵工艺的优化
2.2.1糖蜜浓度对乳酸菌发酵的影响。
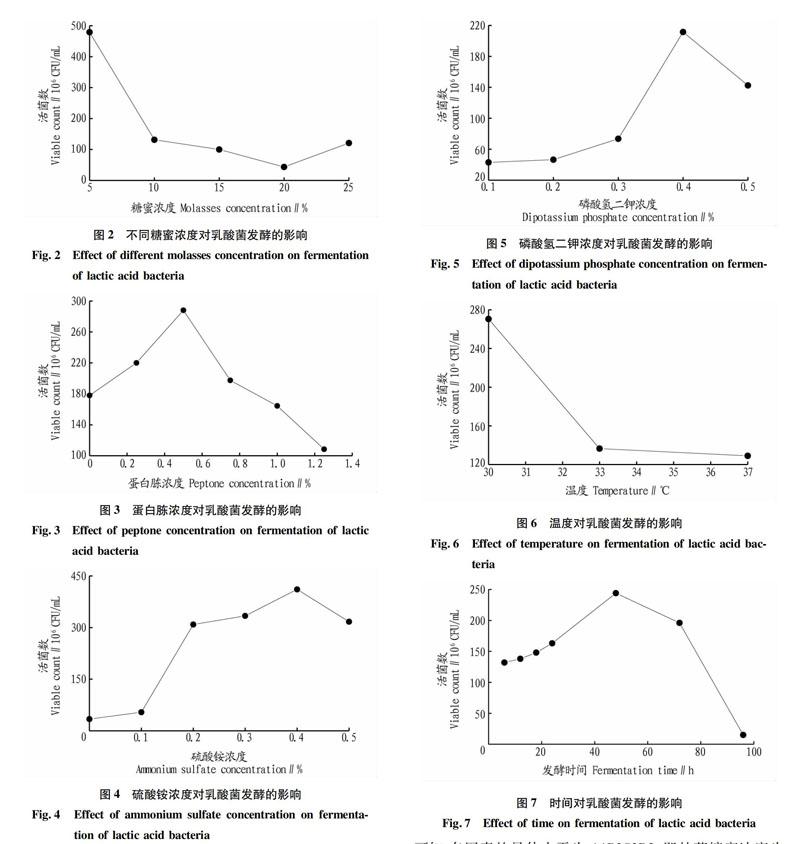
由图2结果可知,在发酵温度和时间相同的条件下,糖蜜浓度为5%时,乳酸菌发酵液中活菌数最多。当糖蜜浓度过高,乳酸菌代谢加快,产物积累,导致培养基的pH过低,抑制乳酸菌发酵。
2.2.2蛋白胨浓度对乳酸菌发酵的影响。
由图3结果所示,随着蛋白胨浓度的增加,发酵液中乳酸菌活菌数先增加后减少,当蛋白胨浓度为0.5%时,乳酸菌活菌数最多。
2.2.3硫酸铵浓度对乳酸菌发酵的影响。
由图4结果可知,在液体发酵培养基中碳源以及有机氮源浓度为最优,发酵温度及时间相同的条件下,当硫酸铵浓度为0.4%时,乳酸菌的活菌数最多。
2.2.4磷酸氢二钾浓度对乳酸菌发酵的影响。
由图5结果可知,在液体发酵培养基中碳源、有机氮源以及无机氮源浓度最佳,发酵温度及时间相同的条件下,磷酸氢二钾浓度为0.4%时,乳酸菌的活菌数最多。
2.2.5发酵温度对乳酸菌发酵的影响。
由图6结果可知,当发酵温度为30℃时,乳酸菌活菌数最多。发酵温度升高后,乳酸菌活菌数减少,因此,最佳发酵温度应选择30℃。
2.2.6发酵时间对乳酸菌发酵的影响。
由图7结果可知:发酵时间小于48h,乳酸菌在正常的发酵繁殖,活菌数逐渐增多;在48h左右,活菌数达到最大值;在48h之后,乳酸菌数目开始逐渐减少,甚至在96h时,乳酸菌活菌数几乎为0。因此,最佳发酵时间为48h。
2.2.7正交实验优化发酵工艺。
在单因子实验的基础上,利用正交实验对发酵工艺进行优化,结果如表2所示,由表2可知,各因素的最佳水平为A1B3C3D3,即甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵浓度为0.5%,磷酸氢二钾浓度为0.5%,并且在以上工艺下,发酵液中乳酸菌活菌数达到4.97×108CFU/mL,R值的大小分别为A>C>D>B。
3结论与讨论
该试验采用从对虾养殖环境中的海水和底泥筛选出的乳酸菌作为菌种,利用革兰氏染色和16SrDNA基因序列分析进行乳酸菌的鉴定,通过单因素实验及正交试验,确定了粪肠球菌M5的最佳发酵工艺为:甘蔗糖蜜浓度为5%,蛋白胨浓度为0.75%,硫酸铵0.5%,磷酸氢二钾的浓度为0.5%,发酵温度为30℃,发酵时间为48h。在以上工艺下,发酵液中的乳酸菌的活菌数高达4.97×108CFU/mL,对对虾养殖所用乳酸菌的发酵生产有一定的参考价值。
参考文献
[1]程秀玉,王炎松.海南省养殖南美白对虾药物残留检测[J].热带农业工程,2016,40(3):1-3.
[2]桂建芳.水生生物学科学前沿及热点问题[J].科学通报,2015,60(22):2051-2057.
[3]ESIOBUN,ARMENTAL,IKEJ.Antibioticresistanceinsoilandwaterenvironments[J].IntJEnvironHealthRes,2002,12(2):133-144.
[4]WANGYB,LIJR,LINJD.Probioticsinaquaculture:Challengesandoutlook[J].Aquaculture,2008,281(1/2/3/4):1-4.
[5]张家国,刘翠玲.乳酸菌代替抗生素在水产养殖上的应用[J].中国水产,2014(7):66-68.
[6]KONGNUMK,HONGPATTARAKERET.EffectofLactobacillusplantarumisolatedfromdigestivetractofwildshrimpongrowthandsurvivalofwhiteshrimp(Litopenaeusvannamei)challengedwithVibrioharveyi[J].Fish&shellfishimmunology,2012,32(1):170-177.
[7]WANGW,LIM,FANGWH,etal.ApredictivemodelforassessmentofdecontaminationeffectsoflacticacidandchitosanusedincombinationonVibrioparahaemolyticusinshrimps[J].Internationaljuornaloffoodmicrobiology,2013,167(2):124-130.
[8]张玲.一株对虾肠道益生菌的筛选及其作用机理和应用效果的研究[D].青岛:中国海洋大学,2007.
[9]文金顺.海南土著乳酸菌筛选及其对凡纳滨对虾生长影响的研究[D].海口:海南大学,2017.
[10]杨吉霞,张利玲,蒋厚阳,等.眉山泡菜中乳酸菌的分离鉴定[J].食品科学,2015,36(17):158-163.
[11]华鹤良.乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].扬州:扬州大学,2014.
[12]曾议霆,郭溪浪,周康,等.富硒乳酸菌的筛选及鉴定[J].食品科学,2015,36(3):178-182.
[13]凌代文.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:1-25.

