肠道真菌菌群失调对小鼠角膜创伤修复的影响
贾路路,路顶立,刘素素,陈雨晴,李志杰,2,王丽娅
0引言
角膜创伤是眼科常见的急症,角膜创伤的愈合是一个重要的临床问题,快速良好的角膜创伤修复对于恢复角膜完整性和视力至关重要。角膜的创伤修复是一个动态、有序的过程,涉及到复杂的细胞和分子机制。这一过程中生长因子和细胞因子是重要的调节因子,可刺激参与伤口愈合的细胞生长、增殖、迁移、分化、黏附,以及细胞外基质沉积和蛋白酶调节等[1-2]。动物实验研究显示,在角膜创伤修复的初期,角膜上的免疫细胞通过角膜缘血管网向创伤区域迁移,通过释放大量的生长因子、细胞因子和各种酶类等物质促进创伤的愈合。其中中性粒细胞和γδT细胞发挥着重要的作用[3-5]。因此,任何破坏或者干扰炎症细胞功能和免疫反应过程的因素都会造成角膜创伤修复的延迟。
哺乳动物肠道存在着多样复杂的共生微生物,其中包括细菌、古生菌、真菌、病毒等。人体肠道中约定植1012~1014个微生物,基因总量是人基因的150倍,被称为人类的第二套基因组[6]。大量研究表明,肠道微生物参与人体的营养代谢、肠道功能、免疫调节等生理过程,肠道微生态的失调常伴随多系统疾病的发生,如心脑血管疾病、肥胖、糖尿病,甚至神经组织的修复再生等[7-10]。这些研究主要阐明肠道细菌与疾病发生和发展的关系,但在肠道真菌方面研究甚少。肠道真菌作为肠道微生态的重要一员,亦有着不可忽视的作用。长期口服抗真菌药物两性霉素B可造成肠道真菌菌群失调,增加炎症性肠道疾病和过敏性呼吸道疾病的严重程度。并且两性霉素B在肠道几乎不可吸收,因此可以排除肠道外非特异效应的作用[11-12]。本研究通过两性霉素B诱导肠道真菌菌群失调,从而探索肠道真菌菌群失调对角膜创伤修复的影响,试图从肠道真菌菌群方面为角膜创伤的治疗提供思路。
1材料和方法
1.1材料
1.1.1实验动物SPF级C57BL/6J雄性小鼠60只,8~12周龄,体质量23~25g,均购自南京大学-南京生物医药研究院,裂隙灯下检查双眼角膜均无病变。小鼠的饲养与使用均遵照视觉与眼科研究协会制定的科研动物使用规范,经河南省眼科学与视觉科学重点实验室管理与伦理审查委员会批准。动物饲养环境为12h光照/12h黑暗(上午6∶00开灯,下午6∶00关灯)的循环周期。
1.1.2主要实验试剂免疫荧光试剂FITC/Gr-1(553127,BD Bioscience);PE/GL3(553178,BD Bioscience);4,6-diamidino-2-phenylindole(DAPI)(944021,美国Invitrogen公司);Bovine Serum Albumin(9048-46-8,BIOSHARP);Triton X-100(T8200,北京索莱宝科技有限公司);封片胶(F4680-25ML,美国Sigma公司);多聚甲醛(北京索莱宝科技有限公司);戊巴比妥钠(国药集团化学试剂有限公司);荧光素钠(H11619-1009,美国Alcon公司);两性霉素B(大连美仑生物技术有限公司);粪便样本DNA提取试剂盒(Omega)。
1.1.3主要仪器设备手术显微镜(YZ20T4,苏州六六视觉科技股份有限公司);超净工作台(SW-CJ-1F,苏净集团苏州安泰空气技术公司);裂隙灯(SL.8Z,日本Topcon);解剖显微镜(Discovery V20,德国Zeiss);荧光显微镜(Eclipse 80i,日本Nikon);单光子共聚焦荧光显微镜(NikonC1Si,日本);移液器(法国Gilson);角膜剪和显微无齿镊(苏州明仁医疗器械厂);环钻(2mm,美国);高尔夫刀(Accutome,美国);分析天平(PL402-L,瑞士)。
1.2方法
1.2.1诱导小鼠肠道真菌菌群失调利用抗真菌药物两性霉素B诱导小鼠肠道真菌菌群失调,选取体质量均一(23±2g)、角膜无病变小鼠60只,随机分为两组:两性霉素B组(Amph)与对照组(Ctrl)。两性霉素B组按60mg/(kg·d)的剂量将两性霉素B加入小鼠饮食中喂养4wk[13],对照组正常饮食喂养4wk。

图1 角膜分区模式示意图(1区为角膜缘区,5区为角膜中央区)。
1.2.2小鼠粪便样本收集和DNA提取饲养4wk后将待取样小鼠放入铺有灭菌滤纸的笼子内,每笼1只小鼠,排便后立即用无菌棉签收集小鼠粪便,不同的小鼠取样要更换新的滤纸。采集的小鼠粪便参照粪便样本DNA提取试剂盒使用方法(E.Z.N.A.TMStool DNA Kit)提取样本DNA。采用包含“GTGAATCATCGARTC”序列的上游引物和包含“TCCTCCGCTTATTGAT”序列的下游引物扩增真菌ITS rDNA上的ITS2高变区,构建高通量测序文库并检测,然后利用Illumina MiSeq PE250平台进行测序。测序结果经过分析,得到样本物种信息。
1.2.3小鼠角膜上皮创伤两性霉素B诱导肠道真菌菌群失调后,于中午12∶00制作小鼠角膜上皮创伤模型。10g/L戊巴比妥钠按80mg/kg剂量腹腔注射麻醉小鼠。解剖显微镜下使用环钻在小鼠角膜中央标记直径为2mm圆形区域,采用高尔夫刀机械性刮除标记圆形区域的角膜上皮细胞层[5]。以上过程均在超净工作台中进行。
1.2.4角膜上皮创伤修复观察创伤后0、6、12、18、24、30h采用20g/L荧光素钠溶液染色两组小鼠角膜,在裂隙灯显微镜下观察角膜创伤修复情况并拍照,通过图像处理软件Photoshop CS6(13.0.1)计算创伤区域面积。
1.2.5角膜免疫荧光标记两组小鼠分别于创伤后0、6、12、18、24、30、36h各时间点分别处死3只小鼠,取角膜组织,修剪角膜去除虹膜、晶状体等组织,于2%多聚甲醛中固定40min,固定后1×PBS冲洗角膜,添加0.2%Triton-BSA溶液中室温破膜、封闭30min,然后分别加入FITC/Gr-1、PE/GL3,4℃避光孵育过夜,次日加入1μg/mL DAPI染液,避光室温染色。染色后取出角膜组织,1×PBS冲洗。将角膜上皮层朝上使用手术刀片将角膜均匀切割成4瓣平铺于载玻片上,使用封片胶封片。
1.2.6分裂细胞、中性粒细胞和γδT细胞定量分析小鼠角膜进行免疫荧光染色后,对角膜中分裂细胞、中性粒细胞和γδT细胞进行定量分析。将角膜从角膜缘到角膜中央依次分为1~5区(图1)。在单光子共聚焦显微镜40倍油镜下分别计数角膜两条直径上从一侧角膜缘到另一侧角膜缘9个视野DAPI标记的分裂细胞、PE/GL3标记的γδT细胞。单光子共聚焦显微镜断层扫描角膜两条直径上第4区FITC/Gr-1标记的嗜中性粒细胞,然后使用Imaris7.2.1软件进行定量统计。

图2 两组小鼠肠道真菌菌群在门、纲水平上的构成 A:门水平;B:纲水平(不同颜色表示不同菌群)。

注:Ctrl组:对照组;Amph组:两性霉素B组。

表2 两组小鼠创伤后不同时间点分裂细胞计数
注:Ctrl组:对照组;Amph组:两性霉素B组。
1.2.7角膜上皮厚度测量两组分别于创伤后24、48、96h各处死3只小鼠,取下完整小鼠眼球,经固定、脱水浸蜡、包埋、切片、脱蜡等过程,制作石蜡切片并进行HE染色,在显微镜10倍物镜下拍摄图像并使用Image J软件进行角膜厚度定量计算。
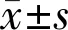
2结果
2.1两性霉素B诱导后小鼠肠道真菌菌群发生改变小鼠粪便样本ITS rDNA测序结果显示:两性霉素B处理4wk后,小鼠肠道真菌菌群多样性和结构发生改变,其中Alpha多样性分析显示两组Shannon指数差异有统计学意义(P=0.02),其余各项指标差异无统计学意义(表1)。说明抗真菌药物处理后肠道真菌菌群的多样性存在一定程度的差异。肠道真菌菌群结构分析显示,在门水平上,两组间担子菌门(basidiomycota)和接合菌门(zygomycota)差异有统计学意义(P=0.032、0.008,图2A);在纲水平上,两组酵母菌纲(saccharomycetes)、黑粉菌纲(ustilaginomycetes)及微球黑粉菌纲(microbotryomycetes)差异有统计学意义(P=0.008、0.016、0.032,图2B)。结果证明,两性霉素B处理后造成小鼠肠道真菌菌群改变。
2.2肠道真菌菌群失调对小鼠角膜创伤再上皮化的影响角膜上皮创伤后,两组小鼠角膜均逐渐进行修复,Ctrl组小鼠创伤后24h荧光素钠染色角膜上皮无着染,而Amph组仍有部分着染,并且创伤后30h仍有着染(图3A)。Amph组小鼠与Ctrl组小鼠相比,角膜创伤后再上皮化速度明显延缓(图3B)。创伤后,两组分裂细胞数量持续增加,但Amph组上皮层分裂细胞总数显著低于Ctrl组,各时间点比较差异均有统计学意义(表2)。实验表明肠道真菌菌群失调导致小鼠角膜创伤后再上皮化时间延长,上皮层分裂细胞数量与Ctrl组相比显著下降。

图3 两组小鼠角膜创伤修复的动态变化 A:创伤后不同时间点荧光素钠染色显示创伤面积;B:创伤后各时间点两组的角膜创伤面积占创伤原始面积百分比(aP<0.05,bP<0.01 vs Ctrl组)。

图4 两组小鼠创伤后48h角膜HE染色和上皮层厚度定量 A:创伤后48h角膜上皮组织形态变化(×100);B:创伤后48h角膜上皮厚度定量计算(bP<0.001 vs Ctrl组)。

表3 两组小鼠创伤后不同时间点γδT细胞计数个/视野)
注:Ctrl组:对照组;Amph组:两性霉素B组。

表4 两组小鼠创伤后不同时间点中性粒细胞计数个/视野)
注:Ctrl组:对照组;Amph组:两性霉素B组。
2.3肠道真菌菌群失调对小鼠角膜炎症细胞的影响通过观察创伤后炎症细胞的数量变化,说明肠道真菌菌群失调对炎症反应的影响。两组γδT和中性粒细胞数量在创伤后均明显增加,但是与Ctrl组相比,Amph组角膜两条径线上γδT细胞数量显著下降(表3),中性粒细胞数量也明显降低(表4)。结果表明,肠道真菌菌群失调小鼠创伤后炎症反应降低,炎症细胞数量明显减少。
2.4肠道真菌菌群失调对创伤修复后角膜厚度的影响Amph组小鼠角膜创伤后上皮厚度在创伤后24、48、96h均小于Ctrl组(t24h=2.60,P24h=0.014;t48h=7.58,P48h<0.01;t96h=2.85,P96h=0.007),创伤后48h时Amph组角膜上皮厚度为10.02±1.62μm,Ctrl组小鼠角膜上皮厚度为14.58±1.97μm,差异有统计学意义(P<0.001,图4)。表明肠道真菌菌群失调小鼠角膜创伤后再上皮化及复层化能力显著降低,角膜上皮厚度下降。
3讨论
创伤后炎症反应是组织完成修复的一个必经过程[14]。组织创伤后通过一系列的微血管反应,大量的炎症因子和其他因子等刺激微血管扩张、血管内皮细胞间隙增大、黏附分子表达增加,促使炎症细胞向创伤区域迁移、浸润[15]。角膜创伤后,γδT细胞在趋化因子CCL20的诱导下聚集在角膜上皮层,γδT细胞可以产生IL-17、IL-20和IL-22等炎症因子,促使中性粒细胞向创伤区域的募集和上皮细胞的分裂,从而诱导炎症反应和促进上皮修复,TCRδ-/-小鼠角膜创伤后表现出炎症反应的降低、创伤愈合的延迟,在创伤后96h上皮细胞密度的降低,所以γδT细胞在角膜创伤后中性粒细胞在角膜缘血管中的定位和上皮细胞的有丝分裂至关重要[4-5,16]。创伤早期,白细胞的迁移可以促进再上皮化,研究表明通过抗体中和法去除中性粒细胞的小鼠角膜创伤愈合延迟,证明中性粒细胞参与创伤修复[17]。本研究中,角膜上皮创伤后,角膜缘γδT细胞和中性粒细胞均迅速增多,中性粒细胞在创伤后迅速向创伤区域迁移,但创伤后6、12h中性粒细胞在第4区计数差异无统计学意义,可能是炎症反应初期中性粒细胞仍未大量迁移至创伤区域,但创伤后24h在角膜第4区浸润量达高峰,之后又逐渐恢复正常。但肠道真菌菌群失调组γδT细胞在角膜缘聚集明显减少,分裂细胞数量和中性粒细胞的浸润减少,导致角膜创伤的愈合延迟,在创伤后24、48、96h角膜上皮厚度均较对照组明显减少,这也验证了上述研究的结果。所以正常的免疫反应在角膜创伤修复中占有重要地位。
正常的肠道菌群对免疫系统具有重要作用。过去的研究表明,肠道细菌对调节机体稳态和免疫反应至关重要;然而,近几年来研究发现肠道真菌对这些过程也有很大的影响[18-19]。新的研究表明,真菌菌群的破坏可能会对宿主免疫系统产生有害影响[20-22]。在对慢性酒精性肝硬化、强直性脊柱炎等疾病的研究中,均发现肠道真菌菌群多样性和结构上的改变,这些疾病的发生和肠道真菌菌群之间关系密切[13,23]。研究表明在宿主抗真菌的免疫反应中NF-κB信号通路发挥重要作用[24],并且IL-22、IL-17参与肠道黏膜免疫反应,直接参与控制肠道真菌菌群,缺乏IL-22的小鼠胃肠道更易感染念珠菌[18,25]。而NF-κB信号通路被认为是与角膜创伤后炎症反应关系最密切的调控分子,IL-17和IL-22在角膜创伤修复中也有重要的作用[26]。因此我们推测,肠道真菌失调可能通过多种机制影响局部和全身免疫状态,其中包括调节细胞因子环境、激活不同细胞类型和释放代谢物等[22],从而影响了创伤修复中炎症反应的信号传导通路、炎症细胞的迁移和募集、炎症因子和其他调节因子的产生,进一步降低了炎症反应并延缓修复过程。
本实验采用属于近交系的C57小鼠,因其具有基因纯合度高、遗传背景明确、动物模型重复性较好的优点,所以我们前期很多研究都建立在C57小鼠上,其它品系小鼠是否会有不同的研究发现,可以作为我们下一步新的研究方向。另外本研究发现抗真菌药物处理后肠道真菌中一些菌群发生明显变化,但在国内外文献中未见对这些显著差异菌属的研究报道,因此其与机体免疫反应和肠道微生态的相关性不甚明确,对角膜创伤修复的影响更是知之甚少。并且肠道真菌和细菌之间有着密切的拮抗、互利、共生关系,可以通过物理接触和分泌分子直接发生,或者通过改变宿主的免疫反应间接发生[22,27]。那么小鼠角膜创伤修复的延迟是由肠道真菌菌群失调直接导致还是间接的细菌改变所造成,仍需要后续大量的实验来验证。本研究虽然发现肠道真菌菌群的失调延缓了角膜创伤的修复,但是未能揭示肠道真菌菌群的具体作用机制以及与角膜创伤修复的相互关系,这将是我们下一步研究的方向和重点。

