3D打印钛金属骨科植入物应用现状
甄 珍 王 健 奚廷斐 刘 斌*
1(国家药品监督管理局医疗器械技术审评中心,北京 100087)2(中国食品药品检定研究院医疗器械检定所,北京 102629)3(北京大学前沿交叉学科研究院,北京 100871)
引言
3D打印技术(three-dimensional printing,3DP),或者称为增材制造(additive manufacturing),于20世纪80年代逐渐兴起,其制造原理是根据计算机辅助设计模型(computer aided design or computer aided manufacturing,CAD/CAM)或是断层扫描(computed tomography/magnetic resonance imaging,CT/MRI)形成的数据,通过计算机系统控制能量源(电子束、激光束等热源),对逐层铺展的离散材料进行扫描固化,从而直接成形得到三维零件,在材料成型工程中对其微观结构进行精确控制,快速加工制造成任意形状的3D复杂物体[1-2]。3D打印具有自由成型的特点,在快速精确制造多孔和具有复杂微观结构的植入物方面具有独特优势,有利于减少患者的等待时间,提高手术质量,还解决了传统通用型、标准型植入器械形状不匹配难以满足临床需求的问题,因此在生物医用领域得到了快速发展,主要应用于齿科、骨科及颅颌面外科等硬组织的修复和替代医疗硬植体市场[3]。
3D打印骨科植入物的原材料研究主要集中于PEEK(聚醚醚酮)和钛及钛合金两大类。钛金属具有高的比强度、与皮质骨近似的低弹性模量、低密度、高耐蚀性和良好的生物相容性,因此被作为创伤类骨钉骨板、膝/髋关节假体以及脊柱植入物等广泛地应用于骨科植入物领域。
由于3D打印技术独特的优势以及钛金属本身良好的生物相容性和力学性能,3D打印钛金属骨科植入物近10年来得到广泛的发展,目前各大全球性医疗器械公司都推出了各自的3D打印骨科植入物产品,种类涉及髋关节、膝关节、脊柱、颅颌面等假体(见表1),其中中国已上市的3D打印钛合金骨科植入器械产品分别为3D打印髋臼杯、人工椎体和脊柱椎间融合器,以及金属骨小梁AVN重建系统。特别是2016年获得CFDA注册批准的3D打印人工椎体为世界首例,标志着我国在3D打印植入物领域居于世界领先水平。
1 植入物特点
骨是一种具有独特结构的高密度结缔组织,在结构上主要分为皮质骨和松质骨两种类型。松质骨位于骨的内部,呈海绵状,由相互交织的骨小梁排列而成,孔隙率为50%~90%,骨小梁延应力方向生长以承受更大的重量。皮质骨是分布于骨头外周表面的骨密质,由骨板紧密排列而成,孔隙率小于10%[1]。由于骨骼再生能力强,特别是在年轻人中,大多数微骨折在无过多外加干预的情况下会自愈合。然而,当骨缺损较大,如骨肿瘤切除或严重的不愈合骨折,则需要植入一个修复体来引导骨再生[4]。考虑到骨的复杂生理环境,骨的独特复杂的力学转导生长机制对骨科植入物的制造提出了严峻的挑战。
传统的金属加工通常采用等材模具铸造或者减材工艺进行植入物的制造,对于单件或者少量的复杂结构产品来说生产成本较高。这些加工方法只能加工出全致密或全多孔的结构,不能实现多孔结构与致密体之间的良好配合,对于结构复杂的骨植入物制造捉襟见肘,难以模拟真实骨组织中皮质骨与松质骨的结合结构,无法实现骨组织的结构和生物力学的重现。而电子束熔化成型(electron beam melting,EBM)和选择性激光熔融(selective laser melting,SLM)等3D打印技术和设备的发展,可以高精度、高效率地满足小零件的制造和大规模的生产需要,并且打印出可控的微孔结构,实现对真实骨组织的完美复刻[5]。因此,3D打印骨科植入物具有以下特点:
1)个性化定制。3D打印技术能够根据患者原生骨骼的特征进行个性化定制,制造出与原生骨骼完全匹配的产品,从而减少植入物对人体的影响,最大程度地恢复人体骨骼的正常功能。
2)微观结构精准。3D技术融化的钛粉层厚约150 μm,与骨小梁100~140 μm的尺寸接近[6],同时能够打印出贯通的粗糙网孔结构,促进成骨细胞的黏附增殖,以实现植入物与骨组织的生物固定,达到骨愈合的目的[7];通过调整孔径、孔隙率的大小来调节植入物的密度、强度和弹性模量,模仿天然的松质骨和皮质骨结构[8],使植入物外形和力学性能与人体自身骨达到双重适配。
3)成本低,周期短,材料利用率高。铸造或减材制造等传统的加工工艺,需要定制模具或者切削大量原料,对于单件或者少量的产品来说生产成本较高。3D打印技术从设计到制造出一个产品,最快可以在24 h内完成,极大地缩短了交货时间,并且打印过程通常是在真空或者惰性气体保护下进行的,近净成型,材料可以循环利用。
2 成型原理
目前的3D打印技术主要有:立体平板印刷(stereo lithography appearance,SLA)、熔融层积成型(fused deposition modeling,FDM)、电子束熔化成型(electron beam melting,EBM)、选择性激光熔融(selective laser melting,SLM)、激光熔敷(laser engineered net shaping,LENS)、三维喷印(three-dimension printing,3DP)、数字激光成型(digital light processing,DLP)、UV紫外线成型、分层实体制造(laminated object manufacturing,LOM)等。用于3D打印钛合金植入物的成型工艺以EBM和SLM两种技术为主。
电子束熔融(EBM)系统通过在高真空气氛下使用磁导电子束(最高可达3 kW)逐层熔化金属粉末来制造零件。选择性激光熔融(SLM)也被称为直接金属激光烧结(direct metal laser-sintering,DMLS)或选择性激光烧结(selective laser sintering,SLS),使用功率为200~400 W的大功率光学激光器,将金属粉末熔合成固体部件。图1为两种3D打印技术设备系统的示意图[9],其打印工艺的基本流程类似。首先,根据计算机辅助成型或者断层扫描数据,形成预打印植入物的三维模型;然后,按照一定的厚度对该三维模型进行分层切片处理,将三维数据离散成一系列二维数据;最后,将所有的数据导入打印控制设备中进行打印,通过铺粉—(预加热)—融化—平台下降—铺粉的循环加工过程,可得到最终的成型件[21]。在加工过程中,当打印的部件与工作平台夹角小于一定角度时,由于熔融的金属无法支撑自身的重量,需要增加支撑结构,防止塌陷,并且减少热应力导致的翘楚等变形,以保证成型部件的精度。

表1 国内及国际较早上市的部分3D打印钛金属骨科植入物Tab.1 Examples of early marketed 3D-printed titanium orthopaedic implants in China and abroad
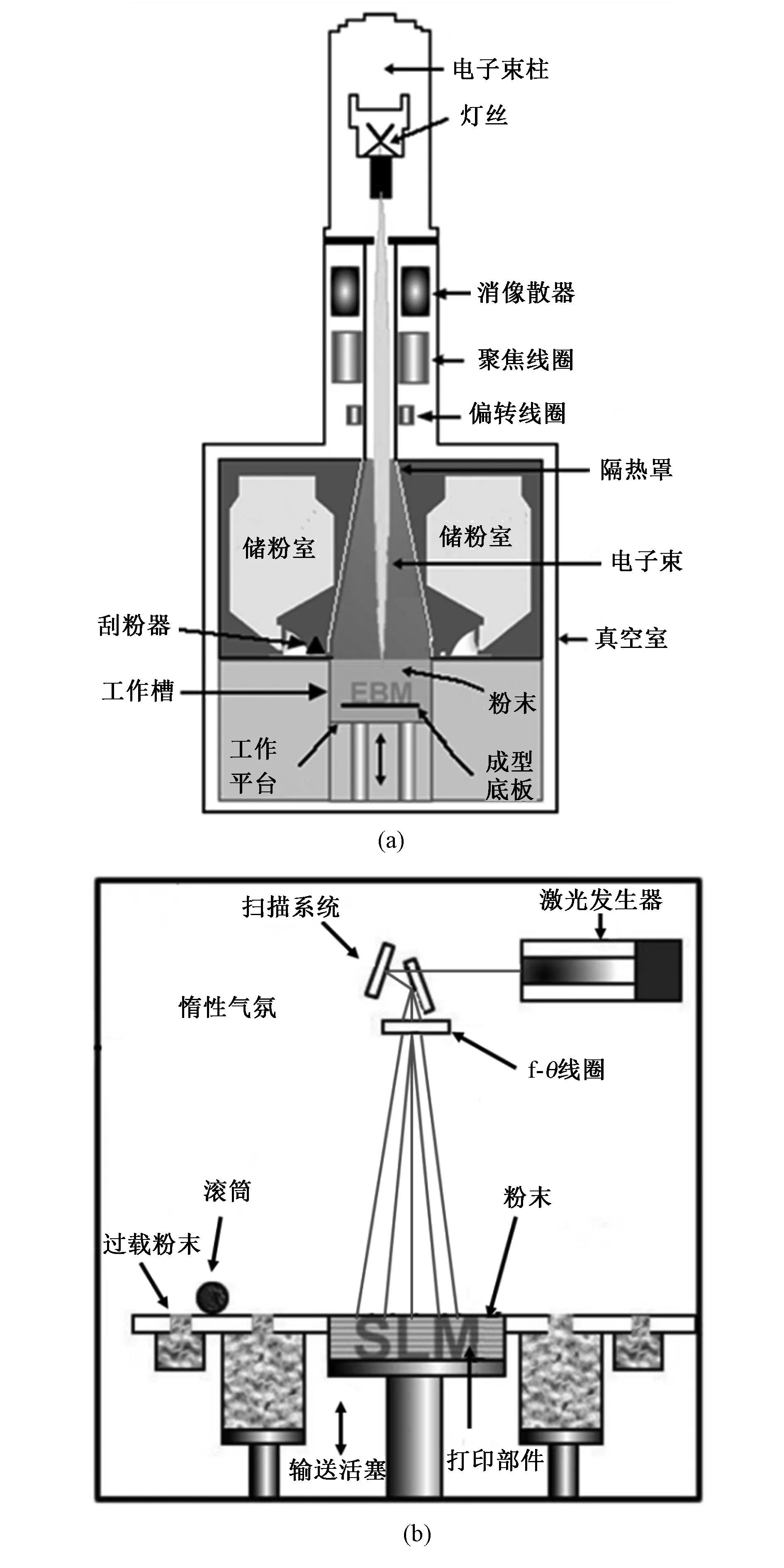
图1 3D打印技术设备示意。(a)电子束熔融系统(EBM);(b)选择性激光熔融系统(SLM)Fig.1 Schematic diagram of 3D printing technology equipment. (a) electron beam melting system(EBM); (b) selective laser melting system(SLM)
两种3D打印技术的区别在于以下几个方面:
1)辐照热源不同。在EBM辐照热源为电子束加工过程中,电子束能量集中在熔化金属部分及热辐射到周围粉末,能量可以被充分利用;SLM辐照热源为激光束,打印过程中约95%的能量由于金属粉末的光反射而损失掉,能源利用率较低[22],但是激光束斑更小,有利于精细零件和复杂结构的成型。
2)保护气氛不同。EBM加工舱是高真空保护状态(10-5~10-6Pa),避免了钛金属粉末的氧化,提高了产品的纯净度;SLM为惰性气体保护状态(如氮气或氩气等),保护力度较低。
3)工作成型预加热温度不同。EMB需要对粉末进行预加热至600~1 200℃,打印部件的残余应力较低,表面粗糙度较高;SLM通常不需要进行预加热或者较低温度(低于300℃)的预加热,因此容易产生热应力、残余应力而导致部件变形和开裂[23],需要后续热处理。
4)金属组织不同。SLM冷却速度快,易形成马氏体,使其制造的钛合金零件强度高于EBM,但塑性要低于EMB[24],不过经过后续热处理后,两者组织和力学性能基本一致。
从以上几点对比可知:两种技术各有特点和优势,EBM精度略差,但成型效率高,成型部件残余应力低,不需要二次热处理,比较适合骨科植入物的直接成型,目前全球已上市的钛及钛合金骨科植入产品[10]包括国内已上市的3D打印产品,多由EBM技术制备而成[25];SLM成型效率较低,残余应力较大,需要二次热处理,但成型精度高,在精细零件和复杂结构方面更具有优势。
3 钛金属粉末
3D打印技术对钛合金粉末材料有很高的性能要求,其纯净度、粉末球形度、粒径尺寸及分布范围、流动性、松装密度等对成型效果均有影响[26]。在3D打印钛金属粉末的制备过程中,由于制粉工艺的缺陷会引入一些杂质,其熔点与基体粉末不同,打印过程中会产生气孔等缺陷,影响成品的致密性和力学性能。在打印加热的过程中,由于钛粉末的热力学性能不稳定,易与杂质元素氧、氮、氢等发生化学反应,使材料的塑性和韧性下降[27-28]。因此,对3D打印用钛金属粉末的纯净度需要严格控制。粉末球形度是指金属粉末颗粒接近球体的程度,流动性是指以一定质量的金属粉末颗粒流过规定孔径的量具所需要的时间,松装密度是指在规定条件下粉末自由填充单位容积的质量[29]。粉末球形度好、粒径尺寸大、松装密度增加,会提高粉末的流动性[30]。粉末的流动性直接影响打印过程中铺粉的均匀度,在打印过程中不易堵塞供粉系统,进而提高3D打印零件的尺寸精度、表面质量以及零件的密度和组织均匀性。粉末粒度的大小直接影响铺粉层的厚度,铺粉层的厚度为粉末直径的2倍以上,粒度小的粉末比表面积大利于提高打印件的致密度和强度,但是细颗粒过多会导致铺粉厚度不均匀,且易团聚不利于输送,影响打印过程的持续进行,因此需要粉末颗粒有一定的粗细搭配[31]。目前3D打印金属粉末球形度要求98%以上,粉末粒度范围是15~53 μm(细粉)、53~105 μm(粗粉)[30]。目前,我国在粉末原材料的生产及产业化方面与发达国家还有很大差距,市场上90%的3D打印钛合金粉末依赖进口,高品质钛合金粉末价格高达200~400 美元/kg,制约了我国3D打印技术产业的发展。
球形度好的粉体具有更好的流动性,使打印过程中铺粉和送粉更容易进行,同时利于粉末的紧密堆积,制造出更致密和高强度的产品。一般由金属液态或熔融态转变为粉末时,颗粒形状趋于球形。因此,目前气雾化法、等离子旋转电极法已成为生产3D打印金属粉末的主流制备技术。气体雾化法(air atomization technique,AA法)借助高速气流来击碎金属液流,之后使其凝固为金属粉末,成本相对较低,细粉收得率较高,但由于存在坩埚和喷嘴的双重污染,粉末纯净度较差,且含卫星式粘连粉、包覆粉末、破碎粉、空心粉及不规则粉末。等离子旋转电极法(plasma rotating electrode-comminuting process,PREP法)以钛金属制成自耗电极,其端面受电弧加热而熔融为液体,通过电机高速旋转的离心力将液体抛出,并粉碎为细小的液滴,后冷凝为球形粉末,球形度好,表面光洁,流动性好,不规则粉及空心粉少,且氧元素含量低,与原始棒材接近,粒度分布范围更窄,但是产生的钛合金粉末粒度较粗,细粉收得率相对较低,经后续提高电极转速可以制备较细的球形粉末[32]。
4 临床研究
近10年来,3D打印钛合金骨科植入物发展迅速,各医疗器械巨头纷纷推出3D打印产品,目前已上市的产品也多为采用3D打印技术模拟骨小梁结构打印的标准规格化产品,而3D打印更广阔的应用前景在于为满足指定患者的罕见或特殊病损情况定制的3D打印个性化植入器械。尤其是骨肿瘤切除以及关节翻修造成的复杂骨缺损以及严重的骨质疏松患者,由于病灶大且不规则,骨再生能力有限,标准规格的骨植入物难以达到理想的效果,而3D打印定制式钛金属骨科植入物可以发挥其独特优势,为患者提供精确匹配的解决方案[33]。
骨盆是人体躯干与肢体连接的重要骨性结构,解剖结构复杂,且原发恶性肿瘤早期无特殊症状,一旦发现体积都比较大,切除后造成下肢与躯干失去联系,严重影响患者的行动。采用3D打印定制式钛金属假体对骨盆结构和力学功能进行重建,可大大提高患者的生存质量。郭卫课题组设计的3D技术定制骶骨、髂骨假体,表面具有多孔结构,允许骨细胞长入,实现长期稳定性,目前该盆骨重建技术已达到国际先进水平[34]。

图2 3D打印骶骨假体[35]Fig.2 3D printed sacrum prosthesis
2015年,郭卫教授开创先河,采用3D技术高级定制人工全骶骨假体(见图2),为一名62岁复发性骶骨脊索瘤的病人进行治疗[35],术后1年病人可以拄拐进行短距离行走,没有疼痛或机械不稳等现象。研究回顾分析了2013年7月—2015年12月,在北京大学人民医院接受骨盆肿瘤切除后应用3D打印骨盆假体重建的35例患者病历资料:其中3例患者使用3D打印髂关节假体,12例使用3D打印标准半盆骨假体,20例使用3D打印钉-棒半骨盆假体(见图3);术后随访20.5个月(6~30个月),无肿瘤生存25例,带瘤生存5例,5例由于肿瘤转移而死亡。采用MSTS-93(Musculoskeletal Tumor Society 93)评分,30例存活患者末次随访平均得分19.1(9~26),3例髂骨假体重建患者平均得分22.7(20~25),12例标准半骨盆假体重建患者平均得分19.8(15~26),15例钉-棒半骨盆假体重建患者平均得分17.7(9~25)。术后并发症,包括7例切口延迟愈合、2例髋关节脱位。短期随访结果表明,3D打印技术制造骨盆假体,有利于假体与截骨面的精确匹配及骨长入,可以促进种植体与宿主骨的精确匹配和骨整合[36-37]。
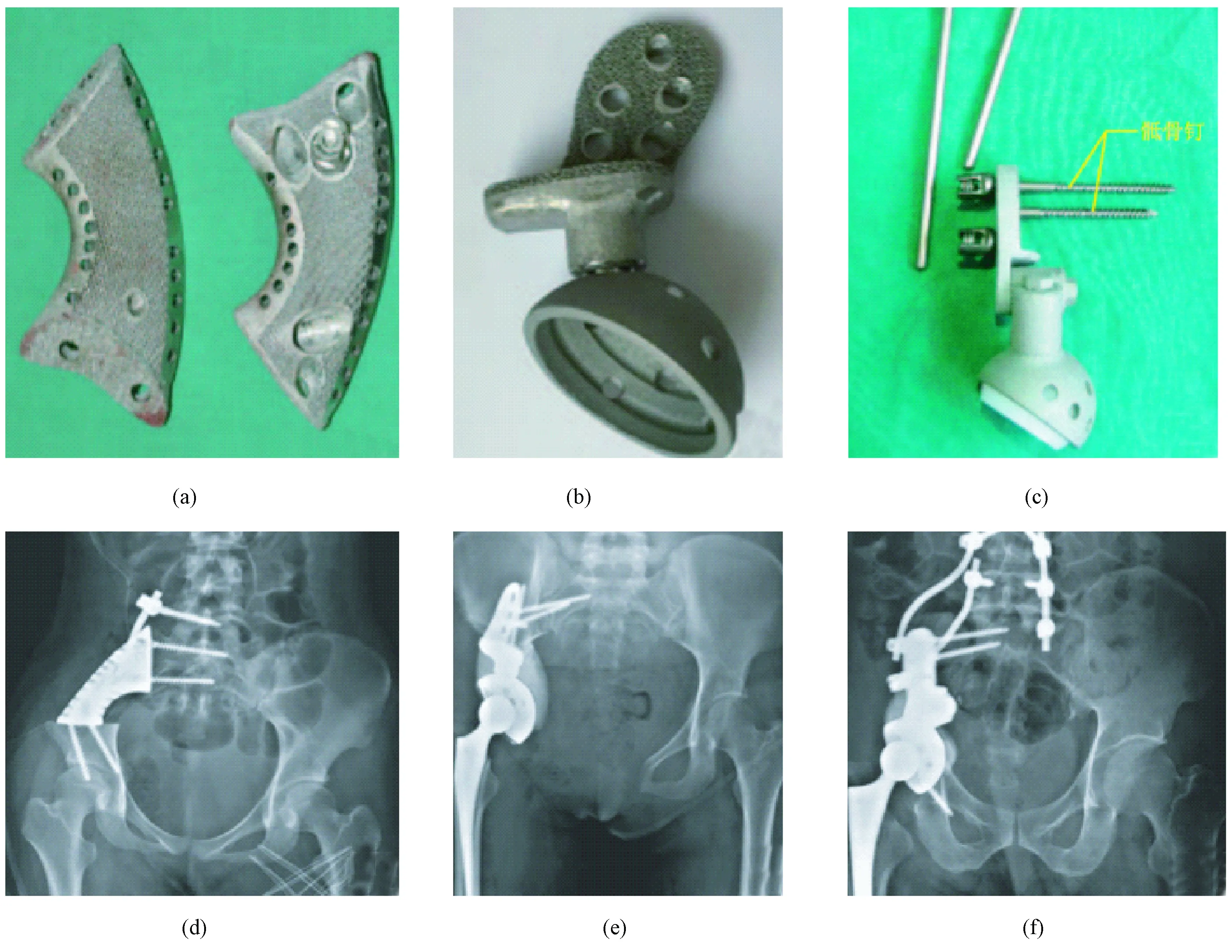
图3 3D打印骨盆假体[37]。(a) 3D打印髂骨假体;(b) 3D打印标准半骨盆假体;(c) 3D打印钉-棒半骨盆假体;(d)~(f)分别为术后2周(a)~(c)3种假体植入后的骨盆正位X线片,显示假体位置良好Fig.3 3D printed pelvic prosthesis[37]. (a) 3D printed Ilium prosthesis; (b) 3D printed standard hemipelvic prosthesis; (c) 3D printed nail-stick hemipelvic prosthesis; (d)~(f) 2 weeks post-operative X-ray photography after pelvic reconstruction with type (a)~(c) hemipelvic prosthesis, respectively, showing the prosthesis in good position.
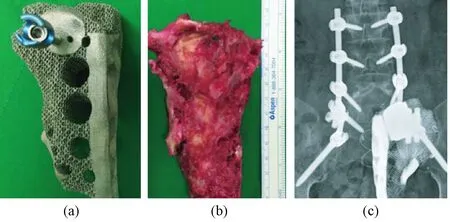
图4 3D定制钛骶骨假体[38]。(a) 3D定制钛骶骨假体多孔结构,螺钉固定部位和接触部位为实心结构;(b)病人整体切除的左侧骶骨,与打印的假体形状大小一致;(c)术后一周X光片显示完整的腰骶结构Fig.4 Custom-made 3D-printed hemisacral prosthesis. (a) Custom-made 3D-printed hemisacral construct with a specific porous titanium structure. The screw hole and contact surfaces were made with high-density structure; (b) The left sacrum was excised with en bloc resection. The shape and size of the implant were the same as the resected mass; (c) Anterior-posterior X-ray at postoperative 1 week demonstrates a complete lumbosacral construct.
Kim等报道了一例骶骨半切除手术采用3D打印钛假体进行重建的病例[38]。16岁女性患者左侧骶骨周围有软骨成骨肉瘤,化疗3个月后实施半切除术,保留了对侧骶神经,并使用3D打印定制钛骶骨假体进行植入重建(见图4)。术后患者疼痛明显降低,术后2周恢复良好,可行走,仅左侧足下垂,无括约肌功能丧失。随访1年,发现骨融合良好。
在脊柱治疗领域,2014年刘忠军团队完成首例3D打印人工定制枢椎进行脊椎肿瘤治疗的手术[39]。该患者患有枢椎尤文氏肉瘤,解剖部位邻近脊髓、神经、重要血管和头颅基底结构,手术难度大。传统手段是采用钛笼加外固定,治疗稳定性差。3D打印的定制枢椎完全模拟枢椎复杂形态,增加接触面积,大大提高了稳定性,为患者提供了更好的生存质量。Wen等报道,一名14岁女性因脊柱的原发性骨肿瘤,造成椎体矢状位及冠状位畸形,并有进展性椎间盘突出和T9椎体的病理骨折,手术切除后采用3D打印定制的钛椎间融合器进行治疗[40]。Kevin等报道了一例采用3D打印钛定制椎间融合器(见图5)治疗颈椎病变的病例[41]。一位65岁女性患者颈椎C1/C2小关节病变,伴有骨赘形成并挤压C2神经根。她枕部神经疼痛在VAS视觉模拟评分法(visual analogue scale/score)上为8/10,术后改善为3/10。
四肢为骨肿瘤多发部位[42],因此3D打印钛金属假体在四肢骨缺损方面也有很大的应用空间,尤其是关节部位。Luo等报道了吉林省二院采用EBM 3D打印技术设计制作钛合金胫骨块(见图6),治疗胫骨近端的骨巨细胞瘤(GCT),用于肿瘤切除后填补骨缺损[43]。该定制的胫骨块结合了标准的膝关节假体,同时为膝关节副韧带提供了附着点,以保持膝关节的稳定性。在平均7个月的随访后,4例患者的MSTS得分平均为19分,膝关节活动范围平均为90°,膝关节软组织平衡及稳定性良好,未现假体骨折、松动或其他相关的并发症。

图5 3D打印定钛制C1/2节段椎间融合器[41]Fig.5 Application of a 3D custom printed patient specific spinal implant for C1/2 arthrodesis[41]
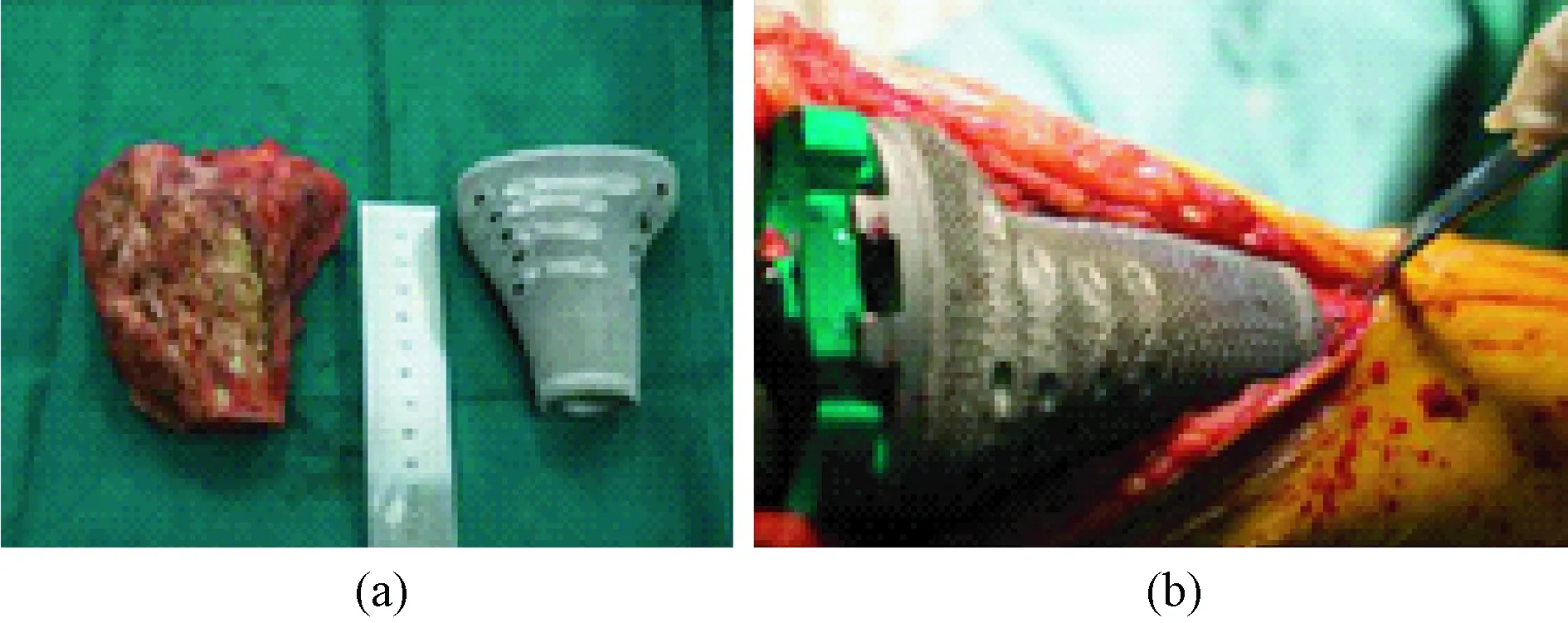
图6 3D打印钛胫骨块[43]。 (a)3D打印钛合金胫骨块与切除的骨肿瘤;(b)术中植入情况Fig.6 3D printed titanium tibia block[43]. (a) 3D printed titanium tibia block with resected bone tumor; (b) Block in implantation
以上案例表明,3D打印钛金属假体,能够有效对骨肿瘤切除后的骨组织进行修补,并帮助功能重建。除此之外,3D打印定制钛金属假体,在关节置换以及复杂关节翻修术领域也得到了临床医生的认可。
李慧武课题组对上海九院采用3D打印进行髋关节翻修的临床应用病例进行了回顾分析:2003年—2013年,对26名Paprosky IIIB髋臼缺损的患者采用3D打印定制钛合金髋臼杯(见图7)进行严重髋臼骨缺损翻修术[44],平均随访67个月(24~1 220个月),Harris评分从术前36(20~49)提高至82(60~96),并且具有良好的机械稳定性。在该临床研究中,有一例疑似臀上神经损伤,可能是由于产品尺寸较大,在精确植入时需要大量暴露髂骨,所以会损伤臀上神经,进而增加髋关节脱位的风险。对2005年10月—2011年9月的病例回顾分析,在平均随访的3.6年(1~9年)时间内,患者的Harris评分从术前36(22~56)提高至85(60~96),1例可能松动,其余病例无明显松动或骨溶解。1例患者术后4天髋关节屈曲超过90°时脱位[45]。
Carl等对某医院2003年8月—2012年2月实施的24例髋关节3D打印定制式植入物翻修手术进行了回顾分析[46]:2年左右(28~108个月)的随访时间内,有2例败血症继发失败,1例假体周围股骨骨折的主干翻修和1例切开复位内固定;但所有假体都是固定的,没有观察到明显的移位或松动;Harris髋关节评分从42±16提高至65±18(P<0.001)。

图8 3D打印定制化多孔钛关节盂填充块[47]。(a)3D打印定制化多孔钛金属填充植入物实体;(b)术后两年随访的X光片显示假体固定良好Fig.8 3D printed custom-made porous titanium glenoid cavity block[47]. (a) The 3D-printed custom-made metal backing with porous structure filling the bone defect; (b) 1 year follow-up show a fully stable glenoid component
3D打印钛金属植入物在肩关节个性化治疗上也有报道,用于治疗一位56岁的女性全肩关节置换12年后的严重肩关节盂缺损。由于关节窝龙骨突的深入,关节窝几乎完全被破坏,因此利用3D打印技术开发了一种定制的关节盂填充假体(见图8),并在2.5年的随访中取得了良好的效果[47]。Han等对3D打印钛合金腕关节假体治疗严重和复杂的手腕创伤进行了研究,结果表明3例3D打印腕关节均术后恢复正常解剖及部分功能重建,1年随访2例患者的Gartland和Werle腕关节评分下降65.21%,1例下降至5%,表明患者疼痛得到缓解,功能得到恢复,证明在治疗腕关节创伤方面3D定制比传统融合术提供了更好的解剖和功能恢复[48]。
这些临床报道表明,3D打印定制式钛金属骨科植入物具有较好的初期稳定性,能够有效地修复骨缺损,帮助机体进行功能性重建。由于目前3D打印技术是一项新兴的技术,长期的植入效果有待更长时间和更多病例的进一步验证。
5 存在的问题
由于3D打印钛金属骨科植入物的生物学和力学的适配优势,在临床上呈现应用广泛的趋势。然而,作为医疗器械制造领域的新兴技术,从设计到临床应用,3D打印制备的植入物与传统减材制造产品存在很大的区别,涉及了患者的图像采集和处理、植入物的设计、力学评估、生产制造、手术植入等过程,这些步骤可能导致不可察觉的错误,进而影响产品的性能,对患者的安全产生风险。以下从制造工艺、医工交互以及临床应用三个方面,对目前3D打印钛金属骨科植入物可能存在的问题,也是3D打印金属植入物面临的共性问题进行讨论。
5.1 制造工艺
1)各向异性。3D打印过程中采用的热源能量大小、扫描线之间的距离均对产品的力学性能造成一定的影响[49],可以通过调整扫描线的间距控制钛合金的孔隙率来调整产品性能[50]。由于3D打印制造加工过程是由点到线、再由面到体的逐渐融化凝固,因此产品的成型存在一定的方向性,水平方向和垂直方向的微观组织具有明显的差异性[51],这种取向性导致力学性能、腐蚀性能的各向异性,垂直堆积方向比沿堆积方向的力学强度更大,而在Hank′s溶液里的耐蚀性较低[52],因此应该对材料和工艺的力学性能进行验证[53]。
2)阶梯效应。3D打印骨科钛合金植入物会存在阶梯效应,尤其是在曲线和倾斜面上更为显著,这种效应会影响3D打印部件的表面质量和粗糙度[53],导致该问题的原因可能是CT图像的切片厚度、部件的构建方向、3D打印机的堆积层厚度以及自由形状。通过改变CT协议、调整3D打印机设置以及优化模型,可以最大限度地减少阶梯效应[54]。
3)产品缺陷。产品缺陷与打印参数存在着相关性,能量过高会使产品过度融化产生缺陷,而能量较低则会产生未熔点,形成空洞和残余粉末[55-56],如图9所示。如果初始粉末中的气体被困在熔池中,也会形成残余孔隙[50]。打印过程中的局部加热和冷却会产生不均匀的热膨胀和收缩,导致残余热应力分布复杂,产品结构可能会发生变形[57]。这些缺陷的存在会促使裂纹的产生,并且降低产品的力学以及疲劳性能。
4)材料的回收。在3D打印过程中,剩余粉末是可以参与回收利用的。研究21次和7次循环利用的钛合金粉末,其氧含量随重复使用次数增加而增加,球形度降低,表面粗糙度增加,卫星颗粒会减少,流动性有改善,且重复使用粉末制造的产品的拉伸强度并没有受到不良影响(见图10)[58-59]。但是,回收次数对骨科植入产品的塑性和疲劳性能会有不良影响,因此粉末材料的粒度和形状必须遵循严格的规范,以保证获得高质量的零件和一致的机械性能。

图9 3D打印Ti-6Al-4V部件中未熔融粉末的扫描电镜照片[56]。(a) SLM; (b) EMBFig.9 SEM micrographs of unmelted powders in 3D printing Ti-6Al-4V samples[56]. (a) SLM; (b) EMB

图10 循环利用的Ti-6Al-4V粉末的形貌扫描电镜照片[58]。(a)~(c)为分别重复使用2、11、21次时的Ti-6Al-4V粉末扫描电镜照片;(d)~(f)为左侧对应的局部放大电镜照片Fig.10 Morphology and surface features of reused Ti-6Al-4V powder[58]. (a)~(c)Ti-6Al-4V powder reused twice,11 times and 21 times, respectively; (d)~(f) are higher magnification views corresponding to the left-hand side micrographs
5.2 医工交互
3D打印产品尤其是定制化产品,中间涉及大量医工交互的环节,如何保证设计、开发和输入、输出每个环节的通畅,是医生、工程师和生产企业共同面临的问题。
1)3D打印定制式假体的临床应用门槛有待建立。应由有丰富临床经验的骨科医生提出需求,由有足够3D打印假体制造经验的制造商研制,对假体的医疗应用机构级别应有要求等。
2)3D打印定制式假体的基础研究不足。由于定制式假体面向的是罕见、复杂的病情,因此医生面对病人多是考虑临床救命优先,但前期的力学验证等方面的研究还需加强。
3)3D打印定制式医疗器械产品的设计开发有不定型的部分。在目前没有成熟的生物力学等效模型建立的前提下,如何把控该变异性带来的风险需要考量。
5.3 临床研究
3D打印作为一种新兴的技术,其制作的假体临床应用时间较短。目前世界上临床使用报道中,随访时间最长的3D打印骨科植入物病例为2007年首位采用3D打印髋臼杯的患者,在2018年的随访中表示假体10年的使用状况(包括屈膝活动等)良好[12]。同时,由于其定制化设计的特点,面向罕见、复杂病患,不能按照严格的随机对照试验进行临床评价,病患随访研究也不够充足,缺乏长期的循证医学证据[59]。建议采用条件式审批的决策思路,研究定制式产品设计开发的变异性,加强上市后的临床研究,以动态追踪产品的风险/受益比[60]。
6 标准和法规
近年来,为了满足精准医疗、健康医疗的需求,利用3D打印成型技术制作具有个性化设计特点的医疗器械的研究越来越多。然而,其成型工艺、结构特征和使用形式有别于传统工艺生产的材料和器械,3D打印材料和植入器械产品的标准以及技术审评在方法、程序、关键点上也与传统医疗器械不同,难以用以往的经验和方法来评价产品的质量,难以判断产品的风险高低和是否安全有效,这给行业产品的研发设计、监管部门的监督管理带来了一定的困难。
目前针对3D打印技术的标准,国际上有ISO 17296和ASTM52900增材制造通用规则系列,国内有GB/T34508—2017《粉末电子束增材制造TC4合金材料》、YS/T 1139—2016《增材制造TC4钛合金蜂窝结构零件》。但是,针对生物医用领域的3D打印标准尚处于空白,亟待完善[61]。2016年5月美国FDA首次发布3D打印医疗器材指引草案,2017年12月4日公告了3D打印医疗器械制造指导意见(TechnicalConsiderationsforAdditiveManufacturedMedicalDevices),包含设备设计、功能、产品耐久性测试及质量要求等3D打印医疗产品制造技术指导,以保证3D打印医疗器械的安全有效,并加速其上市进程。
我国也在积极推动3D打印在生物医用领域的发展,国务院、科技部、工信部等政府部门发布《中国制造2025》《十三五国家科技创新规划》《增材制造产业发展行动计划2017—2020年》等一系列文件,支持3D打印技术的发展。中国食品药品检定研究院医疗器械标准管理研究所、天津市医疗器械质量监督检验中心正在积极推动3D打印植入物相关标准的制定工作,目前已立项的两项行业标准《用于增材制造的医用Ti-6Al-4V粉末》《增材制造医疗产品3D打印钛合金植入物金属离子析出评价方法》正在逐步推进中,2019年拟立项《3D打印多孔结构形貌分析测试方法》。国家食品药品监督管理总局医疗器械技术审评中心开展了对3D打印医疗产品管理模式的研究,对我国3D打印增材制造质量体系的研究情况、定制式医疗器械临床的研究情况进行实地调研,了解行业实际需求和科研能力、制造性能。同时,研究美国FDA、欧盟、加拿大、韩国等多个国家和区域对于增材制造加工的定制式医疗器械的监管和相关政策,为我国医疗器械监管和标准化制定提供一定的参考,并于2018年2月26日公布了《定制式增材制造医疗器械注册技术审查指导原则》(征求意见稿)。国家药品监督管理局于2018年9月29日公布了《定制式医疗器械监督管理规定(试行)》(征求意见稿),规范定制式医疗器械的注册监督管理,推动国内3D打印医疗器械的临床应用和上市流通。
这些相关法规、标准和审评指导原则的建立,将促进国家医疗器械产业健康发展,为科学监管提供重要支撑,极大地推动我国3D打印植入器械产业的进程,提高国产器械在国际竞争中的地位。
7 总结与展望
根据全球第二大数据研究公司Marketsand Markets发布的关于3D打印医疗设备、技术、医疗产品的2020年市场预测报告,预计3D医疗产品到2020年将达到21.3亿美元;同时,影像技术、临床医学、计算机技术、材料科学以及机械设计等相关学科的发展,会进一步推动3D打印技术在生物医用行业快速发展。
3D打印钛金属骨科植入物是3D技术在生物医用行业发展最快速、应用最广泛、临床转化最多的一个领域。近年来,在国家科技发展计划的有力支持以及政府的科学监管下,我国3D打印钛金属骨科植入物的研究方向与国际发展趋势同步,部分研究成果达到了世界领先水平,未来的发展前途更是不可限量。结合目前的研究现状,3D打印钛金属骨科植入物可能的研究方向有以下几点:
1)新的粉末材料的研发和制备。现有临床应用的的打印钛金属粉末局限于纯钛和Ti6Al4V粉末,开发新型的钛合金粉末原料、进一步优化粉末性能势在必行。
2)复合材料以及活性物质的混合打印,钛金属本身并没有生物活性,仅仅起到一个细胞攀爬的支架作用,为了更好地促进骨组织修复,可以将模量更低、可降解以及具有生物活性的材料与钛金属进行复合打印,综合各种材料的优良性能,不仅被动地修复,更能主动地出击治疗和预防疾病。
3)打印设备的升级换代。3D打印技术飞速发展,新理论、新结构、新材料的出现,需要对现在有设备进行优化,以便同时打印理化性能不同的材料,制造性能更优异、结构更复杂的新产品。
4)仿生结构以及等效力学模型的构建。外形匹配是3D打印钛金属植入物最基本的能力,而生物力学的匹配和生物功能的匹配才是临床应用的最终目的。除了微观结构模拟骨小梁促进骨细胞的长入,保证假体的长期稳定,还可以基于有限元分析等手段,对微观和宏观结构进行生物力学分析,制造加工出促进骨组织重建以及人体力学功能恢复的架体结构。
5)3D定制式植入物质量体系特殊要求的建立。3D打印定制式的钛金属骨科植入物的生产制造有别于传统规格化的产品,涉及信息采集、传递、医工交互等很多特殊工序,根据《定制式医疗器械监督管理规定(试行)》(征求意见稿)的要求,定制式产品采用备案管理,企业对定制式医疗器械应该建立相应的质量体系特殊要求,以控制产品的安全性和有效性。
6)在发展技术的同时,完善配套的检测评价方法,建立相关标准、法规和审评规范,指引我国3D打印植入器械产业的健康发展。

