基于生物信息学方法预测野葛中的miRNA及其靶基因△
姚怡玮,徐静,杨萌,李燕呢,何美军,郭坤元,吴斌*
1.中草药物质基础与资源利用教育部重点实验室/中国医学科学院北京协和医学院 药用植物研究所,北京 100193;2.北京市海淀区植物组织培养技术实验室,北京 100091;3.湖北省农业科学院 中药材研究所,湖北 恩施 445000
野葛Puerarialobata(Willd.)Ohwi.为豆科Leguminosae葛属Pueraria多年生木质藤本植物,是一种大宗重要中药材,于2002年被国家卫生部认定为药食两用植物。野葛以其干燥根入药,称为葛根[1],具有提高大脑记忆能力、改善和治疗心脑血管疾病、抗肿瘤、保肝、消炎镇痛等功效[2-3],其主要生物活性成分为异黄酮类物质[4]。此外,野葛还富含淀粉、膳食纤维以及人体必需的多种氨基酸、矿物质和微量元素,在保健品开发方面具有不错的市场前景。近些年大量研究者对于野葛的化学成分[5]、药理作用[6]、代谢途径解析及关键酶基因[7]方面进行了研究。
microRNA(miRNA)是一类由内源基因产生的、长度约为20~24 nt的非编码RNA。在植物中,miRNA通常来自于含有茎-环结构的初级转录物(pre-miRNA),接着在Dicer等一系列酶的作用下产生成熟的miRNA[8-9]。miRNA主要通过切割靶基因或者抑制其翻译在转录后水平调节基因表达,从而在植物组织形态建成[10]、抗病[11]、非生物胁迫[11]、次生代谢产物合成[12]等方面起到了重要作用。然而迄今,在野葛上未见报道。
由于植物中miRNA在序列上具有高度保守性[13],除了高通量测序结合计算机分析鉴定[14],也可以利用生物信息学方法预测其保守miRNA[15]。即从miRBase下载已知的miRNA,将其与所研究的物种转录组数据比对,然后将比对上的转录本进行二级结构折叠,再根据miRNA的判定标准进行筛选,该方法被广泛用于植物miRNA的鉴定[16-17],在一些药用植物,比如毛地黄[18]、甘草[19]、黄芪[20]中有过报道。本研究首次预测了野葛中保守miRNA及其靶基因,为今后解析miRNA在野葛防御反应、次生代谢产物合成等方面的作用奠定了基础。
1 材料
于湖北省恩施州华中药用植物园试验基地采集2年生野葛P.lobata的根、茎和叶,冻于液氮中,然后保存在-80 ℃冰箱用于RNA的提取。
2 方法
2.1 已知植物miRNA序列的获得
从miRBase(http://www.mirbase.org/)中下载全部miRNA序列(版本22),作为预测野葛中保守miRNA的参考序列。
2.2 野葛转录组数据及注释文件的获得
从GitHub(https://github.com/rongchunhan/Pueraria_lobata/commits/master/Pueraria_lobata_contigs.fa)下载野葛的转录组序列和注释信息,该序列是Han等测得[6],由不同组织(叶、茎、幼嫩根、成熟根、根维管束)的测序数据混合拼接得来。
2.3 野葛miRNA的生物信息学预测
利用psRobot软件[21]的前体预测模块“psRobot-mir”,将上述miRNA序列与转录组拼接数据进行比对,采用默认参数,输入文件格式均为fasta格式。psRobot内置mfold 3.5软件(http://www.bioinfo. rpi.edu/applications/mfold/rna/form1.cgi)能够预测并给出候选miRNA前体的二级结构和成熟的miRNA序列[22]。接着对候选的miRNA进行人工核实,参考Meyers等判定miRNA的标准[23],略作修改,具体如下:1)预测的野葛miRNA前体能够折叠成发夹状的二级结构;2)成熟的miRNA与另一条臂上的互补序列不超过5个碱基的错配;3)miRNA与另一条臂上的互补序列不超过3个bug;4)当两条以上的miRNA序列同时比对上同一前体时,本研究以miRBase中大豆Glycinemax或者苜蓿Medicagotruncatula同家族miRNA的序列作为参照。
2.4 茎-环PCR验证miRNA的真实性
用天根公司多糖多酚植物miRNA提取分离试剂盒(DP504)提取植物总RNA,具体操作参照说明书进行。提取野葛幼苗根的总RNA,并使用Nano DropTM2000分光光度计和1.2%琼脂糖凝胶电泳检测RNA的浓度、纯度和完整性。
miRNA的检测采用茎-环PCR法。随机选取7条miRNA,分别设计反转录茎-环引物及PCR引物(见表1),利用荧光定量PCR法验证miRNA的真实性。
2.4.1 第一链反转录 首先配制无RNA混合物,将4 μL 2.5 mmol·L-1dNTP、7.75 μL ddH2O、1 μL RT引物(1 μmol·L-1)在65 ℃放置5 min,接着迅速冰置2 min,接着添加4 μL 5x First-Strand缓冲液,2 μL 0.1 mol·L-1DTT,0.25 μL M-MLV(200单位/μL),1 μL RNA模板,然后执行反转录程序:16 ℃ 30 min,60个循环的30 ℃ 30 s,42 ℃ 30 s,50 ℃ 1 s,75 ℃ 5 min,反转录产物作为荧光定量PCR的模板。

表1 miRNA反转录茎-环引物及PCR引物
2.4.2 荧光定量PCR 在PCR管中加入:10 μL 2x SYBR Premix Ex Taq II(TaKaRa,Japan),1 μL通用反向引物(5 μmol·L-1),1 μL miRNA特异的正向引物(5 μmol·L-1),1 μL 上述反转录产物,7 μL H2O。使用Bio-Rad CFX96实时PCR系统C1000热循环仪(Bio-Rad,USA)进行扩增。程序如下:94 ℃ 2 min,95 ℃ 20 s,45个循环94 ℃ 10 s,60 ℃ 10 s,72 ℃ 6 s。
2.5 野葛miRNA的靶基因预测
使用在线软件psRNATarget[24],采用默认参数对野葛miRNA的靶基因进行预测,通过罚分机制筛选潜在靶基因,规则为:U与G配对罚0.5分,其他不匹配罚1分;小于3个碱基插入或缺失罚2分,3个碱基及以上罚3分。为了保证靶基因的真实性,本研究选择罚分≤3的结果作为miRNA的潜在靶基因。
3 结果与分析
3.1 野葛miRNA预测结果及其二级结构
使用psRobot软件“psRobot-mir”模块共筛选出27条候选miRNA前体,手工核实发现符合标准的共有25条,其中有9条前体产生2条miRNA,其余分别产生1条miRNA。最终在野葛中共预测出34条miRNA,它们属于18个家族。这些miRNA的长度范围为19~24 bp,见表2。

表2 野葛中预测的miRNA

续表2
注:*表示最小自由能折叠指数。
通常情况下,植物miRNA前体在长度和二级结构上存在多样性[25]。在筛选过程中,笔者发现预测的野葛miRNA前体的长度变化相对较大,在90~203 bp;虽然其前体的长度和二级结构变化较大,但都能折叠成茎-环结构(见图1)。
预测出的25条野葛miRNA前体的MFEI值范围为0.64~1.20,平均为0.97(见表2),其中大多数符合miRNA前体二级结构稳定性要求(MFEI大于0.8)[26]。
3.2 野葛miRNA真实性验证
为了验证预测的miRNA真实性,本研究随机选取7条miRNA,通过茎-环实时荧光定量PCR进行实验验证。结果显示这7条miRNA荧光定量PCR扩增产物的熔解曲线均为单峰。随后进行琼脂糖凝胶电泳,均出现明显单一条带,大小约为60 bp(见图2),与预期茎-环PCR扩增的大小相一致,从而验证这些miRNA的真实性。

图1 部分野葛miRNA前体二级结构图
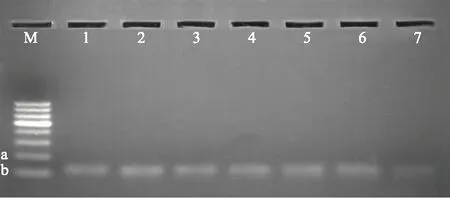
注:M.50 bp DNA Maker(a.100 bp、b.50 bp);1.miR156c-5p;2.miR166-5p;3.miR167-5p;4.miR168-3p;5.miR396b-5p;6.miR1507-3p;7.miR2089a/b-3p。图2 miRNA茎-环引物PCR产物电泳图
3.3 野葛miRNA靶基因预测结果及主要功能分析
根据预测出的34条野葛miRNA序列,通过在线psRNATarget软件预测出235个靶基因,其中有66个有明确的功能,见表3。这些靶基因中有28个是抗病蛋白,其余则主要参与了野葛体内转录调节、信号转导、物质运输、防御反应等多种生物学过程。在这66个有明确功能的靶基因中,有的在不同科植物间高度保守,例如受miR156调控的SPL基因,其广泛存在于许多科的植物中,是调控植物生长发育的重要转录因子[27];miR162靶向DCL,在多科植物中有过报道,其能够特异性地剪切双链RNA并且自身也被miRNA靶向形成反馈调节[28-30];还有的在同科植物中保守,例如本研究发现在豆科植物大豆和苜蓿中都找到miRNA1507靶向含有NBS的抗性蛋白[31-32];其余的靶基因均为非保守。

表3 野葛中预测miRNA的靶基因及其编码蛋白

续表3
续表3
4 讨论
本研究在野葛中共鉴定出34条保守miRNA,预测出66个具有明确功能的靶基因,其中28个为抗病蛋白。在植物抗病防御中,具有核苷酸结合位点(NBS)的抗病基因被用于植物抗病基因识别和分类[33]。本研究预测到野葛的大部分抗病基因也包含这个特征。在野葛同科植物大豆中有报道miRNA负调控NBS抗病基因。在最近的研究中,哈达等在研究大豆花叶病毒病(SMV)时发现SMV可以通过诱导大豆中miR1507a、miR1507c、miR482a、miR168a和miR1515a的积累,下调NBS-LRR家族抗性基因来抑制大豆的防御反应。在抑制上述5个miRNA表达后,SMV在大豆中的感染率有明显下降[32]。在野葛中,miR1507-3p被发现是与大豆miR1507a相同的保守miRNA,且其被预测的靶基因均为抗病相关基因。而在豆科植物苜蓿中,Zhai等[34]发现miRNA通过产生反式作用干扰小RAN(siRNA)负调控NB-LRR基因。这些结果为揭示野葛抗病的分子机制奠定了基础。
还有研究表明,食物中的外源植物miRNA可以调节哺乳动物中靶基因的表达:在稻米中发现含量丰富的168a,被人食用后能够减缓低密度脂蛋白从血浆中清除的速度,从而使食用者更易得高血脂、糖尿病等代谢疾病[35]。本研究在野葛中发现miR1514靶向Aladin蛋白质。目前已知编码该蛋白的AAAS基因突变是导致三A综合征的原因[36]。这一发现也暗示了miRNA可以跨界行使功能。
在世界范围内,野葛主要分布于东亚及东南亚地区;在我国除青海、西藏等少数几个省、自治区外,大部分省、自治区都有分布[37-38]。近年来随着野葛需求量越来越大,现有的野生种质资源可能难以满足日益增长的需求。解析野葛抗病的分子机制一方面有利于野葛栽培,提高其产量和品质;另一方面,野葛主要活性成分为异黄酮类、萜类、生物碱类等次生代谢产物。植物次生代谢及其调控是植物生长或进化过程中出现的对外界环境改变的适应,包括抵御一些环境胁迫和病虫害。本研究预测得到的miRNA的靶基因中以抗病基因居多,关注野葛抗病基因为后续深入了解野葛miRNA的生物学功能,特别是在次生代谢中的作用奠定基础。
本研究采用psRobot软件进行了miRNA预测;以前采用BLAST或者soap程序将miRNA和转录组序列进行比对,然后将比对上的转录组序列用二级结构预测软件进行折叠,再根据miRNA的标准进行筛选;相较于以前方法,本操作更加快捷、方便,psRobot内置二级结构折叠软件mfold3.5在预测miRNA时可以同时输出前体二级结构折叠和成熟的miRNA序列。
随着高通量测序技术的发展,测序小RNA并结合生物信息学分析已经成为鉴定miRNA的主要手段。目前已经在红豆杉[39]、人参[40]等药用植物中得到应用。今后笔者将使用高通量测序野葛的小RNA数据,进一步预测其特异的miRNA和siRNA,并进行实验验证,使结果更加丰富可靠,为深入研究野葛中小RNA的功能奠定基础。

