一株瘤胃源产纤维素酶菌株的筛选、鉴定及其酶学特性研究
张庆芳,王泽坤,姜 南,于 爽,迟乃玉*
(1.大连大学 生命科学与技术学院,辽宁 大连 116622;辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
纤维素(cellulose)约占整个植物干质量的50%,是植物细胞壁的主要成分[1-3]。纤维素作为一种可再生资源,在实际生产中利用率并不高。目前,纤维素的降解方法主要有物理法、化学法和生物酶法。其中传统的物理方法利用效率低,工艺条件难以控制;化学方法容易产生大量副产物,污染环境且成本高;近年来,随着生物酶解技术的发展和成熟,生物酶解已成为研究者的研究热点[4-5],而生物酶法绿色环保,反应条件温和,不产生大量有毒物质,且效率高[6-8]。因此,选择高产纤维素酶菌株以增加纤维素的利用率具有十分重要的意义[5]。
反刍动物瘤胃液中的微生物能够分泌纤维素酶并降解纤维素[9-10],国外关于瘤胃细菌的研究较多,而我国对这方面的研究相对较少。LEE S M等[11]研究发现,稻秸青贮时添加纯培养瘤胃真菌能够降低青贮饲料中性洗涤纤维和酸性洗涤纤维含量,提高青贮饲料粗纤维的降解率;朱雅新等[12]成功构建了荷斯坦奶牛瘤胃微生物元基因组BAC文库,并从BAC文库中筛选出16个具有淀粉酶活性和26个具有纤维素酶活性的阳性克隆;李昊[13]从奶牛瘤胃液中分离到21株兼性纤维素分解细菌。
西藏黄牛耐寒、耐低氧能力突出,且瘤胃中的微生物产纤维素酶的能力高[14-15]。因此,本研究从西藏黄牛瘤胃中筛选高产纤维素酶菌株,采用形态观察、生理生化试验及分子生物学技术对其进行鉴定,并对其所产的纤维素酶酶学特性进行研究,以期为纤维素酶制剂研制及益生菌制剂提供基础,从而促进西藏地区农牧业的发展。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
雌性黄牛:西藏娟姗纯种繁育示范基地,年龄为4.5岁。
1.1.2 试剂
羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)、酵母粉、胰蛋白胨、牛肉膏、MgSO4·7H2O、琼脂粉、氯化钠、KH2PO4、(NH4)2SO4、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、刚果红(均为分析纯):生物工程(上海)股份有限公司。
1.1.3 培养基
富集培养基:蛋白胨5 g/L,CMC-Na 10 g/L,KH2PO42 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 5 mg/L,NaCl 3 g/L,pH 7.0。
筛选培养基:CMC-Na 20g/L,(NH4)2SO42g/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,MnSO4·H2O 5 mg/L,NaCl 3 g/L,琼脂 15 g/L,pH7.0。
发酵培养基:蛋白胨2g/L,酵母膏1g/L,CMC-Na20g/L,KH2PO42 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 10 mg/L,(NH4)2SO42 g/L,MnSO4·H2O 5 mg/L,NaCl 3 g/L,pH自然。
以上培养基均在0.1 MPa、121℃条件下灭菌20 min。
1.2 仪器与设备
CRY-2112立式恒温摇床:上海茸研仪器有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;YXQ-75SII立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;CR21N高速冷冻离心机:株式会社日立制作所;Multiskan GO全波长酶标仪;美国赛默飞世尔科技公司;BioLogMicro Station III全自动微生物鉴定仪:美国Bio Log有限公司;DHG-9070电热恒温鼓干燥箱:上海一恒科技有限公司。
1.3 实验方法
1.3.1 黄牛瘤胃液样品的采集
使用聚氯乙烯(polyvinyl chloride,PVC)管在牛瘤胃的瘤胃囊中的不同位置提取牛瘤胃液样品。收集后立即将样品置于含有CO2的培养箱中,快速关闭。
1.3.2 富集培养
取1 mL西藏黄牛瘤胃液样品于9 mL液体富集培养基中,150 r/min、37℃条件下培养4 d。
1.3.3 纤维素酶产生菌的筛选
初筛:富集培养液经梯度(10-1、10-2、10-3、10-4、10-5、10-6、10-7)稀释后,取150 μL梯度稀释液涂布于筛选培养基平板上,每个梯度设置三组平行,37℃条件下倒置培养4 d。每个梯度选择一个平板用刚果红溶液染色20 min,染色后,弃掉刚果红染液并用1 mol/L NaCl脱色。如果在菌落周围产生透明圈,则可以初步证明该菌株是产纤维素酶的菌株。挑取产生透明圈的单菌落进行分离、纯化。
复筛:基于初级筛选菌株的透明圈大小,选取透明圈直径(D)与菌落直径(d)比值(D/d值)最大的菌株进行纤维素酶活力的测定。
1.3.4 纤维素酶活的测定方法[16]
葡萄糖标准曲线的绘制:取7支试管,分别加入质量浓度为2.0 mg/mL葡萄糖标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8mL、1.0mL、1.2mL,加蒸馏水至2.0mL,分别加入2.0 mL DNS后在沸水浴中加热2 min,迅速冷却,并加入蒸馏水至15 mL。混合后,使用分光光度计在波长540 nm处测定吸光度值(OD540nm值),以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线。葡萄糖标准曲线为y=3.291 8x+0.032 5,R2为0.995 3,线性关系良好,可用于纤维素酶活力的测定。。
粗酶液的制备:将筛选菌株接种于发酵培养基中,装液量为125 mL/250 mL,在37℃、150 r/min条件下培养2 d,作为种子培养液。按1%(V/V)的接种量将种子培养液接种于液体发酵培养基中,装液量为125 mL/250 mL,在37℃、150 r/min条件下培养3 d,每24 h取出一定量的发酵液,室温条件下4 000 r/min离心10 min,收集上清作为粗酶液。
纤维素酶活力的测定:取A和B两只试管,分别加入1.8 mL 1%CMC-Na,A管中添加0.2 mL粗酶液,将A和B管于50℃恒温水浴60 min,取出,分别加入2 mL DNS,B管中加入0.2 mL粗酶液,沸水浴10 min,快速冷却,加入蒸馏水补充至15 mL。采用分光光度计测定OD540nm值。
1.3.5 菌株的鉴定
形态观察:采用平板点样法获得单菌落,通过革兰氏染色的方法对菌体染色,镜检,观察菌体形态。
生理生化试验:通过Biolog微生物鉴定系统进行生理生化试验。
分子生物学鉴定:将复筛得到的高产纤维素酶菌株送交宝生物工程(大连)有限公司,对其16S rDNA进行测序,测序结果提交至美国国立生物技术信息中心(nationalcenter forbiotechnologyinformation,NCBI)的Genbank数据库中进行BLAST比对,利用MEGA5软件中的邻接(neighborjoining,NJ)法构建系统发育树。
1.3.6 纤维素酶酶学性质初步研究
温度对纤维素酶酶促反应的影响:粗酶液分别于10~100℃(梯度为5℃)、pH 7.0条件下进行酶促反应,测定不同反应温度下的纤维素酶活性,并以最大酶活力为100%,计算相对酶活。每个样品重复测定3次。
热稳定性:将反应体系分别在10~100℃(梯度为5℃)条件下保温2 h,快速冷却后,在37℃、pH 7.0条件下测定酶活力,并计算相对酶活。每个样品重复测定3次。
pH对纤维素酶酶促反应的影响:粗酶液分别在pH为3.0~10.0(梯度为0.5)、37℃条件下进行酶促反应,测定不同反应pH条件下的纤维素酶活性,并以最大酶活力为100%,计算相对酶活。每个样品重复测定3次。
pH稳定性:粗酶液在pH为3~10(梯度为0.5)、37℃条件下放置2 h,在37℃、pH 7.0条件下测定酶活力,并计算相对酶活。每个样品重复测定3次。
金属离子对纤维素酶活力的影响:反应体系中添加0.5 mmol/L不同种类的金属离子(K+、Mg2+、Fe2+、Zn2+、Cu2+、Ag2+、Co2+)后,在37 ℃、pH 7.0条件下测定酶活力,并计算相对酶活。每个样品重复测定3次。
2 结果与分析
2.1 菌株的筛选

表1 筛选菌株透明圈直径与菌落直径比值Table 1 Ratio of transparent circle diameter and colony diameter of screened strains

图1 菌株N30的产酶曲线Fig.1 Enzyme production curve of strain N30
通过初筛共筛选到7株产生透明圈的菌株,编号为N5、N7、N14、N18、N30、N36、N37,7株菌株的透明圈直径与菌落直径比值(D/d值)见表1。由表1可知,菌株N30的透明圈直径与菌落直径比值最大,为7。因此,选取菌株N30为目的菌株,对其纤维素酶活力进行测定,菌株N30的发酵产酶曲线如图1所示。由图1可知,菌株N30在发酵72 h时,纤维素酶活力最大,为15.6 U/mL,其他从西藏地区动物胃肠道中筛选得到的产纤维素酶菌株的酶活力大多在10 U/mL以内,该纤维素酶酶活与其他纤维素酶相比,酶活较高[17-18]。
2.2 菌株的鉴定
2.2.1 形态观察
菌株N30的菌落和细胞形态见图2。由图2a可知,菌落形态为淡黄色,半透明,光滑湿润,边缘整齐;由图2b可知,菌株N30呈棒状杆菌,染色后为紫色,属于革兰氏阳性菌。

图2 菌株N30的菌落形态(a)和细胞形态(b)Fig.2 Colony morphology(a)and cell morphology(b)of strain N30
2.2.2 生理生化试验
通过Biolog微生物鉴定系统共测定了菌株N30的103项生理生化特征,结果见表2。由表2可知,菌株N30的淀粉水解、柠檬酸盐和硝酸盐还原试验均为为阳性;可以利用48种碳源,如D-麦芽糖、D-海藻糖、D-纤维二糖等;易被氨曲南、溴酸钠、醋竹桃霉素、林肯霉素、万古霉素、萘啶酮酸等15种物质抑制生长。结果表明,菌株N13的生理生化特征与模式株类芽孢杆菌属(Paenibacillus)基本一致,因此,初步鉴定菌株N30为类芽孢杆菌属(Paenibacillus)。

表2 菌株N30的生理生化特征Table 2 Physiological and biochemical characteristics of strain N30
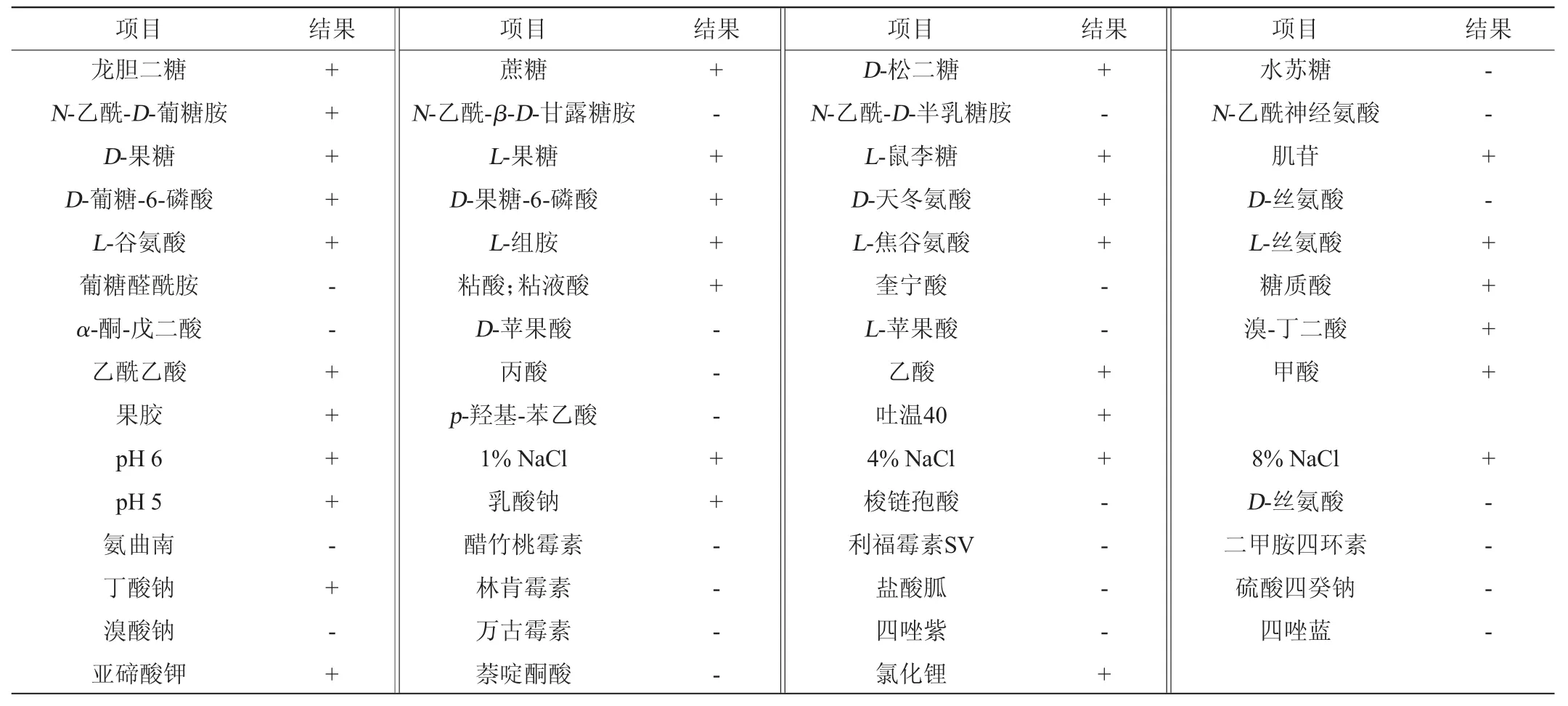
续表
2.2.3 分子生物学鉴定
利用软件MEGA5中的NJ法构建系统发育树,结果如图3所示。由图3可知,菌株N30与灿烂类芽孢杆菌(Paenibacillus lautus)N3-6聚于一支,同源性为99%。因此,结合菌株N30形态特征和生理生化特征,将其鉴定为灿烂类芽孢杆菌(Paenibacillus lautus)。

图3 基于16S rDNA序列菌株N30的系统发育树Fig.3 Phylogenetic tree of strain N30 based on 16S rDNA sequences
2.3 酶学特性
2.3.1 反应温度对纤维素酶酶促反应的影响
由图4可知,该纤维素酶的最适反应温度为55℃,且在40~65℃保持较高的酶活,相对酶活>80%;当温度超过65℃时,纤维素酶活力急剧下降;当温度为100℃时,相对酶活仅为9%。其他纤维素酶在25~45℃时保持50%以上酶活力,本研究中的纤维素酶相较于其他纤维素酶。最适温度较高,应用潜力更大[19]。

图4 反应温度对纤维素酶活力的影响Fig.4 Effect of reaction temperature on cellulase activity
2.3.2 纤维素酶的热稳定性
粗酶液的热稳定性试验结果见图5。
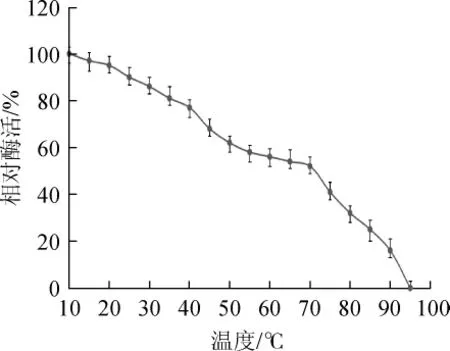
图5 纤维素酶的热稳定性Fig.5 Thermal stability of cellulase
由图5可知,该酶在10~35℃之间保持较高的酶活力,相对酶活>80%。当处理温度高于70℃后,相对酶活明显下降;在70~90℃时,相对酶活仍在10%以上;在95℃保温2 h后,纤维素酶失去活力。相较于其他纤维素酶(在45~55℃之间,相对酶活>80%),该酶温度稳定性相对较高[20]。
2.3.3 反应pH对纤维素酶酶促反应的影响
反应pH对纤维素酶酶促反应的影响结果见图6。

图6 反应pH值对纤维素酶活力的影响Fig.6 Effect of reaction pH value on cellulase activity
由图6可知,该酶最适反应pH值为4.5,同时该酶在pH 4.0~6.5时酶活较高;该酶在pH 7.0~9.0时仍保持60%的相对酶活,相较于其他纤维素酶最适pH无明显差别[21]。
2.3.4 纤维素酶的pH稳定性
菌株N30所产的纤维素酶的pH稳定性结果见图7。

图7 纤维素酶的pH稳定性Fig.7 pH stability of cellulase
由图7可知,该酶在pH 3.5~9.0时仍保持60%以上的相对酶活,其他纤维素酶在pH 4.0~5.5时保持60%以上相对酶活,本研究中的纤维素酶相较于其他纤维素酶,该酶具有较广的pH稳定性[22-23]。
2.3.5 金属离子对纤维素酶活力的影响
金属离子对纤维素酶活力的影响结果见图8。
由图8可知,Ag2+、K+、Mg2+、Fe2+、Zn2+、Co+对纤维素酶活力有显著的促进作用,而Cu2+对纤维素酶活力有抑制作用。
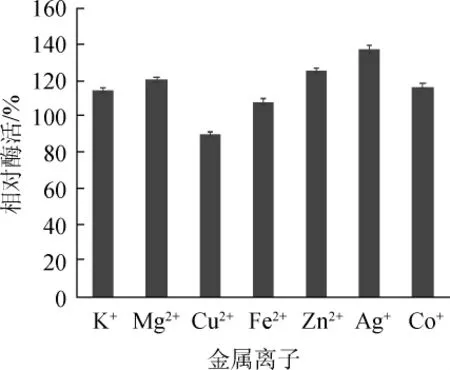
图8 金属离子对纤维素酶活力的影响Fig.8 Effect of metal ions on cellulase activity
3 结论
本研究从西藏黄牛瘤胃中筛选出一株高产纤维素酶的菌株N30,并通过形态观察、生理生化鉴定和分子生物学技术鉴定其为灿烂类芽孢杆菌(Paenibacillus lautus)。菌株N30在发酵72 h时,纤维素酶活力最高,为15.6 U/mL。该纤维素酶的最适反应温度为55℃,在10~35℃时保持较高的酶活力;最适pH为4.5,在pH 4.5时有最高的稳定性,在pH 3.5~9.0时仍保持60%以上的相对酶活力;Ag2+、K+、Mg2+、Fe2+、Zn2+、Co+对纤维素酶活力具有促进作用,而Cu2+对纤维素酶活力有抑制作用。
菌株N30来自于西藏黄牛瘤胃,与其他从西藏地区动物胃肠道中筛选得到的产纤维素酶菌株的酶活相比,酶活较高。并且较于其他纤维素酶,该酶在更宽的温度范围内保持较高酶活,温度稳定性和pH稳定性更高,因此,如将该菌株用作益生菌制剂的生产,应用至当地牧业,会有较强的当地适应性,效果更好,应用潜力更大,可为西藏地区的农牧业发展提供基础。

