水稻温敏型叶片白化转绿突变体tsa2的表型鉴定与基因定位
尚丽娜 陈新龙 米胜南 委 刚 王 玲 张雅怡 雷 霆 林永鑫 黄兰杰 朱美丹 王 楠
水稻温敏型叶片白化转绿突变体的表型鉴定与基因定位
尚丽娜**陈新龙**米胜南 委 刚 王 玲 张雅怡 雷 霆 林永鑫 黄兰杰 朱美丹 王 楠*
西南大学水稻研究所/ 西南大学农业科学研究院, 重庆 400715
水稻温敏型叶色突变体是研究植物光合作用、叶绿体结构和功能以及温度影响叶绿体发育的理想材料。利用甲基磺酸乙酯(EMS)诱变籼型水稻(L.)三系保持系西农1B, 从其后代中筛选到一个突变性状稳定遗传的温敏型叶片白化转绿突变体()。与野生型相比,突变表型受温度影响, 22°C条件下萌发的野生型幼苗表型正常, 而幼苗完全白化, 且约40%白化苗死亡, 存活白化苗的光合色素含量、光合速率均显著降低, 成熟期主要农艺性状均显著变劣; 在28°C下萌发的幼苗叶片呈浅绿色并伴有白条纹, 其光合色素含量显著降低, 光合速率及主要农艺性状差异较小; 32°C下萌发的幼苗叶片无明显差异。透射电镜观察显示, 与野生型相比,在22°C下叶肉细胞中无叶绿体或存在异常发育叶绿体(尚未分化出基粒和基层), 在28°C下部分叶肉细胞含少量发育完整的叶绿体, 在32°C下叶肉细胞数量及形态均正常。实时荧光定量PCR (qRT-PCR)分析表明, 与野生型相比,突变体中部分光合色素代谢途径基因、叶绿体发育相关基因及光合作用相关基因的表达水平呈不同程度变化。遗传分析表明,突变表型受一对隐性核基因控制,被定位于第5染色体SSR标记S5-57和S5-119之间, 物理距离为718 kb。本研究为水稻遗传改良及研究温度影响叶绿体发育机制奠定了基础。
水稻(L.); 温敏; 白化转绿; 叶绿体超微结构; 基因定位
叶色突变常表现为黄化、黄绿、浅绿、白化、条纹、白翠、斑马叶等多种类型[1]。叶色突变体是研究高等植物光合作用机制、叶绿体发育、叶绿体结构与功能以及光合色素生物合成与降解等方面的理想材料[2]。温敏型叶片白化转绿突变体白化表型受温度诱导, 在特定温度下可逐渐恢复绿色, 常被用作杂交育种中的标记性状。因此, 对水稻温敏型叶片白化转绿突变体的鉴定及基因定位有助于水稻的遗传改良, 也为研究叶绿体的发育机制提供线索。
近年来, 水稻中已克隆了一些白化转绿基因, 如()、()、-()、、、、和等[3-10], 其功能主要涉及光合色素代谢途径及叶绿体发育调控。基因()编码一个三角状五肽重复区(PPR)蛋白, 其突变体幼苗在低温下失绿, 随温度升高逐渐恢复绿色[3]; 基因()编码一个叶绿体蛋白合成延伸因子Tu, 是叶绿体发育相关基因, 突变体在三叶期为白化叶, 从四叶期逐渐转为淡绿叶[4]; 基因-()编码一个IMMUTANTS(IM)蛋白, 参与叶绿体电子传递链和光合色素的生物合成等途径, 突变体在三叶期之前完全白化, 随后转绿, 白化转绿表型受生长发育和温度调控[5]; 基因编码一个RNA特异性结合蛋白NUS1, 参与叶绿体RNA的代谢调控过程, 控制关键质体基因的表达时间, 功能缺失突变体在低温下叶绿体的翻译和转录能力受到严重抑制[6]; 基因编码一个新型鸟苷酸激酶(GK), 定位于质体及线粒体上, 参与叶绿体发育时期与细胞核之间的信号传输途径, 功能缺失突变体叶绿体不能正常分化[7]; 基因和分别编码核糖核酸还原酶(RNR)的大亚基RNRL1和小亚基RNRS1, RNR调节DNA合成和修复过程中脱氧核糖核苷酸的产生速率, RNR活性是叶绿体生物合成所必需[8]; 基因编码一个定位于叶绿体上的PPR蛋白,在三叶期之前为白化表型, 随后逐渐恢复正常叶色[9]; 基因编码一个定位在叶绿体上的磷酸核糖胺-甘氨酸连接酶, 参与嘌呤核苷酸的生物合成,突变体的白化叶片从苗期至成熟期逐渐转变为绿色[10]。
尽管如此, 目前关于水稻温敏型叶片白化转绿的分子机理尚不明确。本研究利用EMS诱变籼型三系保持系西农1B, 获得一个新的温敏型白化转绿突变体, 暂命名为, 并对该突变体进行不同温度下的表型分析、叶绿体超微结构观察以及相关基因表达分析等研究, 将定位于第5染色体短臂SSR分子标记S5-57和S5-119之间, 物理距离为718 kb, 为该基因的克隆及功能分析奠定基础, 为探索温度影响叶绿体发育机制提供良好的研究材料。
1 材料与方法
1.1 实验材料
西农1B是西南大学水稻研究所选育的优良籼型三系保持系, 经化学诱变剂EMS处理, 获得水稻温敏型叶片白化转绿突变体, 连续多代自交表明, 白化转绿性状已稳定遗传。2015年, 以表型正常的籼型两系不育系西大1S为母本,为父本, 配制西大1S/杂交组合, 收获F1代种子, 同年在海南种植F1代, F1自交构建F2群体。2016年3月下旬, 在西南大学水稻研究所分别种植亲本和F2群体, 按常规管理田间材料。利用F1群体和F2分离群体进行遗传分析, 于水稻苗期用F2中的隐性单株进行基因 定位。
1.2 表型及农艺性状分析
分别在不同温度(22°C、28°C和32°C)的光照培养箱(8 h黑暗/16 h光照)中培养野生型和突变体, 观察幼苗表型。分别于2016年3月下旬(田间日均气温约22°C)和2016年5月中旬(田间日均气温约28°C)在田间播种野生型西农1B及突变体, 并于苗期移栽至大田种植, 株行距20 cm × 30 cm, 从苗期至成熟期对其进行叶龄标记及表型分析, 并于成熟期从种植小区中部随机各取10株, 考察株高、穗长、有效穗数、每穗粒数、每穗实粒数、分蘖数、结实率和千粒重等主要农艺性状, 进行测验和统计分析。
1.3 光合特性的测定
于孕穗期, 选取长势良好且一致的野生型及突变体单株各5株, 在晴天上午9:00—11:00利用LI- 6400型便携式光合测定仪测定其净光合速率、胞间CO2浓度、蒸腾速率和气孔导度等光合特性参数, 每个单株重复测定5次, 取平均值, 进行测验统计分析。
1.4 不同温度下光合色素含量的测定
在光照培养箱(8 h黑暗/16 h光照)中培养不同温度(22°C、28°C和32°C)条件下萌发后22 d的野生型西农1B和突变体幼苗, 对不同温度下的野生型倒一叶混合取样, 不同温度下的突变体分别取样, 各取6株, 测定其光合色素含量。混合称取0.1 g叶片并剪碎装入50 mL离心管, 加25 mL 95%酒精, 封口避光放置24~48 h, 期间摇动数次充分提取光合色素, 每个样品重复3次。用BECKMAN COULTER- DU720型分光光度计测定提取液在663 nm、645 nm和470 nm波长下的吸光值, 参考Lichtenthaler的方法[11], 根据公式计算各光合色素含量, 取平均值作图, 进行测验统计分析。
叶绿素含量(Chl)=(12.21 ×D663−2.81 × D645) ×V/(1000 FW)
叶绿素含量(Chl)=(20.13 × D645−5.03 × D663) ×V/(1000 FW)
总叶绿素含量(Total Chl)=(17.32 × D645+7.18 × D663)×V/(1000 FW)
类胡萝卜素含量(Car)=(1000×D470−3.27×Chl−104×Chl)/229×V/(1000 FW)
公式中OD663、OD645和OD470分别为萃取液在663 nm、645 nm和470 nm波长下的吸光值; V为萃取液体积(mL); FW为鲜重(g); 单位为mg g–1FW。
1.5 叶绿体超微结构观察
分别选取不同温度(22°C、28°C和32°C)条件下萌发后22 d的野生型西农1B和突变体倒一叶相同部位, 观察叶肉细胞叶绿体超微结构。同时将22°C和28°C下萌发后22 d不同白化程度的幼苗分别移至不同温度(22°C、28°C和32°C)下继续培养10 d, 观察并分析植株移栽前后叶绿体超微结构的变化。剪取大小约5 mm×10 mm的叶片置含有2.5%戊二醛的磷酸缓冲液(PBS)中, 抽真空后于4°C固定4 h;以PBS缓冲液冲洗3次, 每次10 min, 1%锇酸固定2 h (4°C); 再用PBS缓冲液冲洗3次, 每次10 min; 分别用30%、50%、70%、90%、100%和100%的乙醇逐级脱水, 每级10 min; 用Epon8 12环氧树脂进行样品包埋; 置37°C、45°C、65°C恒温箱中固化, 每级温度24 h; 用UltracutE超薄切片机切片, 经醋酸双氧铀硝酸铅染色后, 在JEOL公司生产的JEM- 1200EX型透射电镜下观察叶片细胞超微结构。
1.6 基因组DNA的提取与PCR扩增
选取水稻苗期新鲜叶片按改良的CTAB法[12]提取亲本、基因池及F2群体的基因组DNA用于基因定位。PCR总体系11.9 μL, 包括1.0 μL 100 ng μL–1模板DNA、1.0 μL 10 μmol L–1引物、0.5 μL 2.5 mmol L–1dNTPs、1.25 μL 10×PCR buffer、0.75 μL 25 mmol L–1MgCl2、7.3 μL ddH2O和0.1 μL 5 U μL–1rDNA聚合酶。PCR程序为94°C预变性3 min; 94°C变性30 s, 55~60°C退火30 s, 72°C延伸30 s, 35~40个循环; 72°C终延伸10 min。
1.7 总RNA的提取与qRT-PCR
选取相同生育期野生型和突变体叶片相同部位提取植物总RNA, 总RNA提取纯化试剂盒购自普洛麦格(北京)生物技术有限公司, 反转录试剂盒PrimeScript 1st Strand cDNA Synthesis Kit由Takara生物公司生产。在Applied Biosystems公司7500 Real-time PCR仪上进行qRT-PCR, 以基因为内参基因, 按2–ΔΔCt方法分析基因的相对表达量, 每个样品重复3次。qRT-PCR相关引物均由成都擎科梓熙生物技术有限公司合成。
1.8 分子标记的开发与基因定位
采用BSA法[13]定位目标基因, 从西大1S/的F2群体中选取10株正常单株和10株叶片白化单株, 剪取等量叶片, 构建正常基因池和突变基因池。参照已开发的400余对均匀分布于水稻各染色体的SSR分子标记, 利用http://www.gramene.org/microsat数据库和Vector NTI Advance 10软件开发新的SSR分子标记, 并送成都擎科梓熙生物技术有限公司合成引物。通过PCR扩增和10%非变性聚丙烯酰胺凝胶电泳进行多态性分析及连锁分析, 筛选出两个亲本(西大1S和)的多态性分子标记, 再利用该标记分析正常基因池与突变基因池之间的多态性, 对可能与目标基因连锁的分子标记进行34株F2隐性单株验证, 在确定该分子标记连锁后, 再在连锁标记附近寻找多态性分子标记用于基因初步定位, 待连锁区间确定后, 进一步开发新的多态性分子标记, 用于基因精细定位。
1.9 遗传图谱构建
在用于基因定位的西大1S/的F2群体中, 将显示西大1S带型的单株标记为, 显示带型的单株标记为, 显示杂合带型的单株标记为。根据公式[(2)2]×100计算遗传距离并构建连锁图谱, 其中表示定位群体中出现杂合体带型单株的数量,表示出现正常株带型的单株数,表示用于定位的隐性群体总株数。
2 结果与分析
2.1 表型与农艺性状分析和光合特性测定
田间种植野生型和突变体时发现, 在不同田间温度下分批播种的突变体表型、光合参数及主要农艺性状均存在较大差异。在田间日均气温22°C时(3月下旬)播种的野生型植株在整个生育期正常发育, 而突变体在苗期表现为叶片完全白化, 并有40%逐渐死亡, 存活下来的也生长缓慢, 长势较弱(图1-A, G); 随着叶龄增加, 突变体先抽出的叶片从叶尖向叶基部逐渐恢复绿色, 在分蘖期,其倒四叶为浅绿色, 倒三叶和倒二叶是带有白色条纹的浅绿色, 倒一叶仍表现完全白化(图1-B, H); 刚进入成熟期时, 突变体的倒四叶、倒三叶及倒二叶均为浅绿色, 倒一叶也逐渐恢复浅绿色(图1-C, I)。在田间日均气温28°C时(5月中旬)播种的野生型植株各叶片一直处于正常表型, 而突变体叶片在苗期表现为带有白色条纹的浅绿色叶片(图1-D, J); 在分蘖期, 突变体主分蘖略显白化, 其余分蘖各叶片均接近野生型叶色(图1-E, K); 在成熟期, 突变体的倒一叶至倒四叶叶色与野生型无明显差异(图1-F, L)。叶片光合参数测定表明, 与野生型相比, 22°C下播种的突变体叶片的净光合速率极显著降低, 是野生型的58.02% (图2-A), 气孔导度和细胞间CO2浓度极显著升高, 分别是野生型的236.67%和134.96% (图2-B, C), 蒸腾速率略微升高, 但未达到显著水平(图2-D), 而28°C下播种的突变体叶片各光合参数均接近野生型(图2)。农艺性状调查结果显示, 与野生型相比, 22°C下播种的突变体的株高、分蘖数、有效穗数、每穗粒数、每穗实粒数和结实率均极显著降低, 分别为野生型的66.50%、45.00%、39.47%、56.52%、30.48%和53.92% (图3-A, C~F, H), 其穗长和千粒重略低于野生型, 分别为野生型的85.17%和87.57% (图3-B, G);而28°C下播种的突变体的株高、穗长、千粒重和结实率均接近野生型(图3-A, B, G, H), 仅分蘖数、有效穗数、每穗粒数和每穗实粒数与野生型存在显著差异, 分别为野生型的77.78%、75.00%、86.67%和78.15% (图3-C~F)。

图1 野生型(WT)和突变体tsa2的表型特征
A, B, C: 田间日均气温22°C时播种的野生型(WT)和突变体的苗期(A)、分蘖期(B)和成熟期(C)植株; D, E, F: 田间日均气温28°C时播种的野生型(WT)和突变体的苗期(D)、分蘖期(E)和成熟期(F)植株; G, H, I, J, K, L: 分别对应A, B, C, D, E, F中的叶片。图H, I, K和L中的1、2、3和4分别表示倒一叶、倒二叶、倒三叶和倒四叶。图A和D中, Bar = 2 cm; 图B和E中, Bar = 6 cm; 图C和F中, Bar = 13 cm; 图G~L中, Bar = 0.7 cm。
A, B, C: seedling stage (A), tillering stage (B), and mature stage (C) of the wild type (WT) andmutant seedled at a daily average temperature of 22°C; D, E, F: seedling stage (D), tillering stage (E), and mature stage (F) of the wild type (WT) andmutantseedled at a daily average temperature of 28°C; G, H, I, J, K, L: corresponding to the leaves in A, B, C, D, E, F, respectively. 1, 2, 3, and 4 in the figures H, I, K, and L represent the first, second, third, and fourth fully expanded leaves from topmost leaf, respectively. A and D, Bar = 2 cm; B and E, Bar = 6 cm; C and F, Bar = 13 cm; G–L, Bar = 0.7 cm.
进一步在光照培养箱种植野生型和突变体时发现, 在不同温度下(22°C、28°C和32°C)萌发的22 d龄突变体幼苗之间存在叶色差异(图4-A~C): 22°C时, 突变体叶片完全白化(图4-A); 28°C时, 突变体表现带有白色条纹的浅绿色叶片(图4-B); 32°C时, 突变体叶色与野生型相近(图4-C)。进一步测定光合色素发现, 与野生型相比, 在22°C下, 突变体叶片的叶绿素、叶绿素、总叶绿素及类胡萝卜素含量降低幅度最大, 且均达到极显著水平, 分别降低为野生型的16.50%、17.02%、16.57%和13.87% (图4-D); 在28°C下, 突变体叶片的叶绿素、叶绿素、总叶绿素及类胡萝卜素含量均极显著降低, 但降低幅度较小, 分别降低为野生型的50.89%、53.69%、51.28%和69.73% (图4-D); 在32°C下, 与野生型相比, 突变体叶片的叶绿素、叶绿素、总叶绿素及类胡萝卜素含量均与野生型相近, 分别为野生型的95.99%、97.81%、96.22%和86.27% (图4-D)。
上述表明, 突变体是一个温敏型叶片白化转绿突变体, 低温(22°C)可诱导白化表型, 随田间温度逐渐升高, 白化程度较低的叶片可恢复至野生型叶色, 而完全白化叶片仅能恢复至浅绿色, 并影响其农艺性状。
2.2 不同温度下叶绿体超微结构分析
透射电镜下可见, 野生型在不同温度下(22°C、28°C和32°C), 叶肉细胞中叶绿体含量丰富, 叶绿体形态饱满, 其内部类囊体基粒片层结构清晰, 且数量丰富, 排列紧密(图5-A, E); 而突变体在22°C下, 白化叶片的叶肉细胞中没有叶绿体或者叶绿体发育极不正常, 含有部分囊泡状结构(图5-B, F); 突变体在28°C下, 白化转绿叶片的部分叶肉细胞中无叶绿体或叶绿体发育极不正常, 部分叶肉细胞中叶绿体发育完整, 但数量较少(图5-C, G); 突变体在32°C下的叶绿体数目及超微结构与野生型基本相似(图5-A, E, D, H)。表明低温(22°C)导致突变体叶绿体发育异常, 进而产生白化表型; 突变体白化(图4-A)、白化转绿(图4-B)和绿色(图4-C) 3种叶色是由于不同温度下萌发的突变体2叶肉细胞中叶绿体数量及发育程度不同所致。
为更直接地分析突变体叶绿体发育与温度的关系, 进一步将22°C下萌发的白化幼苗和28°C下萌发的白化转绿幼苗分别移至不同温度下(22°C、28°C和32°C)继续培养10 d发现, 22°C下萌发的白化幼苗在28°C下培养, 叶片出现绿色斑点, 少数叶肉细胞中含有少量完整的叶绿体, 大部分叶肉细胞中的叶绿体仍停留在幼龄阶段, 尚未分化出基粒和基粒片层(图5-I, M); 22°C下萌发的白化幼苗在32°C下培养, 叶片恢复至带有白色条纹的浅绿色, 部分叶肉细胞中的叶绿体数目明显增多, 叶绿体内含有丰富的基粒片层结构, 也含有一些嗜锇颗粒(图5-B, F, J, N), 但与野生型叶肉细胞仍存在明显差异(图5-A, E, J, N); 28°C下萌发的白化转绿幼苗在22°C下培养, 叶片仍为带有白色条纹的浅绿色, 叶肉细胞中叶绿体发育滞缓, 与28°C下萌发的突变体叶肉细胞相比, 叶绿体数目及形态基本相似(图5-C, G, K, O); 28°C下萌发的白化转绿幼苗在32°C下培养, 叶色与野生型接近, 叶肉细胞中叶绿体发育情况也与野生型基本相似(图5-A, E, L, P)。上述表明, 低温抑制突变体2叶肉细胞的叶绿体发育, 随温度升高, 叶绿体发育逐渐恢复正常, 从而使白化叶片逐渐恢复绿色。白化叶片叶肉细胞中没有叶绿体或叶绿体严重畸形, 而白化转绿叶片部分叶肉细胞中含有少量完整的叶绿体, 所以在相同较高温度下, 白化叶片仅能恢复至浅绿色, 而白化转绿叶片却可恢复至野生型叶色。
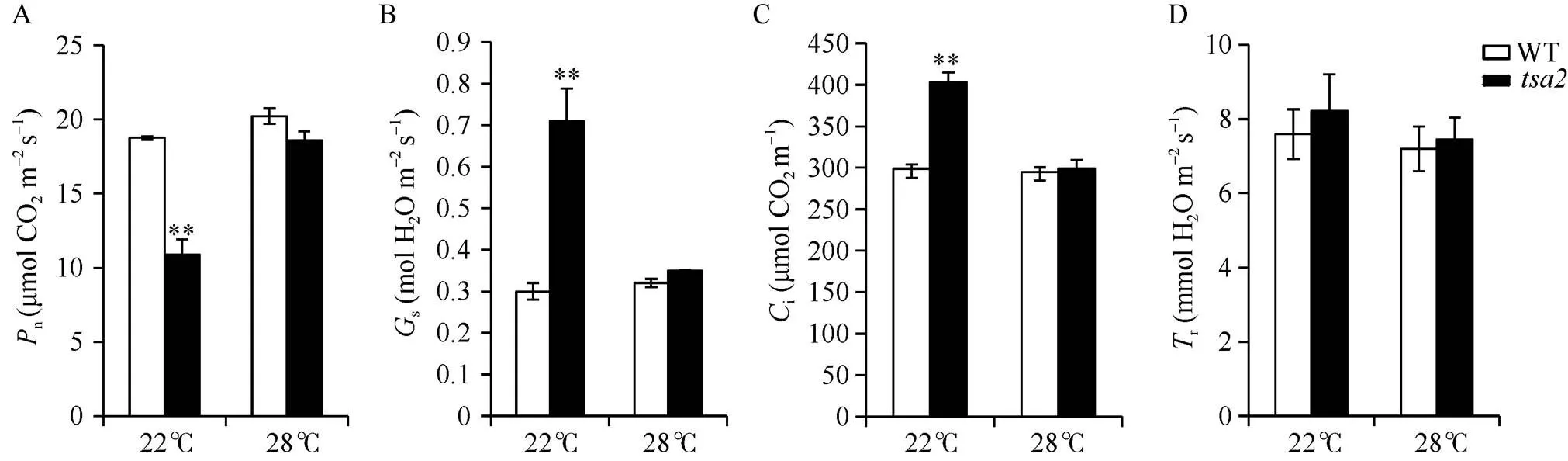
图2 不同田间温度下播种的野生型(WT)和突变体tsa2的光合特性
A: 净光合速率(n); B: 气孔导度(s); C: 胞间CO2浓度(i); D: 蒸腾速率(r); **: 在0.01水平上差异显著。
A: net photosynthetic rate (n); B: stomatal conductance (s); C: intercellular CO2concentration (i); D: transpiration rate (r); **: significant difference at< 0.01 by-test.

图3 不同田间温度下播种的野生型(WT)和突变体tsa2的农艺性状
A: 株高(cm); B: 穗长(cm); C: 分蘖数; D: 有效穗数; E: 每穗粒数; F: 每穗实粒数; G: 千粒重(g); H: 结实率(%); *: 在0.05水平上差异显著; **: 在0.01水平上差异显著。
A: plant height (cm); B: panicle length (cm); C: tiller number; D: effective panicle number; E: grain number per panicle; F: filled grain number per panicle; G: 1000-grain weight (g); H: seed setting rate (%); *: significant difference at<0.05 by-test; **: significant difference at<0.01 by-test.

图4 不同温度下野生型(WT)和突变体tsa2幼苗表型及光合色素含量
A, B, C: 分别为22°C(A)、28°C(B)和32°C(C)下萌发的22 d野生型(WT)和突变体幼苗; D: 不同温度下萌发的野生型(WT)和突变体幼苗光合色素含量; **: 在0.01水平上差异显著。图A、B和C中, Bar = 2.5 cm。
A, B, C: twenty-two days old seedings of the wild type (WT) andmutant seeded under 22°C (A), 28°C (B), and 32°C (C), respectively; D: photosynthetic pigment contents of the wild type (WT) andmutant seedlings seeded under different temperature conditions; **: significant difference at< 0.01 by-test. A, B, and C, Bar = 2.5 cm.
2.3 光合色素代谢以及叶绿体发育和光合相关基因的表达分析
为了解在低温胁迫下, 突变体叶片中叶绿体发育在分子水平上受到的影响, 选取在22°C下萌发22 d的野生型和突变体幼苗叶片, 对其光合色素代谢以及叶绿体发育和光合相关基因的表达水平进行qRT-PCR分析[14]。结果表明, 与野生型相比, 突变体叶片的叶绿素合成途径相关基因、、、和的转录水平不同程度下调, 且均达到极显著水平(图6-A),和的转录水平略微变化, 但未达到显著水平(图6-A); 突变体叶片中类胡萝卜素合成途径相关酶基因、和表达量大幅度下调(图6-A)。与野生型相比, 突变体叶片中PSI亚基编码基因、、、、、、和的表达量不同程度降低, 均达到极显著水平(图6-A); PSII亚基编码基因、、、、、和的转录水平也均表现为极显著下调(图6-A, B); 细胞色素复合物(cytochromecomplex)编码基因、、和的表达量均下降(图6-B); 铁氧还蛋白-NADP+还原酶(ferredoxin- NADP+reductase)编码基因的转录水平极显著下调(图6-B)。与野生型相比, 突变体叶片中的ATP合成酶(ATP synthase)编码基因、和的转录水平极显著下调(图6-B); NADH脱氢酶(NADH dehydrogenase)编码基因和的转录水平极显著下调(图6-B); Rubisco亚基编码基因的转录水平大幅度降低, 且达到极显著水平(图6-B)。此外, 与野生型相比, 在突变体叶片中, 水稻中可能的基因表达水平发生改变, 基因、、、、、、和5的表达水平呈极显著下调(图6-B),的表达水平略微下调, 但未达到显著水平(图6-B), 引物序列见表1。上述表明,基因突变阻碍了低温下突变体幼叶中叶绿体发育进程, 并影响了部分光合色素代谢以及叶绿体发育和光合相关基因的转录水平。
2.4 遗传分析
将突变体与籼型低温敏两系不育系西大1S杂交, F1表型与野生型相同, 未发生性状分离。F2代群体中出现正常和叶片白化转绿两种株型, 在4784个F2植株中, 正常单株数为3634株, 叶片白化转绿单株数为1150株, 经卡方测验, 其分离比符合3∶1 (χ2=2.31<χ20.05,1=3.84), 表明突变表型受一对隐性核基因控制。
2.5 基因定位及候选基因分析
经分子标记多态性分析, 共筛选出80对在2个亲本(西大1S和)间表现出多态性的分子标记, 经基因池连锁分析, 发现目的基因与位于第5染色体短臂上的标记RM405可能存在连锁关系, 进一步利用F2群体中34株隐性单株进行验证, 结果表明该标记与突变位点连锁。通过在RM405附近开发新的SSR标记, 将目的基因初步定位在ZTQ43和RM18053之间, 遗传距离分别为5.79 cM和4.56 cM。在初步定位的区间内, 进一步开发SSR分子标记用于精细定位, 最终得到3对在亲本间呈现多态性的分子标记, 分别是S5-20、S5-57和S5-119 (表2), 在1150个隐性单株中, 这3对SSR标记处发生交换的单株数分别为3、1和19个。其中, ZTQ43处的92个交换株与RM18053处的80个交换株均不同, 并且两端标记ZTQ43和RM18053处的交换株之间不存在交叉。因此, 最终将定位在SSR标记S5-57和S5-119之间, 物理距离约718 kb (图7)。

图5 不同温度下野生型(WT)及突变体tsa2叶肉细胞中叶绿体超微结构
A~D: 不同温度下萌发的22 d野生型(WT)(A)和突变体(B, C, D)叶肉细胞结构; E, F, G, H: 分别为A、B、C、D中虚线区域的放大视野; I, J: 将22°C萌发的22 d突变体分别移至28°C (I)和32°C (J)下培养10 d的叶肉细胞结构; K, L: 将28°C萌发的22 d突变体分别移至22°C (K)和32°C (L)下培养10 d的叶肉细胞结构; M, N, O, P: 分别为I, J, K, L中虚线区域的放大视野。图A~D和I~L中, Bar=2 μm; 图E~H和M~P中, Bar=500 nm。
A–D: mesophyll cells structure of the twenty-two days old wild type (WT) (A) andmutant (B, C, D) seeded under different temperature conditions; E, F, G, H: magnified map of dashed area in A, B, C, D, respectively; I, J: mesophyll cells structure of twenty-two days oldmutant seeded under 22°C and transferred to 28°C (I) and 32°C (J) for 10 days, respectively; K, L: mesophyll cells structure ofmutant seeded under 28°C and transferred to 22°C (K) and 32°C (L) for 10 days, respectively; M, N, O, P: magnified map of dashed area in I, J, K, L, respectively. A–D and I–L, Bar=2 μm; E–H and M–P, Bar=500 nm.

图6 野生型(WT)及突变体tsa2叶片中光合色素代谢以及叶绿体发育和光合相关基因的表达分析
**: 在0.01水平上差异显著。**: significant difference at< 0.01 by-test.

表1 光合色素代谢以及叶绿体发育和光合相关基因的定量引物

表2 第5染色体上的部分多态性分子标记
在基因定位区间内, 包含103个注释基因, 经https://www.genscript.com/预测, 其中的28个基因的表达产物可能位于叶绿体(表3)。根据http:// www.ricedata.cn/gene/和http://www.gramene.org/提供的信息, 对基因定位区间内其余75个注释基因分析发现, 有4个编码酸性磷酸酶家族蛋白、1个编码胶原蛋白、1个编码GA11916-PA、1个编码富含甘氨酸的蛋白质、1个编码HAD超家族磷酸酶、1个编码含组氨酸的磷酸转运蛋白、1个编码同源框结构域含蛋白、1个编码SCC3、1个编码泛醌生物合成蛋白CoQ4、1个编码胞质己糖激酶、1个编码钙调素结合蛋白和1个编码苹果酸酶(表4), 其余60个基因分别编码反转座子、转座子、假设蛋白和表达蛋白。

图7 TSA2基因在第5染色体上的分子定位
= 285: 初步定位群体数目;= 1150: 精细定位群体数目。
= 285: number of plant in primary mapping;= 1150: number of plant in fine mapping.
(续表3)

基因登录号 Accession number蛋白质亚细胞定位预测Protein subcellular localization prediction(https://www.genscript.com/)基因登录号 Accession number蛋白质亚细胞定位预测Protein subcellular localization prediction(https://www.genscript.com/) LOC_Os05g09400chlo: 12, mito: 2LOC_Os05g10210chlo: 4, cyto: 2.5, vacu: 2, cyto_nucl: 2, mito: 1 LOC_Os05g09430chlo: 9, mito: 3, extr: 1LOC_Os05g10290chlo: 9, cyto: 2, mito: 1, extr: 1 LOC_Os05g09450chlo: 7, extr: 3, nucl: 2, cyto: 1LOC_Os05g10300chlo: 3, nucl: 3, E.R.: 3, vacu: 2, mito: 1, plas: 1 LOC_Os05g09480chlo: 10, mito: 2, nucl: 1LOC_Os05g10330chlo: 6, cyto: 2, vacu: 2, E.R.: 2, nucl: 1 LOC_Os05g09490chlo: 9, cyto: 5LOC_Os05g10350chlo: 8, cyto: 3, nucl: 1.5, nucl_plas: 1.5 LOC_Os05g09510chlo: 12, nucl: 1LOC_Os05g10380chlo: 12, mito: 2 LOC_Os05g09540chlo: 9, mito: 4LOC_Os05g10420cyto: 7, chlo: 6 LOC_Os05g09550chlo: 11, nucl: 1, plas: 1LOC_Os05g10430chlo: 6, nucl: 5, extr: 1, E.R.: 1 LOC_Os05g09590chlo: 5, mito: 5, nucl: 4LOC_Os05g10550chlo: 6, nucl: 5, cyto: 3

表4 TSA2基因定位区间内部分注释基因
3 讨论
水稻温敏型叶片白化转绿突变体分为高温敏型和低温敏型两种[15], 后者的白化性状受低温诱导, 在较高温度下可逐渐恢复至野生型叶色, 这在水稻遗传育种和探索温度影响叶绿体发育分子机制等方面具有研究价值。
本研究所用的低温敏型叶片白化转绿突变体, 在22°C和28°C条件下萌发的幼苗表现出不同程度的白化, 温度升高至32°C时, 完全白化幼苗叶色仅可部分恢复, 而白化程度低的幼苗才可恢复野生型叶色。受一对隐性核基因控制, 被定位于第5染色体SSR标记S5-57和S5-119之间。这与目前已完成分子定位的白784、、、、()、等[16-21]低温敏型白化转绿突变体的突变表型及定位区间均不相同。白784被定位于第6染色体, 在20~24°C低温处理下, 其叶片光合色素合成不同程度受阻, 叶片白化[16];被定位于第8染色体, 在温度低于24°C时三叶期之前叶片白化, 随后逐渐变绿[17];被定位于第9染色体, 16~20°C时幼苗白化, 叶肉细胞中没有叶绿体或叶绿体发育极不正常, 只有一些小的囊泡状结构, 在温度高于23°C时复绿[18];被定位于第11染色体, 低于20°C时叶片白化, 高于24°C时复绿, 白化叶片中叶绿体发育有缺陷, 含有较少的基粒片层结构[19]。()和都被定位于第5染色体, 但定位区间与相差较远, 表型亦存在差异,()和均被定位在第5染色体长臂上, 而均被定位在第5染色体短臂[20-21];()在低于26°C时的幼苗前3叶白化, 叶尖和叶鞘带有些许绿色, 白化苗在苗期逐渐死亡, 无法恢复叶色[20], 而有60%左右的白化苗可以存活至成熟期, 最终植株以浅绿色为主;在20~24°C时叶片白化, 在28~32°C时叶色与野生型无差异[21], 而在28°C时幼苗有带白色条纹的浅绿色叶片。、、和等低温敏型白化转绿突变体尚未完成分子定位, 但表型与明显不同,在15~20°C低温条件下白化, 30°C时恢复正常叶色[22];在低温下叶片白化, 在30°C和35°C时叶色分别转为浅绿色和淡绿色[23];在25°C及以上温度下出苗后表现白化随后逐渐恢复绿色, 在20°C及以下温度下萌发的白化苗因无法恢复绿色, 在三叶期便夭亡[24];在低于26.1°C时叶片趋向从黄绿到黄白再到白色, 在高于26°C时叶片趋于正常绿色[25]。上述表明,是一个新的温敏型叶片白化转绿突变体。
叶色突变体主要是由光合色素代谢异常及叶绿体发育缺陷所致。叶绿体是植物光合作用的主要场所, 光照、温度等环境因素及叶绿体发育相关基因的表达可直接或间接影响叶绿体发育及光合色素代谢, 叶绿素等光合色素的稳定性被破坏, 叶绿素代谢异常将直接导致叶色的变化[26]。与野生型相比, 在22°C时, 突变体白化叶片中的叶绿素、叶绿素、总叶绿素及类胡萝卜素含量均极显著降低, 但仍可检测到光合色素的存在, 光合色素含量随温度升高(28°C和32°C)与野生型植株之间的差距逐渐缩小直至无明显差异。说明基因突变影响了低温下光合色素的合成代谢, 导致叶绿素等光合色素的含量大幅下降, 叶片白化。为进一步了解突变体叶色、叶绿体发育与温度之间的关系, 对不同温度下(22°C、28°C和32°C)的突变体叶肉细胞透射电镜分析发现, 其白化叶片(22°C萌发)中没有叶绿体或者叶绿体发育极不正常, 仅含有部分囊泡状结构; 带有白色条纹的浅绿色叶片(28°C萌发)中有部分叶肉细胞含发育完整的叶绿体, 但叶绿体数量仍较少; 而野生型叶片(32°C萌发)中的叶绿体数目及叶绿体超微结构与野生型基本相似。说明低温可导致突变体叶绿体发育异常, 使光合色素合成受阻, 导致22°C和28°C下萌发的突变体出现不同程度的白化表型。为探索突变体白化转绿的原因, 分别将22°C和28°C下萌发的白化和白色纹幼苗移至不同温度下(22°C、28°C和32°C)培养观察并进行透射电镜分析, 发现随温度升高, 白化叶片缓慢恢复至浅绿色, 白化叶片中部分叶肉细胞开始出现少量的叶绿体, 叶绿体数目逐渐增多, 但仍不及野生型, 说明随温度升高突变体叶绿体发育在一定程度上得到恢复, 使叶片逐渐恢复浅绿色。白色条纹叶片在低温下(22°C)的叶色无明显变化, 其叶肉细胞叶绿体发育情况也与28°C时相似, 而在较高温度(32°C)时趋向野生型叶色, 其叶肉细胞的叶绿体数量及发育程度与野生型相近, 说明突变体白化表型主要受萌发阶段的温度影响, 低温处理难使已复绿的幼苗复白, 高温处理可使白色条纹叶片叶绿体发育恢复正常, 叶片完全复绿; 之所以在较高温度下(32°C), 白化叶片仅能恢复至浅绿色, 而白色条纹叶片却可恢复至野生型叶色, 可能是由于完全白化叶片叶肉细胞中没有叶绿体或叶绿体严重畸形, 而白色条纹叶片部分叶肉细胞中含有完整的叶绿体, 叶绿素合成相对较多。与野生型相比, 突变体叶片的叶绿素合成途径相关酶基因、、、和的转录水平大幅下调, 说明低温下突变体白化叶片中叶绿素合成途径相关基因的表达紊乱, 叶绿素不能正常合成; 类胡萝卜素合成途径相关酶基因、和表达量大幅下调, 说明低温下突变体白化叶片中类胡萝卜素合成代谢受阻; 部分PSI亚基编码基因、PSII亚基编码基因以及光合相关基因的表达水平大幅下调, 水稻中可能的基因表达水平也发生改变, 说明低温下突变体白化叶片中叶绿体发育及光合相关基因表达受到影响。与野生型相比, 在田间日均气温约22°C时播种的突变体孕穗期光合速率明显降低, 成熟期株高、每穗粒数和结实率等均极显著降低, 而在田间日均气温约28°C时播种的突变体的孕穗期光合速率无明显变化, 成熟期株高和结实率接近野生型, 每穗粒数与野生型存在较小差异, 是野生型的86.67%。综上所述, 推测基因突变致使突变体叶片中光合色素代谢及叶绿体发育相关基因在低温下异常表达, 导致叶绿体发生异常, 光合色素合成受阻, 叶片白化, 完全白化幼苗随温度升高仅能恢复至浅绿色, 光合作用低下, 最终影响突变体的株高、分蘖数及有效穗数等主要农艺性状, 尤其是产量性状受到明显抑制。
基因被定位在第5染色体分子标记S5-57和S5-119之间, 物理范围718 kb。在该染色体上已克隆了4个叶色相关基因, 但其突变表型均与不同,基因突变后, 导致叶绿素缺失, 突变体表现为黄绿叶[27];基因突变后, 突变体叶片呈现亮绿色[28]; 对和基因进行RNAi干扰, 突变体表现出叶片缺绿, 但未见白化现象[29]。目前, 在该定位区间内尚无白化转绿基因被克隆, 所以可能是一个新的白化转绿基因。叶绿体自身基因和表达产物定位于叶绿体以外的基因发生变异均有可能导致叶绿体发育异常[30-31]。基因定位区间包含103个基因, 其中有28个的表达产物可能位于叶绿体, 影响叶绿体的正常发育; 其余75个注释基因中, LOC_Os05g09650编码泛醌生物合成蛋白CoQ4, 类似于质体醌, 可能参与电子传递链中高能电子的传递; LOC_Os05g09410编码含组氨酸的磷酸转运蛋白, 可能在植物抵御高盐、低温和干旱等非生物胁迫中起作用。目前, 尚不能确定, 还有待于进一步的基因定位及对相关候选基因的遗传互补实验验证。
4 结论
是一个新的温敏型叶片白化转绿突变体,白化表型受低温诱导, 在22°C和28°C下萌发的幼苗出现不同程度的白化, 叶肉细胞中叶绿体发育缺陷; 当温度升高至32°C时, 白化程度较低(28°C萌发)的植株叶片恢复正常, 而白化程度较高(22°C萌发)的植株仅能恢复至浅绿色; 并且在低温下播种的植株光合作用受到明显抑制, 最终影响农艺性状。基因突变影响了叶片中部分光合色素代谢以及叶绿体发育和光合相关基因的转录水平。突变表型受一对隐性核基因控制,被定位于第5染色体SSR标记S5-57和S5-119之间物理范围718 kb的区间内。
[1] Kurata N, Miyoshi K, Nonomura K, Yamazaki Y, Ito Y. Rice mutants and genes related to organ development, morphogenesis and physiological traits., 2005, 46: 48−62.
[2] 黄晓群, 赵海新, 董春林, 孙业盈, 王平荣, 邓晓建. 水稻叶绿素合成缺陷突变体及其生物学研究进展. 西北植物学报, 2005, 25: 1685−1691. Huang X Q, Zhao H X, Dong C L, Sun Y Y, Wang P R, Deng X J. Chlorophyll-deficient rice mutants and their research advances in biology., 2005, 25: 1685−1691 (in Chinese with English abstract).
[3] 兰涛, 汪斌, 凌秋平, 徐春花, 童治军, 梁康迳, 段远霖, 金晶, 吴为人. 水稻苗期低温失绿基因()的精细定位及其候选基因的确定. 科学通报, 2010, 55: 2183−2187. Lan T, Wang B, Ling Q P, Xu C H, Tong Z J, Liang K J, Duan Y L, Jin J, Wu W R. Fine mapping of(), a gene for cold-induced seedling chlorosis, and identification of its candidate in rice., 2010, 55: 2183−2187 (in Chinese).
[4] Chen T, Zhang Y D, Zhao L, Zhu Z, Lin J, Zhang S B, Wang C L. Fine mapping and candidate gene analysis of a green-revertible albino gene() in rice., 2009, 36: 117−123.
[5] 郭涛, 黄永相, 黄宣, 刘永柱, 张建国, 陈志强, 王慧. 水稻叶色白化转绿及多分蘖矮秆基因-()的图位克隆. 作物学报, 2012, 38: 1397−1406. Guo T, Huang Y X, Huang X, Liu Y Z, Zhang J G, Chen Z Q, Wang H. Map-based cloning of a green-revertible albino and high-tillering dwarf gene-() in rice., 2012, 38: 1397−1406 (in Chinese with English abstract).
[6] Kusumi K, Mizutani A, Nishimura M, Iba K. A virescent genedetermines the expression timing of plastid genes for transcription/translation apparatus during early leaf development in rice., 1997, 12: 1241−1250.
[7] Sugimoto H, Kusumi K, Noguchi K, Yano M, Yoshimura A, Iba K. The rice nuclear gene,, is essential for chloroplast development and encodes a novel type of guanylate kinase targeted to plastids and mitochondria., 2007, 52: 512−527.
[8] Su N, Hu M L, Wu D X, Wu F Q, Fei G L, Lan Y, Chen X L, Shu X L, Zhang X, Guo X P, Cheng Z J, Lei C L, Qi C K, Jiang L, Wang H, Wan J M. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production., 2012, 159: 227−238.
[9] 简磊, 王仲康, 曾冬冬, 秦冉, 石春海, 金晓丽. 水稻白化转绿突变体的鉴定和基因精细定位. 核农学报, 2017, 31: 2289−2297. Jian L, Wang Z K, Zeng D D, Qin R, Shi C H, Jin X L. Identification and gene fine mapping of green-revertible albino mutantin rice., 2017, 31: 2289−2297 (in Chinese with English abstract).
[10] Zhang T, Feng P, Yu P, Yu G L, Sang X C, Ling Y H, Zeng X Q, Li Y D, Huang J Y, Zhang T Q, Zhao F M, Wang N, Zhang C W, Yang Z L, Wu R H, He G H.regulates leaf colour development and cell division in rice., 2018, 69: 4791−4804.
[11] Lichtenthaler H K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes., 1987, 148: 350−382.
[12] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321−4325.
[13] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations., 1991, 88: 9828−9832.
[14] 王忠伟. 水稻黄绿叶基因和的克隆与功能分析. 西南大学博士学位论文, 重庆, 2016. Wang Z H. Cloning and functional analysis of two yellow-green leaf genesandin rice (L.). PhD Dissertation of Southwest University, Chongqing, China, 2016 (in Chinese with English abstract).
[15] 全瑞兰, 王青林, 马汉云, 扶定, 霍二伟, 沈光辉, 郭桂英. 水稻白化转绿突变体研究进展. 安徽农学通报, 2015, 21(12): 17−20. Quan R L, Wang Q L, Ma H Y, Fu D, Huo E W, Shen G H, Guo G Y. Research advances on green-revertible albino mutants of rice., 2015, 21(12): 17−20 (in Chinese with English abstract).
[16] 王付华, 王亚, 王青林, 尹海庆, 王生轩, 陈献功, 孙建军, 王越涛, 付景, 白涛, 周柯. 水稻白化复绿突变体白784的生理特性分析及基因精细定位. 河南农业科学, 2015, 44(10): 17−23. Wang F H, Wang Y, Wang Q L, Yin H Q, Wang S X, Chen X G, Sun J J, Wang Y T, Fu J, Bai T, Zhou K. Physiological characters analysis and gene fine mapping of green-revertible albino mutation line Bai 784., 2015, 44(10): 17−23 (in Chinese with English abstract).
[17] Xia J C, Wang Y P, Ma B T, Yin Z Q, Hao M, Kong D W, Li S G. Ultrastructure and gene mapping of the albino mutantin rice (L.)., 2006, 33: 1112−1119.
[18] 郑加兴, 覃保祥, 邱永福, 刘芳, 张月雄, 马增凤, 刘驰, 李容柏. 水稻低温白化转绿突变系的形态生理特性及基因定位. 西南农业学报, 2013, 26: 843−849. Zheng J X, Qin B X, Qiu Y F, Liu F, Zhang Y X, Ma Z F, Liu C, Li R B. Physiological character and gene mapping of virescent mutant linein rice (L.)., 2013, 26: 843−849 (in Chinese with English abstract).
[19] Peng Y, Zhang Y, Lyu J, Zhang J H, Li P, Shi X L, Wang Y F, Zhang H L, He Z H, Teng S. Characterization and fine mapping of a novel rice albino mutant low temperature albino 1., 2012, 39: 385−396.
[20] 王军, 杨杰, 陈志德, 范方军, 朱金燕, 杨金欢, 仲维功. 水稻白化转绿突变体()的生理特性和基因定位. 中国农业科学, 2011, 44: 1973−1979. Wang J, Yang J, Chen Z D, Fan F J, Zhu J Y, Yang J H, Zhong W G. Physiological characteristics and gene mapping of rice albino green mutant() in rice., 2011, 44: 1973−1979 (in Chinese with English abstract).
[21] 刘钰龙, 刘峰, 周坤能, 苏晓妹, 方先文, 张云辉, 鲍依群. 水稻温敏型叶片白化突变体的表型鉴定和基因定位. 作物学报, 2016, 42: 1754−1763. Liu Y L, Liu F, Zhou K N, Su X M, Fang X W, Zhang Y H, Bao Y Q. Phenotypic identification and gene mapping of rice albino mutantin warm-sensitive leaves., 2016, 42: 1754−1763 (in Chinese with English abstract).
[22] 崔海瑞, 夏英武, 高明尉. 温度对水稻突变体叶色及叶绿素生物合成的影响. 核农学报, 2001, 15: 269−273. Cui H R, Xia Y W, Gao M W. Effects of temperature on leaf color and chlorophyll biosynthesis of rice mutant., 2001, 15: 269−273 (in Chinese).
[23] 舒庆尧, 刘贵富, 夏英武. 温敏水稻叶色突变体的研究. 核农学报, 1996, 1(10): 6−10. Shu Q Y, Liu G F, Xia Y W. Temperature-sensitive leaf color mutation in rice (L.)., 1996, 1(10): 6−10 (in Chinese).
[24] 吴殿星, 舒庆尧, 夏英武, 郑涛, 刘贵付. 一个新的水稻转绿型白化突变系的叶色特征及遗传. 浙江农业学报, 1996, 8: 372−374. Wu D X, Shu Q Y, Xia Y W, Zheng T, Liu G F. Leaf color character and genetics of a new green able albino mutation lineof rice (L.)., 1996, 8: 372−374 (in Chinese).
[25] 董彦君, 董文其, 张小明, 石守望, 张宏德. 突变体苗色低温敏感性状的遗传分析. 中国水稻科学, 1995, 9: 249−250. Dong Y J, Dong W Q, Zhang X M, Shi S W, Zhang H D. Genetic analysis of low-temperature-sensitive seedling-colour character in the mutant., 1995, 9: 249−250 (in Chinese with English abstract).
[26] 张天泉, 郭爽, 邢亚迪, 杜丹, 桑贤春, 凌英华, 何光华. 水稻新黄绿叶基因的分子定位. 作物学报, 2015, 41: 989−997. Zhang T Q, Guo S, Xing Y D, Du D, Sang X C, Ling Y H, He G H. Molecular mapping of a new yellow green leaf genein rice (L.)., 2015, 41: 989−997 (in Chinese with English abstract).
[27] Wu Z, Zhang X, He B, Diao L P, Sheng S L, Wang J L, Guo X P, Su N, Wang L F, Jiang L, Wang C M, Zhai H Q, Wan J M. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis., 2007, 145: 29−40.
[28] Yoo J H, Park J H, Cho S H, Yoo S C, Li J J, Zhang H T, Kim K S, Koh H J, Paek N C. The rice bright green leaf () locus encodes OsRopGEF10, which activates the development of small cuticular papillae on leaf surfaces., 2011, 77: 631−641.
[29] Miyoshi K, Ito Y, Serizawa A, Kurata N.genes regulate chloroplast biogenesis in rice., 2003, 36: 532−540.
[30] Moore M, Goforth R l, Mori H, Henry R. Functional interaction of chloroplast SRP/FtsY with the ALB3 translocase in thylakoids: substrate not required., 2003, 162: 1245−1254.
[31] Motohashi R, Nagata N, Ito T, Takahashi S, Hobo T, Yoshida S, Shinozaki K. An essential role of a TatC homologue of a DpH-dependent protein transporter in thylakoid membrane formation during chloroplast development in., 2001, 98: 499−504.
Phenotypic identification and gene mapping of temperature-sensitive green- revertible albino mutantin rice (L.)
SHANG Li-Na**, CHEN Xin-Long**, MI Sheng-Nan, WEI Gang, WANG Ling, ZHANG Ya-Yi, LEI Ting, LIN Yong-Xin, HUANG Lan-Jie, ZHU Mei-Dan, and WANG Nan*
Rice Research Institute, Southwest University / Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China
Temperature-sensitive leaf colormutants of rice are ideal materials in studies on photosynthesis, chloroplast structure and function, and chloroplast development. A temperature-sensitive green-revertible albinomutant () with genetically stable mutational traits was screened out from the progeny of ethyl methane sulfonate (EMS) treatedthree-line maintainer line Xinong 1B. The wild type seedlings had normal phenotype at 22°C, while the mutanthad completely albino leaves and about 40% of albino seedlings died at the seedling stage; the photosynthetic pigment contents and photosynthetic rate of surviving albino seedlings decreased significantly, and the main agronomic traits were significantly lower than those of the wild type at maturity stage.When germinated at 28°C,showed light-green leaves with white streaks and significantly lower photosynthetic pigment contents than the wild type, while a small difference of photosynthetic rate and main agronomic traits between theand the wild type. No significant difference in leaves was observed betweenand the wild type when seedlings germinated at 32°C. Transmission electron microscope observation revealed that the albino leaves ofdemonstrated abnormal chloroplast development (without differentiated grana and granum lamella) or without chloroplast at 22°C and completely developed chloroplasts in partial mesophyll cells at 28°C, and normal number and morphology of mesophyll cells compared with wild type at 32°C. The analysis of qRT-PCR indicated that genes related to partial photosynthetic pigment metabolism pathways, chloroplast development and photosynthesis expressed into a varying degrees compared with these of the wild type. Genetic analysis suggested that mutational phenotype ofwas controlled by a single recessive nuclear gene,which was finally mapped between SSR markers S5-57 and S5-119 on chromosome 5, with a physical distance of 718 kb. These results lay a foundation for the research on genetic improvement and the mechanism explanation of chloroplast development affected by temperature in rice (L.).
rice (L.); temperature-sensitive; green-revertible albino; chloroplast ultrastructure; gene mapping
2018-10-10;
2019-01-12;
2019-02-12.
10.3724/SP.J.1006.2019.82049
王楠, E-mail: wangnan_xndx@126.com
**同等贡献(Contributed equally to this work)
尚丽娜, E-mail: 1872230691@qq.com; 陈新龙, E-mail: 1347647864@qq.com
本研究由国家自然科学基金项目(31771750), 重庆市基础研究与前沿探索项目(cstc2018jcyjAX0424)和重庆市研究生科研创新项目(CYS18084)资助。
This study was supported by the National Natural Science Foundation of China (31771750), the Basic Research and Frontier Exploration Project in Chongqing (cstc2018jcyjAX0424), and the Graduate Research and Innovation Project in Chongqing (CYS18084).
URL: http://kns.cnki.net/kcms/detail/11.1809.s.20190206.1427.002.html

