粉末冶金Ti-Zr牙科修复材料的结构与性能
王葆奇,张桃梅,汪建英,杨海林,阮建明
粉末冶金Ti-Zr牙科修复材料的结构与性能
王葆奇,张桃梅,汪建英,杨海林,阮建明
(中南大学 粉末冶金国家重点实验室,长沙 410083)
采用真空烧结法制备粉末冶金Ti-Zr合金(为质量分数,%。=15,25,35,45),借助X射线衍射仪、光学显微镜、维氏硬度计、万能试验机、滚动摩擦磨损试验机、电化学工作站等仪器和实验设备,对Ti-Zr合金的物相组成、微观组织、力学性能、摩擦磨损性能以及抗腐蚀性能进行分析和测试,并在Ti-Zr合金表面接种培养肉骨瘤成骨细胞(MG-63),借助扫描电镜观察细胞的生长形态,对Ti-Zr合金的生物相容性进行分析与研究。结果表明,Ti-Zr合金由α相和α′相组成,弹性模量较纯Ti明显降低,在53.5~59.3 GPa之间,与人体骨组织较匹配,MG-63细胞在Ti-Zr合金表面呈现良好的生长形态。Ti-Zr合金的力学性能、摩擦磨损性能与抗腐蚀性能较纯钛都有较大的提升,且Zr含量越大,性能越好。其中Ti-45Zr合金具有最高的硬度(HV为525) 、最高抗压强度(1 599.9 MPa)、最高腐蚀电位corr(−0.255 V)及最低的体积磨损量(0.078 3 mm2)和摩擦因数(0.3~0.4),是最理想的牙科修复材料。
Ti-Zr合金;牙科修复材料;摩擦性能;抗腐蚀性能;生物相容性
钛及钛合金具有较低的密度,良好的耐腐蚀性能及优异的力学性能,广泛应用于航空航天领域[1]。事实上,钛及钛合金因其出色的生物相容性,也是一种生物医用金属材料[2−3]。在牙科医用钛合金中,应用最早最广泛的为Ti-6Al-4V合金[4−5],其弹性模量约为110 MPa,与人体骨组织的4.4~28.8 MPa相差甚远,容易产生应力屏蔽效应,严重的应力屏蔽效应会导致骨组织的衰退甚至分解[6−8],并且Ti-6Al-4V合金在植入人体后所释放的铝离子和钒离子对人体产生不良反应,其生物相容性太差[9−11]。1995年KOBAYASHI[12]首次提出将Ti-Zr合金应用于医学领域。Ti和Zr同属第四副族,具有相似的物理和化学性能,并且Ti和Zr形成的是无限固溶的体系[13]。Zr元素还具备良好的耐腐蚀性能以及生物相容性。CORREA等[5]研究发现,在金属Ti中加入Zr元素,在一定程度上会降低材料的弹性模量,而KOBAYA-SHI[12]的研究表明,Ti-Zr合金的力学性能较纯钛有明显的提升,合金的强度和硬度随Zr含量增加而增大,Zr含量为50%(质量分数)时达到最大值,为纯钛的2.5倍。该新型钛合金在强度上已足够满足牙科修复的需求,然而用作牙科修复材料除了强度之外,还应考虑材料的生物相容性,与此同时,由于口腔环境的复杂性,金属材料极易受腐蚀而失效,因此材料的摩擦磨损性能及抗腐蚀性能也应受到足够的重视。本研究选用Ti为主要原料,添加适量的Zr,采用真空烧结法制备粉末冶金Ti-Zr合金,研究Zr含量对合金微观组织、力学性能、摩擦磨损性能和抗腐蚀性能的影响,并通过体外细胞培养考察合金的生物相容性。研究结果对于制备综合性能优良的Ti-Zr牙科修复材料具有指导意义。
1 实验
1.1 Ti-Zr合金制备
以南宫市中洲材料有限公司提供的钛粉和锆粉为原料,其主要成分列于表1。钛粉的平均粒度为34 μm,锆粉的平均粒度为22 μm。
用钛粉和锆粉配制Zr含量(质量分数,%)分别为15,25,35和45的4种Ti-Zr混合粉末 ,在QM-3SP4混料机中以200 r/min的转速混料6 h以上,保证粉末混合均匀。分别将混合粉末及纯钛粉在150 MPa压力下压制成形,然后在DTZK-K真空烧结炉中烧结,得到纯钛及4组不同Zr含量的Ti-Zr合金。烧结后的样品为25 mm×8 mm×6 mm的条形及直径为10 mm、高为15 mm的圆柱形。烧结温度为1 200 ℃,保温2 h后在炉壁外侧通以循环水冷却,烧结过程中真空度始终保持在10−2Pa以下,以防止发生氧化。对烧结样品进行超声波清洗,除去表面污物。
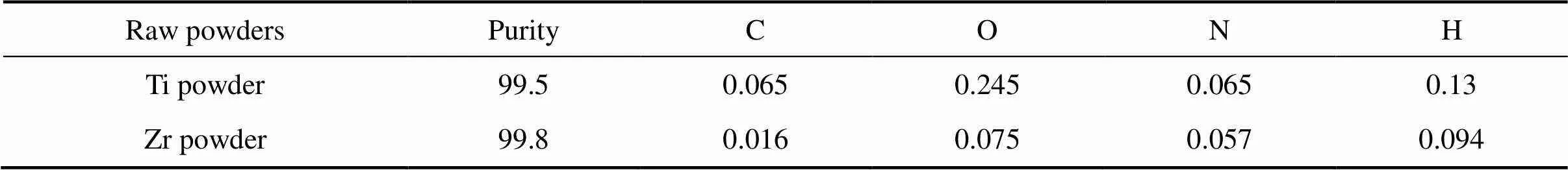
表1 原料粉末的主要成分
1.2 显微组织观察和力学性能测试
采用数控线切割机将Ti-Zr合金制成直径为10 mm、长度为12 mm的圆柱体试样,进行磨制、抛光、腐蚀处理后,用Rigaku X-2000型X射线衍射仪分析合金的物相组成,用F-Leica MeF3AEI光学显微镜进行组织观察。采用610HVS-30数显维氏硬度计测定纯Ti及Ti-Zr合金的维氏硬度,加载载荷为10 N,加载时间为30 s,每个试样选取5个点进行测定,取平均值。采用Instron 3369型万能材料试验机测定Ti及钛合金的抗压强度,并通过应力应变曲线的初始线性部分计算材料的弹性模量,压缩速度为1 mm/min,实验结果为3个试样的平均值。
1.3 摩擦磨损试验
通过HRS-2M滚动摩擦磨损试验机对材料的摩擦磨损性能进行测定,采用球−面接触模式,球形试件为直径为5 mm的Si3N4球,平面试样为打磨抛光后的尺寸为25 mm×8 mm×6 mm纯钛和Ti-Zr合金,在10 N的载荷下运行5 min。
1.4 电化学腐蚀试验
利用CHI604D电化学工作站记录纯钛及钛锆合金在人工唾液环境中的电位动力学极化曲线,分析材料的抗腐蚀性能。采用饱和甘汞电极(SCE)为基准电极,铂板为辅助电极。人工唾液的成分列于表2。
1.5 生物相容性试验
通过骨肉瘤成骨细胞(MG-63)的体外细胞培养实验来检测钛锆合金的生物相容性,细胞来源于上海生命科学研究院,采用RPMI 1640培养基接种,培养基中包含10 %胎牛血清、1 %抗生素和0.85 mL抗坏血酸磷酸盐。将成骨细胞和培养基滴在合金样品表面后置于CO2浓度为5 %,温度为37 ℃的培养箱中培养7天。分别在第1,3,5,7天这4个时间点取出样品,将AlamarBlue试剂滴在样品表面,活细胞能将蓝色氧化形式的Alamar Blue变成红色的还原形式,同时发生可量化的荧光变化。用酶标仪测定其颜色变化来计算细胞的还原率,用nano230扫描电镜观察细胞增殖过程中细胞的附着、生长行为及详细形态。

表2 人工唾液的成分
2 结果与分析
2.1 显微组织与力学性能
图1所示为Ti-Zr合金的XRD谱,从图中看到,Ti-Zr合金主要由密排六方结构的α相和α′相组成。常温下Ti-Zr合金为α相,烧结过程中因为采用了循环水冷却,冷却速率高于合金的平衡冷却速率,因此发生马氏体相变生成α′相。相对于α相,α′相含有更多的固溶元素Zr,且由于Zr的原子半径大于Ti的原子半径,XRD峰向小角度偏移,Zr含量越多,偏移越明显。
图2所示为Ti-Zr合金的金相显微组织,可以明显看到粗细交错的2种组织,细的为α相,粗的为α′相。随Zr含量增加,2种组织均有细化的趋势。
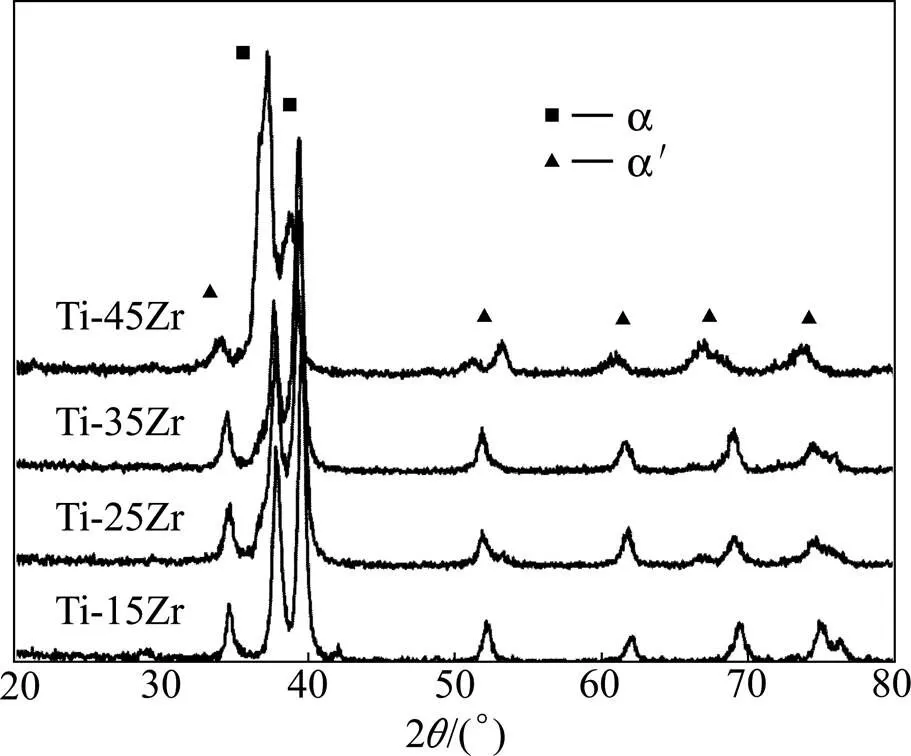
图1 Ti-Zr合金的XRD谱
力学性能和弹性模量是评价牙科修复材料的重要指标,理想的牙科修复材料既能在弹性模量上很好地跟口腔组织相匹配,也能承受一定载荷的重击[14−15]。表3所列为纯Ti及Ti-Zr合金的维氏硬度、抗压强度与弹性模量。可见Ti-Zr合金的抗压强度和硬度都远优于纯Ti,这得益于Ti-Zr合金的固溶强化和细晶强化作用。Ti-Zr为无限固溶体系,Zr的加入可产生固溶强化的效果,与此同时,Zr的加入会降低Ti-Zr合金的相转变温度,从而阻碍相组织的长大,使得组织细化,在材料性能上表现为细晶强化,随Zr含量增多,强化作用越明显。但在加入Zr之后材料的弹性模量明显降低,一方面是因为Ti-Zr合金在α相的基础上有新相α′相析出,α′相夹杂在α相之间,不同相之间的结合力没有单一相之间的结合力大;另一方面是因为Zr的加入使得原子间距增大,原子间键合力 下降。

图2 Ti-Zr合金的微观组织
(a) Ti-15Zr; (b) Ti-25Zr; (c) Ti-35Zr; (d) Ti-45Zr
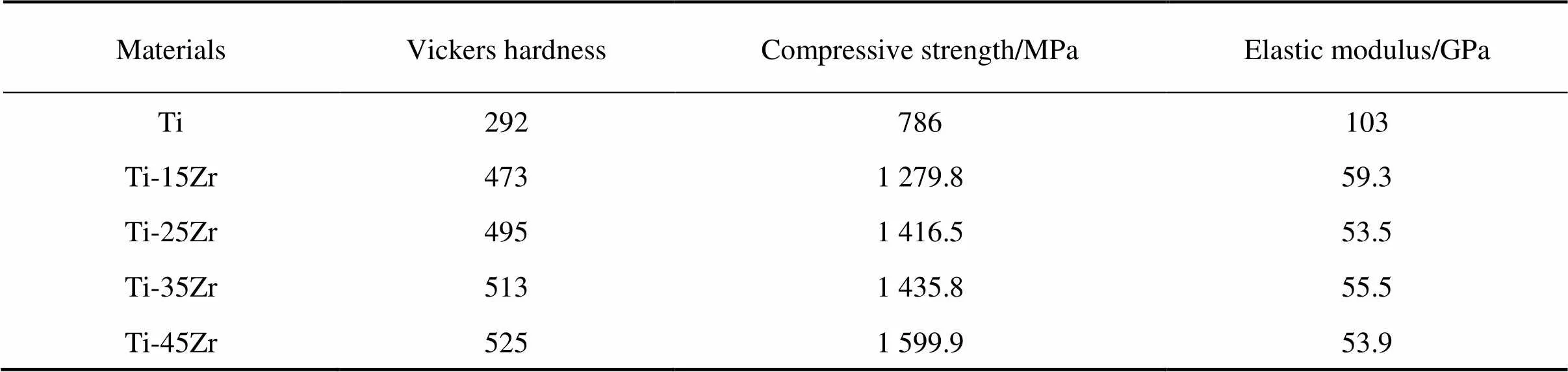
表3 Ti及Ti-Zr合金的力学性能
2.2 摩擦磨损性能
耐磨性能是选择牙科修复材料的重要参考因素。表4所列为纯钛及Ti-Zr合金的体积磨损量,图3所示为材料横截面的磨损深度分布图。由表4和图3可知,Ti-Zr合金的磨损量低于纯钛的磨损量,合金的磨损深度均低于纯钛的磨损深度;随Zr含量增加,体积磨损量减小,磨损深度下降,这表明Ti-Zr合金的耐磨性能随Zr含量增加而提高。图4所示为纯钛及Ti-Zr合金的摩擦因数曲线。由图可见,当摩擦因数趋于稳定时,Ti-Zr合金的摩擦因数明显低于纯钛的摩擦因数,且随Zr含量增加,摩擦因数降低程度更明显,在Zr含量为45%时材料的摩擦因数为0.3~0.4,远低于纯钛的摩擦因数0.6~0.7。由于Zr元素的加入所产生的固溶强化和细晶强化效果,Ti-Zr合金的硬度较纯钛提高近1倍。硬度是影响金属材料耐磨性能及摩擦性能的重要因素,硬度越大,材料的摩擦因数越小,耐磨性能越好[16]。因此Ti-Zr合金较纯钛拥有更低的摩擦因数,Zr含量越高,耐磨性能越好。

表4 Ti和Ti-Zr合金的体积磨损量
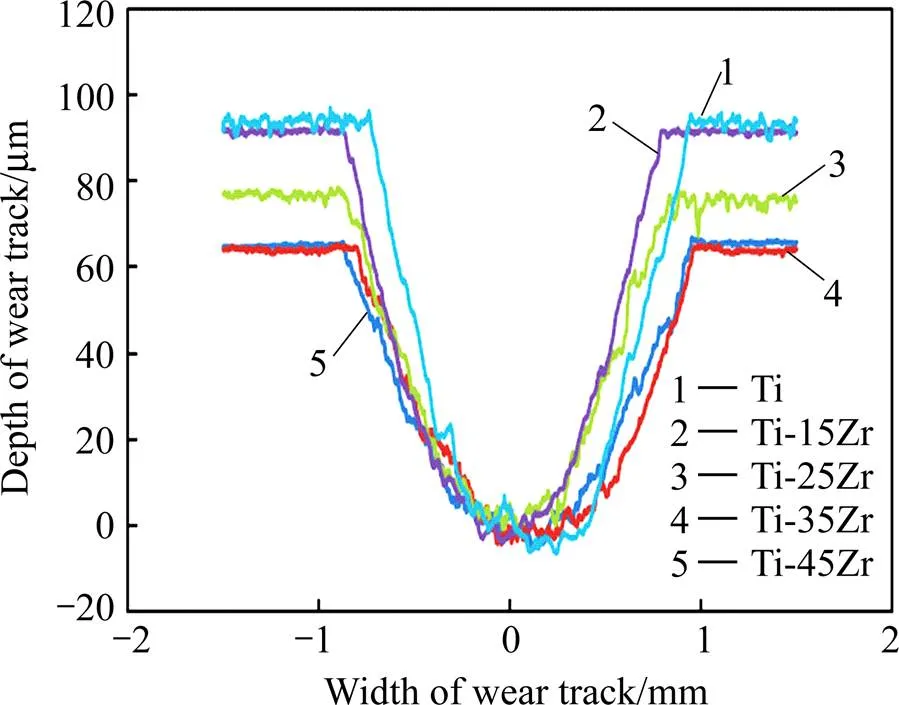
图3 Ti和Ti-Zr合金截面磨损深度
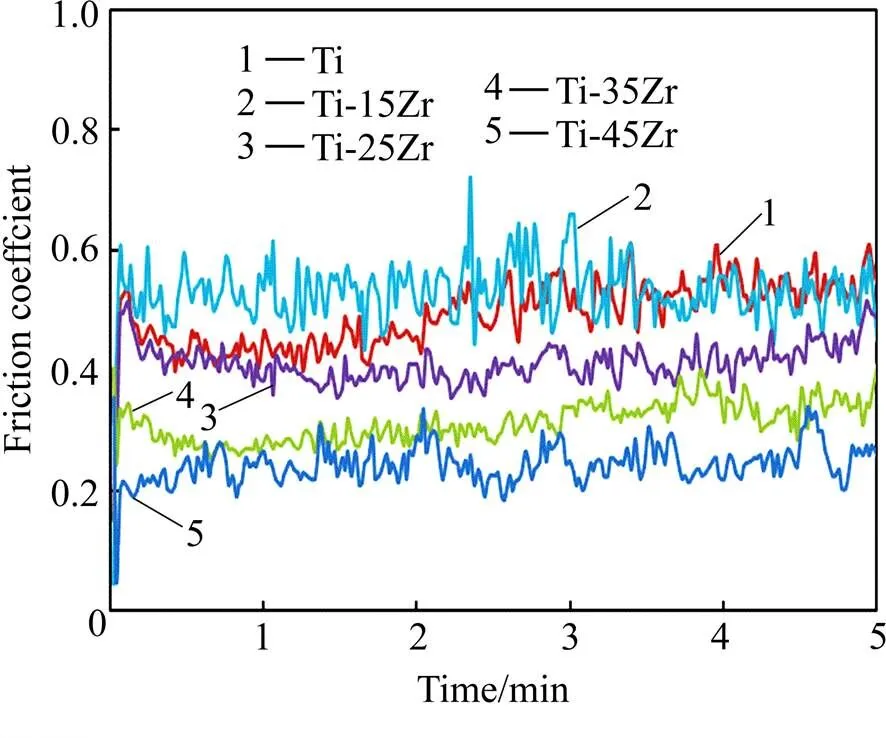
图4 Ti和Ti-Zr合金的摩擦因数曲线
2.3 电化学腐蚀
口腔环境中金属极易受到腐蚀,腐蚀后的金属强度降低、美观不足,甚至损伤细胞组织造成过敏、致癌等不良反应[17−18]。图5所示为纯Ti和Ti-Zr合金在人工唾液环境下的极化曲线,表5所列为材料的腐蚀电位corr。从表5可看出,添加Zr可提高金属钛的自腐蚀电位,并且随Zr含量增加,Ti-Zr合金的自腐蚀电位增大,表明合金的耐腐蚀性能增强。Ti-Zr合金表面形成一层由TiO2和ZrO2组成的更加稳定的氧化 膜[19],对合金起到一定的保护作用,因而Ti-Zr合金表现出较好的抗腐蚀性能。
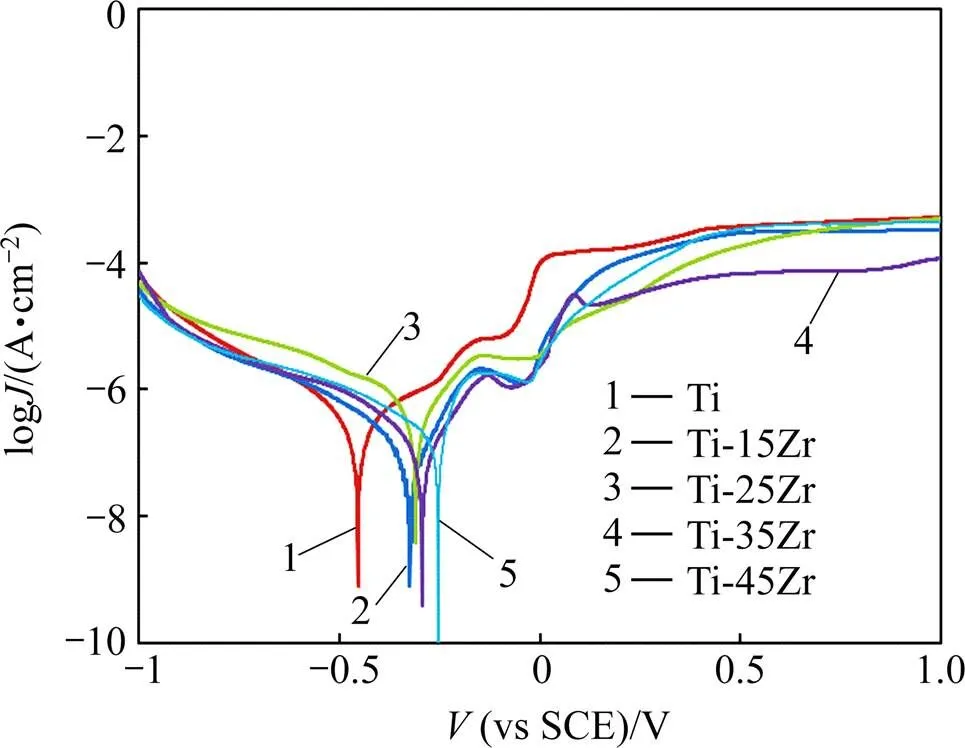
图5 Ti和Ti-Zr合金的极化曲线

表5 Ti和Ti-Zr合金的腐蚀电位
2.4 生物相容性
图6所示为MG-63细胞在Ti-Zr合金表面不同时间点的还原率,其中对照组为细胞在表面皿上面的还原率。由图可见,随时间延长,合金表面的细胞还原率稳步上升,说明MG-63细胞在Ti-Zr合金表面稳定地生长和繁殖,没有出现异常的大面积死亡或坏死现象。图7所示为扫描电镜下观察的培养7天之后的Ti-Zr合金表面细胞生长形态,可以看到细胞紧密地粘附并覆盖在合金表面,同时观察到一定量的细胞伪足,这有利于细胞的生长和繁殖。细胞的这种形态表明细胞和Ti-Zr合金之间具有良好的相互作用。Ti-Zr合金表现出优异的生物相容性,具有良好的生物医学应用潜力。

图6 材料表面MG-63细胞的还原率随时间的变化

图7 扫描电镜下Ti-Zr合金表面MG-63细胞的生长形态
(a) Ti-15Zr; (b) Ti-25Zr; (c) Ti-35Zr; (d) Ti-45Zr
3 结论
1) 粉末冶金Ti-Zr合金由α和α′相组成。与纯钛相比,Ti-Zr合金的维氏硬度及抗压强度提高近1倍,Zr含量越大,硬度及抗压强度越高,弹性模量在53.5~59.3 GPa范围内,与人体骨组织较匹配。
2) Zr的加入使金属钛的抗腐蚀性能有较大提升,并表现出优良的生物相容性,MG-63细胞在Ti-Zr合金表面呈现良好的生长形态,合金具有良好的生物医学应用潜力。
[1] MOURITZ A. Introduction to Aerospace Materials[M]. Cambridge: Woodhead Publishing, 2012: 202−223.
[2] GEETHA M, SINGH A K, ASOKAMANI R, et al. Ti based biomaterials, the ultimate choice for orthopaedic implants[J]. Progress in Materials Science, 2009, 54(3): 397−425.
[3] YU Z T, HAN J Y, MA X Q, et al. Biological and mechanical compatibility of biomedical titanium alloy materials[J]. Chinese Journal of Tissue Engineering Research, 2013, 2(4): 175−202.
[4] LONG M, RACK H J. Titanium alloys in total joint replacement[J]. Biomaterials, 1998, 19(18): 1621−1639.
[5] CORREA D R N, VICENTE F B, DONATO T A G, et al. The effect of the solute on the structure, selected mechanical properties, and biocompatibility of Ti-Zr system alloys for dental applications[J]. Materials Science & Engineering C, 2014, 34(1): 354−359.
[6] OH I H, NOMURA N, MASAHASHI N, et al. Mechanical properties of porous titanium compacts prepared by powder sintering[J]. Scripta Materialia, 2003, 49(12): 1197−1202.
[7] MORONI A, CAJA V L, EGGER E L, et al. Histomorphometry of hydroxyapatite coated and uncoated porous titanium bone implants[J]. Biomaterials, 1994, 15(11): 926.
[8] SBERVEGLIERI G, COMINI E, FAGLIA G, et al. Titanium dioxide thin films prepared for alcohol microsensor applications[J]. Sensors & Actuators B Chemical, 2000, 66(1): 139−141.
[9] CATALANI S, STEA S, BERAUDI A. Vanadium release in whole blood, serum and urine of patients implanted with a titanium alloy hip prosthesis.[J]. Clinical Toxicology, 2013, 51(7): 550−556.
[10] OKAZAKI Y, RAO S, ASAO S. Effects of Ti, Al and V Concentrations on Cell Viability[J]. Materials Transactions Jim, 2007, 39(10): 1063−1069.
[11] WALKER P R, LEBLANC J, SIKORSKA M. Effects of aluminum and other cations on the structure of brain and liver chromatin[J]. Biochemistry, 1989, 28(9): 3911−3915.
[12] WEN B, ZHU F, LI Z, et al. The osseointegration behavior of titanium-zirconium implants in ovariectomized rabbits[J]. Clinical Oral Implants Research, 2014, 25(7): 819−825.
[13] HO W F, CHEN W K, WU S C, et al. Structure, mechanical properties, and grindability of dental Ti-Zr alloys[J]. Journal of Materials Science Materials in Medicine, 2008, 19(10): 3179− 3186.
[14] 杨栋华, 邵慧萍, 郭志猛, 等. 凝胶注模工艺制备医用多孔Ti-Co合金的性能[J]. 稀有金属材料与工程, 2011, 40(10): 1822−1826. YANG Donghua, SHAO Huiping, GUO Zhimeng, et al. Mechanical properties of porous Ti-Co alloy for medical application by gelcasting[J]. Rare Metal Materials and Engineering, 2011, 40(10): 1822−1826.
[15] REZWAN K, CHEN Q Z, BLAKER J J, et al. Biodegradable and bioactive porous polymer/inorganic composite scaffold for bone tissue engineering[J]. Biomaterials, 2006, 27(18): 3413− 3431.
[16] MONASKY G E, TAYLOR D F. Studies on the wear of porcelain, enamel, and gold[J]. Journal of Prosthetic Dentistry, 1971, 25(3): 299−306.
[17] 高勃, 严晓东, 陈静, 等. 激光立体成形Ti-Zr合金腐蚀性能研究[J]. 实用口腔医学杂志, 2006, 22(3): 325−328. GAO Bo, YAN Xiaodong, CHEN Jing, et al. Corrosion behavior of Ti-Zr alloy by laser solid forming technology[J]. Journal of Practical Stomatology, 2006, 27(18): 3413−3431.
[18] 钱棱, 王培志. 种植体腐蚀及其影响因素的研究进展[J]. 口腔生物医学, 2012, 3(2): 87−89. QIAN Leng, WANG Peizhi. Research progress of implants corrosion and its influencing factors[J]. Oral Biomedicine, 2012, 3(2): 87−89.
[19] GEORGIANA B, JAVIER I, JUAN J. SANTANA, et al. Electrochemical characterization of ZrTi alloys for biomedical applications[J]. Electrochimica Acta, 2013, 88(9): 447−456.
Microstructure and properties of powder metallurgy Ti-Zr alloys for dentalimplants
WANG Baoqi, ZHANG Taomei, WANG Jianying, YANG Hailin, RUAN Jianming
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Powder metallurgy Ti-Zr alloy (=15, 25, 35, 45, mass fraction, %) were prepared by vacuum sintering technology. The microstructure and phase composition of Ti-Zr alloys were investigated by OM and XRD, the mechanical properties were measured by Vickers hardness tester and universal material testing machine, the friction performance and corrosion resistance were investigated by Rolling friction and wear tester and electrochemical workstation, and the in-vitro cytotoxicity tests (MG-63) were carried out for biocompatibility evaluation. The results indicated that α and α′ phase exist in Ti-Zr alloys, all Ti-Zr alloys show a lower elastic modulus ranging from 53.5 GPa to 59.3 GPa compared with CP-Ti. The alloys presented no cytotoxic effects and the surface of the alloys exhibited great growth conditions for MG-63 cells. Increasing Zr content could lead to increase in mechanical properties,friction performance and corrosion resistance. The Ti-45Zr alloy exhibited the maximum vickers hardness (HV 525), compressive strength (1 599.9 MPa), corrosion potentialcorr(−0.255 V) and the minimum volume of friction wear (0.078 3 mm2) and friction coefficient (0.3−0.4) which is of great potential for dental applications.
Ti-Zr alloys; dental applications; friction performance; corrosion resistance; biocompatibility
TG146.4
A
1673-0224(2019)02-106-06
2018−09−29;
2018−11−04
阮建明,教授,博士。电话:0731-88876644;E-mail: jianming@csu.edu.cn
(编辑 汤金芝)

