应用还原型谷胱甘肽预防处理接受TACE治疗的中晚期原发性肝癌患者对肝功能的影响
赵晓光,史玉洁
原发性肝癌(primary liver cancer,PLC)作为肝脏常见的恶性实体瘤之一,其发病率位居男性癌症的第二位[1]。因肝癌发病隐匿,早期无明显临床症状,故确诊肝癌时多已为中晚期,错过了最佳的治疗时机,预后差[2]。目前,经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE) 作为治疗PLC的常规手段,已广泛应用于临床,但其可能导致肝功能损伤[3]。研究[4,5]表明,给予接受TACE治疗的中晚期PLC患者还原型谷胱甘肽(glutathione,GSH)治疗,有明显的护肝作用,可使血清肝酶水平保持正常。我们回顾性分析了应用GSH预防处理接受TACE治疗的中晚期PLC患者的临床疗效,现将结果报道如下。
1 资料与方法
1.1 一般资料 2010年2月~2014年7月于我院肝脏外科治疗的PLC患者138例,男性84例,女性54例;年龄24~68岁,平均年龄(54.3±8.7)岁。诊断均符合《原发性肝癌诊疗规范》[6]的标准。纳入标准:(1)未接受过任何治疗的PLC患者;(2)无介入治疗禁忌证者。排除活动性肝炎或结核或肿瘤远处转移者。采用随机数字表法将PLC患者分为对照组67例和观察组 71 例,两组在性别(x2=0.001,P=0.980)和年龄(t=1.393,P=0.166)方面比较,差异无统计学意义,具有可比性。患者及其家属签署知情同意书。本研究获得我院医学伦理委员会批准同意。
1.2 介入治疗方法 患者仰卧位于数字减影血管造影(DSA)器(德国西门子公司)检查台,行腹股沟常规消毒,铺无菌巾,给予2%利多卡因(国药集团容生制药有限公司,国药准字H20043676)行局部麻醉。采用改良的Seldinger技术穿刺股动脉,置入4F导管鞘,置入4F肝动脉导管,依次对腹腔干动脉、肝动脉和肠系膜上动脉进行造影检测,确定病灶,选择性将导管插至肿瘤供血动脉,实施TACE常规治疗。手术期间用药为:超液化碘油(法国加柏公司)5~20 ml、丝裂霉素(海正辉瑞制药有限公司,国药准字H33020786)2~4 mg、吡喃阿霉素(浙江海正药业股份有限公司,国药准字H33021980)10~30 mg和顺铂(齐鲁制药有限公司,国药准字H37021358)20 mg,将其充分乳化并由导管注入以栓塞血管,或在下次治疗时给予顺铂20 mg和氟尿嘧啶200~500 mg。当出现疼痛和呕吐等症状时,及时采取对症处理措施。与此同时,给予明胶海绵颗粒栓塞供血靶动脉。每例患者治疗2~3次,间隔4 w。
1.3 护肝治疗 给予两组水化、止吐、保护胃黏膜等常规治疗。在对照组,给予维生素B6、维生素C(陕西博森生物制药股份集团有限公司,国药准字H20059692)、肌苷和支链氨基酸静脉滴注,1次/d,术后连续应用7 d;在观察组,在上述用药基础上,加用GSH(重庆药友制药有限责任公司,国药准字H20067129)1.8 g加入5%葡萄糖溶液(浙江康吉尔药业有限公司,国药准字H20045167)250 ml中,静脉滴注,1次/d,术后连续应用7 d。
1.3 疗效评估 在治疗前后行CT平扫和增强扫描,评估近期临床疗效:肿瘤完全缓解(complete response,CR):肿瘤完全消失;肿瘤部分缓解(partial response,PR):肿瘤长径之和至少缩小30%;疾病进展(progressive disease,PD):肿瘤长径之和至少增加20%;疾病稳定(stable disease,SD):不符合 PR 和PD。根据美国癌症研究所不良事件通用评估4.0标准评价不良反应。
1.4 观察指标 使用全自动生化分析仪(日本日立公司)检测血生化指标。门诊和电话随访一年,追踪患者生存情况,并计算6 m和1 a生存率。
1.5 统计学方法 应用SPSS 19.0统计学软件行数据处理,对服从正态分布的计量资料以(±s)表示,采用独立样本t检验;计数资料以%表示,采用x2检验;等级资料的比较采用秩和检验;检验水准为α=0.05,即P<0.05为差异具有统计学意义。
2 结果
2.1 PLC患者治疗前后影像学表现变化 经TACE治疗后,肿瘤体积明显减小(图1)。

图1 PLC患者治疗前后腹部CT表现
2.2 两组近期临床疗效比较 在治疗后3 m复查,两组PR和SD发生率比较,无显著性差异(P<0.05,表1)。
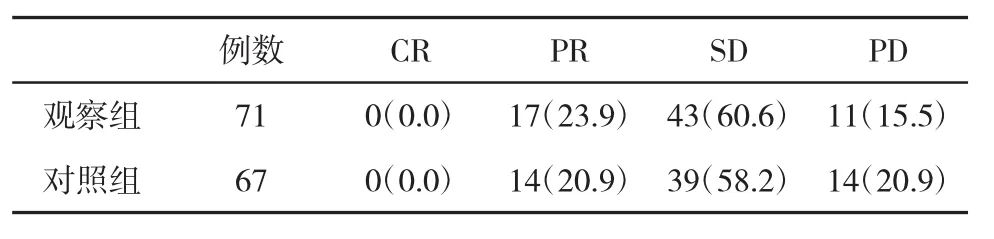
表1 两组近期临床疗效(%)比较
2.3 两组肝功能指标变化的比较 在治疗后10 d复查,发现观察组患者血清ALT和AST水平显著低于对照组,差异有统计学意义(P<0.05,表2)。
2.4 两组治疗后不良反应发生率比较 在治疗后2 w观察,观察组患者发生胃肠反应(恶心、呕吐)19例(26.8%),白细胞减少16例(22.5%),血红蛋白减少14例(19.7%),血小板减少2例(2.8%);对照组发生胃肠反应 22例(32.8%,P<0.05),白细胞减少 19例(28.4%),血红蛋白减少20例(29.9%,P<0.05),血小板减少4例(6.0%)。
表2 两组患者治疗后肝功能指标(±s)比较
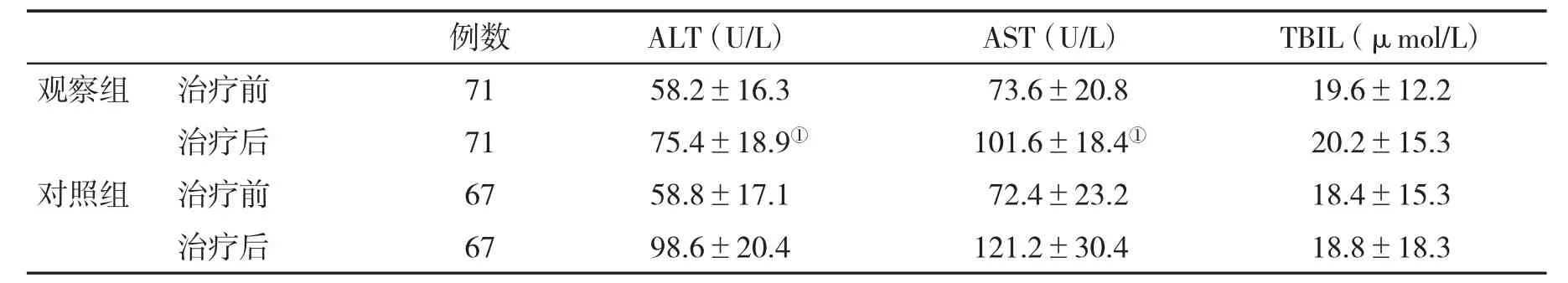
表2 两组患者治疗后肝功能指标(±s)比较
与对照组比,①P<0.05
例数 ALT(U/L) AST(U/L) TBIL(μmol/L)观察组 治疗前 71 58.2±16.3 73.6±20.8 19.6±12.2治疗后 71 75.4±18.9① 101.6±18.4① 20.2±15.3对照组 治疗前 67 58.8±17.1 72.4±23.2 18.4±15.3治疗后 67 98.6±20.4 121.2±30.4 18.8±18.3
2.5 两组生存率比较 观察组和对照组患者6 m生存率分别为 91.5%(65/71)和 85.1%(57/67),差异无统计学意义(P>0.05);观察组和对照组1 a生存率分别为 84.5%(60/71)和 61.2%(41/67),差异有统计学意义(P<0.05,图 2)。
3 讨论
PLC作为一种实体恶性肿瘤,严重影响人类的身心健康和日常生活。近些年来,PLC的发病率呈上升趋势[7]。因PLC患者确诊时多为中晚期,失去了手术的机会。故及早对PLC进行诊断、治疗及评估其预后可有效改善该类患者的生存质量[8,9]。一般,临床上常用的治疗方法有手术切除和各种局部介入治疗,如化疗栓塞术,但该治疗可能对PLC患者正常的肝脏功能造成损伤,严重者可导致肝衰竭的发生[10]。有关研究[11,12]显示,在局部介入治疗肝脏肿瘤时,应用GSH静脉滴注可缓解化疗药物或栓塞剂对肝脏的损伤,进而改善肝脏微环境。本研究探讨了采用TACE治疗中晚期PLC患者治疗前后肿瘤体积的变化、临床疗效、各项肝功能指标的变化和不良反应发生率情况,并分析了在介入治疗后联合应用GSH对PLC患者肝功能的影响。
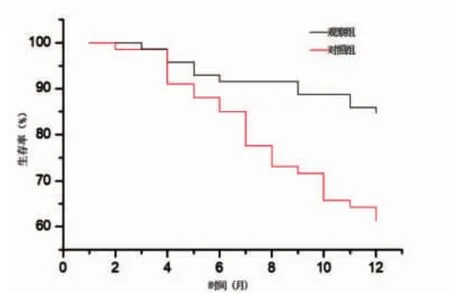
图2 两组生存率比较
有研究[13,14]表明,经TACE治疗后,肝癌组织存在高密度的碘油沉积,较术前CT图像显示的病灶体积明显缩小,表明PLC患者肿瘤体积有较明显的缩小。本研究结果显示,经TACE治疗后,两组患者肿瘤体积均有所缩小,而应用GSH治疗本身对肝脏肿瘤体积的影响较小,可能因为GSH并没有抗肿瘤作用。既往研究[15-17]表明,PLC患者在介入治疗后联用GSH治疗可加强肝脏的解毒作用,从而修复受损的肝脏细胞。本研究两组患者治疗后临床疗效比较显示,两组肿瘤近期应答率无显著差异,但观察组肝功能改善较明显。上述结果提示,应用GSH对PLC患者肝脏具有保护作用,可改善患者的肝脏功能,增加患者对化疗和栓塞治疗的耐受性。分析原因可能为对PLC患者补充外源性GSH后,可使患者肝细胞膜功能稳定,膜上酶活性趋于正常,进而改善了肝脏微环境。本研究还发现在应用GSH静脉滴注后,观察组患者胃肠反应、白细胞减少、血红蛋白减少和血小板减少发生率低于对照组,表明PLC患者在介入治疗后给予联合应用GSH具有较好的减轻不良反应的作用。
有研究[18-20]表明,PLC患者在介入治疗后接受静脉滴注GSH,能使肝功能指标趋于正常,即GSH具有护肝疗效。本研究结果亦显示,观察组患者治疗后血清ALT和AST水平显著低于对照组,提示治疗后观察组肝功能指标的上升没有对照组那么高,分析原因为化疗药物在体内代谢产生大量的氧自由基,使得患者肝脏组织受损,但GSH可与氧自由基结合生成低毒性的代谢产物,从而降低对肝脏的损害。本研究生存结果分析表明,应用GSH后,两组患者6月内的生存率无显著性相差,但12个月后观察组生存率明显高于对照组,个中原因还需要随访观察,可能原因为GSH能够维持细胞的正常代谢及细胞膜的完整性,有效抑制肿瘤的转移和侵袭。上述结果提示,虽然单纯行介入治疗能有效抑制和杀死肿瘤组织细胞,但对正常肝脏细胞有所损伤,在介入治疗后加用GSH静脉滴注,对PLC患者不仅能有效抑制和杀死肿瘤组织细胞,还可保护肝脏免于损伤,提升临床近期疗效,降低患者不良反应发生率,改善患者的生活质量。
综上所述,在经肝动脉介入化疗栓塞治疗中晚期PLC患者后加用GSH静脉短期滴注,可提高临床疗效,改善肝功能,提高患者生存质量。本研究为单中心回顾性研究,可能存在选择偏倚,影响结果的因素较多,如基础肝病、合并症、肿瘤分期和辅助治疗等的不同,都可能影响了结果的观察。另我们应用GSH静脉滴注的时间也较短,是否应在TACE治疗前即开始治疗以及治疗疗程等,均需要进一步研究。下一步我们将增加观察例数,尽量完善纳入标准,并可能地进行多中心临床研究,以验证所得结果的科学性。

