超声内镜下穿刺引流治疗感染性胰腺坏死:附60例报告
刘云飞,尚明铭,罗东,朱红伟 ,李宜雄,余枭
(1.中南大学湘雅三医院 肝胆胰外科II,湖南 长沙 410013;2.中南大学湘雅医院 普通外科,湖南 长沙 410008)
急性胰腺炎(acute pancreatitis,AP)是胰腺的急性炎症反应,分轻症(MAP)、中重症(MSAP)和重症(SAP),其中SAP约为AP的15%~20%[1-3]。MAP为自限性疾病且预后良好,M S A P和S A P患者多可发展为胰腺坏死,病死率高达15%~30%[4]。胰腺坏死形成与AP疾病严重程度直接相关,坏死继发感染是导致AP患者死亡的主要原因。当并发感染性胰腺坏死(infected pancreatic necrosis,IPN)时病死率可达50%~100%[5-6]。而IPN死通常在AP患者发病后第2~4周出现,也是导致患者死亡的第2个高峰期,如果不对其进行及时的干预和治疗,病死率几乎可达100%[7]。由此可见,胰腺坏死和感染的正确及时处理,对患者的预后具有显著的影响。对于IPN,传统的治疗手段通常直接行开腹清创引流进行治疗,近些年来,随着“微创”、“损失控制”等治疗理念的更新转变,IPN的微创治疗取得了较快进展,包括超声内镜(endoscopic ultrasound,EUS)引导下穿刺引流术、CT引导下置管引流、经腹膜后肾镜清创引流和经腹腔镜清创等方式均可降低开腹手术的病死率和并发症发生率[8-10]。EUS引导下穿刺引流术是目前国内外有关治疗IPN的最新微创技术。有报道[11]称,EUS引导下对IPN穿刺引流的成功率可高达93%,而且具有疗效显著、低复发率等特点,甚至在某些情况下可以替代外科手术治疗。但是,也有学者[12]认为EUS引导下穿刺引流治疗较大的IPN的疗效有限,担心因穿刺引流不彻底而错过了外科手术的最佳时间。如何选择病例、何时进行病灶引流,目前仍在积极研究当中。近几年,我院积极开展了EUS治疗技术,对部分AP并IPN的患者在EUS引导下行穿刺引流取得了良好的效果。本回顾性研究对EUS引导下穿刺引流术在治疗IPN的临床疗效及安全性方面进行探讨总结,旨在为临床应用提供参考。
1 资料与方法
1.1 研究对象
收集2013年1月—2018年12月于中南大学湘雅三医院肝胆胰外科行EUS引导下穿刺引流术的AP并IPN患者的临床资料。纳入标准:⑴ 年龄为20~80岁。⑵ 根据2014年急性胰腺炎诊治指南[13],符合其诊断标准,具备相关的临床表现和生化改变,并伴有局部并发症(急性胰周液体积聚、急性坏死物积聚、胰腺假性囊肿合并感染、包裹性坏死等)。⑶ 发病时间>4周,IPN所形成的肿块横向直径>4 cm;且内镜能够到达坏死灶。⑷ 腹部增强CT检查提示胰腺组织坏死伴炎症改变,实质增强后无强化,胰腺坏死组织区域内出现气泡征;经穿刺坏死病灶后留取标本送检行细菌学培养或病原体涂片分析,检验结果提示细菌或真菌感染。⑸ 患者的症状和体征发生明显改变或加剧、实验室相关指标显著异常,如:持续性高热、呼吸急促、持续性心动过速、出现胃肠道压迫症状、腹痛加剧、肠麻痹和腰背部疼痛等症状以及出现最为特征性的体征(上腹部或者全腹可触及明显压痛的包块)、白细胞计数明显升高和核左移、淀粉酶及肝肾功能等检验结果明显异常。⑹ 根据对患者治疗的选择,行EUS引导下穿刺引流术,临床资料完整可靠。排除标准:⑴ 年龄<20岁或>80岁。⑵ 术前罹患恶性肿瘤、免疫系统疾病、血液系统疾病以及严重的心脑血管疾病,如脑梗塞、脑出血,心脏病、心肌梗死等。⑶ 创伤性胰腺炎、腹部手术引起的胰腺炎、既往长期激素类或其他毒性药物服用史、吸毒史。⑷ 合并其他感染性、流行性疾病的患者。⑸ IPN所形成的肿块横向直径<4 cm,腹膜后、结肠旁沟等较深部位的感染坏死灶以及全胰腺及周围广泛区域坏死并感染的患者。⑹ 合并认知功能障碍,难以配合者。
最终纳入符合标准的AP并IPN的患者60例,患者的一般资料见表1。

表1 60例IPN患者的一般资料Table1 The general data of the 60 patients with IPN
1.2 设备和治疗方法
1.2.1 设备EUS主机、电子胃镜、Cook 19G超声穿刺针、Boston黄斑马导丝、囊肿切开刀、南京微创1.0 cm球囊扩张器、双猪尾塑料支架、南京微创双膨胀式覆膜金属支架、鼻胆管等。
1.2.2 手术过程患者取左侧卧位,口服利多卡因胶浆咽部局麻或行丙泊酚静脉麻醉后,在多普勒超声探头引导下进行EUS检查,在检查过程中密切观察患者生命体征,详细探查感染坏死灶的位置、大小、以及包膜是否完整等[7]。然后以靠近胃壁或者十二指肠壁且液化情况较好的坏死灶作为穿刺点,在穿刺病灶的操作过程中需注意回抽,观察有无明显出血,若抽出有灰色、黑色或褐色的脓性液体则表示穿刺成功。所有患者术中均抽取脓液或坏死灶作为标本,留取的标本需及时送检行常规生化、细菌学培养+病原体分析等检验,以便指导术后抗菌药物的使用。然后用斑马导丝顺着穿刺针方向置于脓腔或感染坏死病灶处,接着顺导丝用囊肿切开刀扩开穿刺点,再顺导丝使用球囊扩张器充分扩张穿刺道,然后将特定的支架或者鼻胆管顺导丝置入脓腔内,操作完成后再次确认穿刺点是否有明显出血、观察引流管是否通畅及支架位置是否放置准确无误。
手术后仔细观察引流管引流液的流量变化,性状和颜色并做好详细的记录,以便指导后续的临床治疗。应注意保持引流管的通畅,必要时给予适当的冲洗,需尽量避免引流管发生弯曲、折叠或脱落等意外发生。根据病原学和药敏试验结果,选择敏感的抗菌药物加强抗感染治疗;在后续的治疗过程中结合患者感染症状、CT复查结果以及引流管流量的变化情况予以综合评估,若患者出现感染症状无明显好转或是再次加重的迹象,或CT复查提示感染坏死灶的范围无缩小或有所扩大,或者坏死物较多、脓液黏稠并伴有大块未完全液化的坏死组织脱落,从而导致引流管堵塞,引流效果不好时可进一步行内镜下清创处理,最后根据患者的具体恢复情况择期取出支架或者拔除引流管(图1)。
1.3 观察项目
⑴ 一般资料:患者的性别、年龄组成、病因构成、感染性坏死部位、穿刺部位、感染细菌种类等。⑵ 观察指标:治疗前与治疗后7 d患者生命体征、腹腔内压(IAP)、疼痛评估视觉模拟评分系统(VAS)、急性生理学及慢性健康状况评分系统(APACHE Ⅱ)和多器官功能障碍评分(Marshall评分),记录患者治疗前及治疗后3、7 d的临床症状变化:包括发热、腹痛、腹胀、呕吐等,以及各项实验室检验指标:包括白细胞总数、C反应蛋白、降钙素原、血尿淀粉酶、血糖、血钙、总胆红素变化。并追踪患者治疗结果。⑶ 治疗效果[14]:治愈,患者的临床症状及体征完全消失,实验室检验相关指标(淀粉酶、脂肪酶)均提示已恢复正常,影像学检查提示胰腺功能基本正常,无并发症或并发症消失;好转,症状及体征出现明显缓解,检查提示发生并发症但无加重现象,如感染得到有效控制、坏死灶有缩小趋势但未完全消失;无效,患者症状及体征无好转甚至急剧加重,以及手术治疗效果欠佳或死亡。总有效率=(治愈+好转)/总例数×100%。并发症发生情况:消化道瘘(胰瘘、肠瘘)、消化道出血、穿孔、术后残余脓肿及器官功能障碍。⑷ 随访资料:随访从出院后2周开始,3年之内以死亡时间、疾病复发再次治疗以及最后1次随访作为截止时间,总随访时间为截止时间减去初始时间,按月来计算(>15 d作为1个月)。主要是通过电话、微信、门诊复查等方式随访,观察患者生活质量及疾病复发情况。

图1 EUS引导下穿刺引流 A:EUS引导下定位病灶;B:穿刺进针;C:导丝顺着穿刺针方向进入;D:导丝置于脓腔或感染坏死病灶处;E:球囊扩张器充分扩张穿刺道;F:鼻胆管顺导丝置入脓腔内Figure1 EUS-guided puncture and drainage A: Lesion positioning under EUS guidance; B: Puncture and needle insertion ; C: Entry of the wire along the direction of the puncture needle; D: Placement of the guide in the abscess or infected and necrotic lesions; E: Fully expansion of the puncture channel with a balloon dilator; F: Placement of the nasal bile duct in the abscess cavity
1.4 统计学处理
本研究所有资料数据均通过使用SPSS 22.0软件进行相关分析,其中计量指标以均数±标准差(±s)表示,患者治疗前后计量资料的对比使用t检验;计数指标以百分率表示,P<0.05认为差异有统计学意义。
2 结 果
2.1 治疗前后患者生命体征比较
60例患者经EUS引导下穿刺引流后,通过比较其在治疗前及治疗后第7天患者生命体征相关指标,发现生命体征渐趋于平稳,各项数据前后差异有统计学意义(均P<0.05)(表2)。
表2 治疗前后患者一般生命体征比较(±s)Table2 Comparison of the main vital signs of the patients before and after treatment (±s)

表2 治疗前后患者一般生命体征比较(±s)Table2 Comparison of the main vital signs of the patients before and after treatment (±s)
注:1)与治疗前比较,P<0.05Note: 1) P<0.05 vs. preoperative level
时间 体温(℃)呼吸(次/min)脉搏(次/min)血氧饱和度(%)治疗前 37.9±0.7 107.1±10.728.9±4.1 90.17±6.21治疗后 36.8±0.41)87.5±7.81) 17.4±3.31)98.22±1.281)
2.2 治疗前后IAP和临床评分比较
与治疗前相比较,经EUS下穿刺引流治疗后,患者发热、腹痛、腹胀、呕吐等临床症状得到明显缓解,患者IAP、VAS评分、APACHE II和Marshall评分均低于治疗前,差异有统计学意义(均P<0.05)(表3)。
表3 治疗前后IAP和相关临床评分比较(x-±s)Table3 Comparison of the IAP and relevant clinical scoresbefore and after treatment (±s)

表3 治疗前后IAP和相关临床评分比较(x-±s)Table3 Comparison of the IAP and relevant clinical scoresbefore and after treatment (±s)
注:1)与治疗前比较,P<0.05Note: 1) P<0.05 vs. preoperative level
时间 IAP(mmHg) VAS评分 APACHE II评分 Marshall评分治疗前 17.13±4.32 6.21±1.7 14.17±6.217.12±4.26治疗后 11.3±1.811)2.5±0.81)7.22±3.861)4.35±2.791)
2.3 治疗前后实验室指标的比较
60例患者经EUS引导下穿刺引流后,通过比较其在术前及术后3、7 d的白细胞总数、C-反应蛋白、降钙素原、血糖、血钙、血淀粉酶、尿淀粉酶以及总胆红素水平等指标,相比于术前均得到了明显改善,且差异有统计学意义(均P<0.05)(表4)。
表4 治疗前后检验指标的比较(±s)Table4 Comparison of the laboratory results before and after treatment (±s)
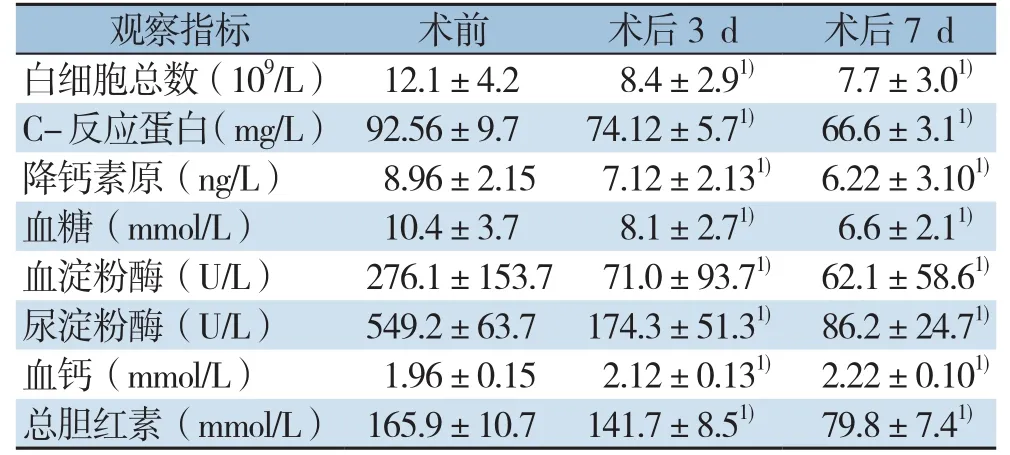
表4 治疗前后检验指标的比较(±s)Table4 Comparison of the laboratory results before and after treatment (±s)
注:1)与治疗前比较,P<0.05Note: 1) P<0.05 vs.preoperative level
观察指标 术前 术后3 d 术后7 d白细胞总数(109/L) 12.1±4.2 8.4±2.91) 7.7±3.01)C-反应蛋白(mg/L) 92.56±9.7 74.12±5.71) 66.6±3.11)降钙素原(ng/L) 8.96±2.15 7.12±2.131) 6.22±3.101)血糖(mmol/L) 10.4±3.7 8.1±2.71) 6.6±2.11)血淀粉酶(U/L) 276.1±153.7 71.0±93.71) 62.1±58.61)尿淀粉酶(U/L) 549.2±63.7 174.3±51.31) 86.2±24.71)血钙(mmol/L) 1.96±0.15 2.12±0.131) 2.22±0.101)总胆红素(mmol/L) 165.9±10.7 141.7±8.51) 79.8±7.41)
2.4 临床疗效
经EUS引导下穿刺引流和积极治疗后,60例患者中治愈10例(16.7%),明显好转46例(76.6%),其总有效率达到93.3%,无效4例(6.7%),后进行了多次手术干预治疗,3例死亡。
2.5 并发症及其相关处理
术后出现严重并发症消化道瘘4例(胰内瘘3例,肠外瘘1例),肠穿孔3例,消化道出血3例,发生率16.7%(10/60)。3例发生胰内瘘患者,经充分引流、控制感染和积极治疗后胰瘘自愈;1例肠外瘘患者经进一步在腹腔镜下行坏死组织清创术获得好转;3例出血患者,其中2例经输血、补液等积极对症处理后出血停止,1例患者则经内镜下止血成功;3例患者发生肠穿孔后进行了多次手术干预治疗均康复出院,无手术相关的死亡。
2.6 出院后随访
60例患者中失访4例,随访56例,随访率93.3%。其中34例(60.7%)患者复查CT发现坏死灶基本吸收,临床症状消失、实验室检验指标无明显异常;10例患者半年内胰腺炎复发再次住院,其中6例为胆结石未做进一步处理所致,4例为高脂血症原因所致;4例死亡,其中1例患者出院后1个月内因脓毒血症感染未得到有效控制以及合并多器官功能衰竭导致死亡;7例患者复查CT发现胰腺有钙化,胰管不同程度地扩张呈串珠样改变并伴有胰腺外分泌功能不全,需长期补充胰酶制剂。
3 讨 论
EUS引导穿刺引流胰腺坏死组织清除术已被证明是SAP合并IPN安全有效的微创治疗方法[15-17]。有研究[18-22]报道对于IPN,EUS下穿刺引流相比传统的直接开腹手术,在缩短住院时间、改善术后生活质量等方面却更有优势,故而认为在临床上值得推广。临床上SAP合并IPN,EUS引导下穿刺成功率可达90.9%~98.8%,这为临床应用提供了安全保证[23-25]。对于合并IPN的SAP患者,传统的治疗方法是通过外科手术对胰腺坏死组织进行清创,但其创伤大、住院周期长、并发症发生率及病死率较高。研究[26-28]报道实施开腹坏死组织清创引流术后病死率可达11.4%~30.0%。近年来,随着治疗性内镜技术的发展,特别是以EUS引导下SAP并发IPN引流清创术、胰腺假性囊肿穿刺引流术等为代表的新NOTES技术,对胰腺或胰周坏死组织进行清创引流,显著改善SAP并发IPN的疗效。美国的一项多中心研究[29],对104例包裹性胰腺坏死实施内镜直视下坏死组织清除术(DEN),结果显示有效缓解率达91%。本研究中60例患者在EUS引导下均一次性成功放置了支架、鼻胆管引流,其中经胃内镜下引流43例,经十二指肠治疗为17例,两种引流方式在术后3 d和7 d的白细胞总数、C反应蛋白、降钙素原、血糖、血钙、血淀粉酶、尿淀粉酶以及总胆红素水平等AP炎症及感染监测指标相比术前均得到了明显改善,说明患者的感染及炎症得到了有效控制,显示EUS引导下穿刺引流对于SAP并发IPN患者的处理有较好的疗效。
对于SAP并IPN的患者,其治疗不论是采用微创方式或是传统的外科开腹手术清创治疗,都可能引起相关并发症。国内外研究[23-25,29-30]报道EUS直视下坏死组织清除术并发症发生率4.6%~25%。本研究中术后出现严重并发症胰内瘘3例,肠外瘘1例,肠穿孔3例,出血3例,发生率16.7%,与国外报道发生率接近。感染作为多数操作的常见并发症,通常难以避免,而行 EUS 引导下穿刺引流可减少囊内感染的发生[31],术前预防性使用广谱及高效的抗菌药物,术中操作精细减少损伤、术后加强相关护理等都能尽量降低这一常见并发症的发生,从而达到预防的目的[32],术前详细了解患者病情,完善术前准备、术中操作精细对减少穿孔和消化道瘘等并发症的发生均有一定帮助。
本研究中60例患者经E U S引导下穿刺引流后,治愈10例(16.7%),明显好转46例(76.6%),其总有效率达到93.3%,与上述国外报道疗效结果接近,余4例(6.7%)引流无效患者后进行了多次手术干预治疗,2例因心肺功能衰竭死亡,1例家属放弃,1例好转出院。2018年最新发表的一项纳入1980例患者微创及EUS与开腹的胰腺坏死组织清除的研究[33]报道,EUS等微创术式相比开腹坏死组织清除术,可降低患者病死率。本研究中无1例与手术相关的死亡病例,与国外研究报道相符,说明临床疗效确切。在术后随访中,有34例(60.7%)患者复查CT发现坏死灶基本吸收,临床症状消失、实验室检验指标无明显异常,随访中长期疗效均较好。综上所述,EUS引导下穿刺引流术在治疗SAP合并IPN方面,具有较好的临床疗效和较好的安全性,在IPN的临床治疗中,值得临床推广、应用。
诚然,本研究尚存在一些不足。首先,本次研究为单中心的回顾性分析,而非多中心的前瞻性研究,可受多种因素干扰而影响结论的准确性;其次,在筛选患者时可能产生选择性偏倚,也受制于个人的临床经验和治疗观念的影响;再者,本次研究纳入的样本总量偏少,对研究结果的准确性可能会产生一定的影响。因此,还需要进行多中心、随机性及前瞻性的临床治疗观察和研究来提供更客观和高质量的依据。

