表皮生长因子受体在胶质母细胞瘤中的表达及其与患者预后的关系*
周修明, 徐静, 陈旭娜, 何桂录, 马宇强, 赵华福, 李维平, 刘文兰, 陈保东△
1安徽医科大学深圳二院临床学院(广东深圳 518035); 2深圳市第二人民医院神经外科(广东深圳 518035); 3广州中医药大学深圳医院检验科(广东深圳 518034)
胶质母细胞瘤(glioblastoma multiforme, GBM)是预后较差的脑肿瘤之一,具有增殖性强,侵袭性高,及对常规治疗耐受的特点[1]。现如今对于GBM,临床主要通过手术切除肉眼可见范围肿瘤组织,并选择性切除少许临近肉眼正常组织,术后辅以放化疗,靶向治疗等方式对患者进行治疗[2]。然而摆在外科医生面前的一大难题就是GBM患者预后较差,标准治疗方案治疗后中位生存期仍只有14.6个月左右[3]。现在有很多与GBM相关的分子靶向药物被科研人员一一开发,然而目前对GBM更深层次的研究仍然不够充分。表皮生长因子受体(epidermal growth factor receptor,EGFR)是表皮生长因子细胞增殖和信号传导的受体[4]。研究表明许多实体瘤存在EGFR的异常表达[5]。EGFR与肿瘤细胞的增殖、侵袭、转移及细胞凋亡的抑制有关[6]。而众多相关的数据都可以在癌症基因组图谱中查到[7]。本研究通过对TCGA数据库中EGFR的表达与GBM患者预后的关系,以及对本院42例GBM样本、2例Ⅰ级胶质瘤和4例对照样本的分析来研究EGFR对GBM患者预后的评估价值。
1 资料与方法
1.1 一般资料 本研究共纳入我院2016年1月至2017年1月42例GBM样本、2例Ⅰ级胶质瘤和4例对照组样本,并从我院病例系统中收集患者年龄、性别、临床症状、切除部位及病理类型的数据。纳入标准:GBM样本选取首次确诊为GBM且经病理证实的患者,Ⅰ级胶质瘤患者选取首次确诊为Ⅰ级胶质瘤且经病理证实的患者。对照组为我院外伤及癫痫患者的病变样本。排除标准:排除儿童患者。肿瘤的病理分型等数据同时由两名神经外科医生独立判断。本研究及收集的患者病理标本由我院伦理委员会批准。
1.2 方法
1.2.1 总RNA提取 本研究使用Trizol法提取总RNA。先将组织在液氮中能研磨成粉末,再以50~100 mg组织加入1 mL Trizol液研磨。研磨液室温放置5 min,以每毫升Trizol液加入0.2 mL的比例加入氯仿,盖紧离心管后振荡15 s。取上层水相于新离心管,按照每毫升Trizol液加0.5 mL异丙醇比例加入异丙醇,室温放置10 min后12 000×g离心10 min。弃去上清液并按照每毫升Trizol液加入至少1 mL的比例加入75%乙醇,混匀后4℃下离心5 min。弃去上清液后室温干燥10 min,再将其溶于水中即为总RNA。
1.2.2 cDNA合成 使用RNA逆转录酶与相应引物,通过oligo(dT)短片段合成cDNA的第一条链。再以mRNA杂交体作为切口平移的模板,RNA酶H在杂交体的mRNA链上造成切口和缺口,产生一系列RNA引物,在大肠杆菌DNA聚合酶Ⅰ的作用下合成cDNA的第二条链。将cDNA保存在-80℃冰箱中保存。
1.2.3 实时聚合酶链反应 本实验使用华大基因公司的EGFR引物,正向序列5′-TCCTCGATGAAGCCTACGTGATGG-3′,反向序列5′-AAGCGACGGTCCTCCAAGTAGTT-3′。使用Roche公司的FastStart Universal SYBR Green Master(ROX)试剂。首先将试剂溶解保存于冰上,在16 μL的单个PCR反应体系中依次加入8 μL FastStart Universal SYBR Green Master(ROX),0.5 μL正向引物,0.5 μL反向引物,6.6 μL PCR等级的水,混匀。将15.6 μL混合液吸取至PCR微孔板中。加入0.4 μL的DNA模板,小心混匀。将微孔板置于real-time PCR 7500仪器中,95℃变性15 s,60℃退火并延长1 min,完成40个循环,同时检测引物效率。
以EGFR为目的基因,GAPDH为内参基因。计算基因差异表达的倍数,计算公式为2-ΔΔCt,其中ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组-ΔCt对照组。将PCR结果中2-ΔΔCt值>2设置为EGFR高表达组,2-ΔΔCt值≤2设置为非EGFR高表达组。
1.2.4 TCGA数据库样本筛选 TCGA数据库中筛选2017年当年录入患者,年龄>25岁,且为初发GBM,对录入的患者进行EGFR关联蛋白网络、拷贝数、无进展生存期和总生存率的分析。
1.3 统计学方法 使用SPSS 20.0和GraphPad Prism 6.0软件分析实验结果。通过非配对t检验评估表达差异性,Pearson2检验和连续性校正的2检验比对临床数据特征,log-rank检验评价生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 GBM患者临床病理特征与EGFR表达的相关性分析 按照年龄、性别、是否存活及是否复发分组,EGFR高表达组与低表达组现存活患者生存期均值分别为26.1和27.1个月,死亡患者生存期均值分别为18.7和13.0个月。分析后发现EGFR高表达组和非高表达组与年龄、性别、存活和复发均无关(P>0.05)。见表1。
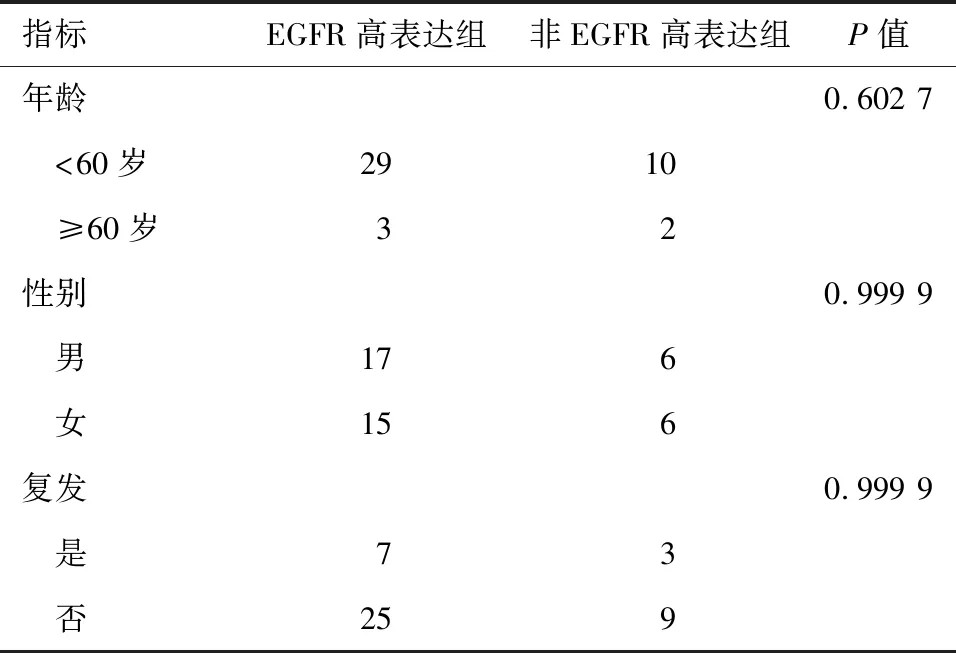
表1 GBM患者临床病理特征与EGFR表达的相关性例
2.2 44例GBM患者EGFR的PCR结果及分析 4例对照组的2-ΔΔCt值均<6,GBM样本的2-ΔΔCt值分布在0~500范围内。GBM组2-ΔΔCt值均值明显高于对照组(图1)。根据先前收集的患者资料及随访结果,对患者的生存时间进行统计(图2),但可能由于手术效果及样本量原因,本院患者生存时间明显高于数据库中的14个月平均生存期,而从两组生存时间差异角度比较,两组之间差异无统计学意义(P>0.05)。
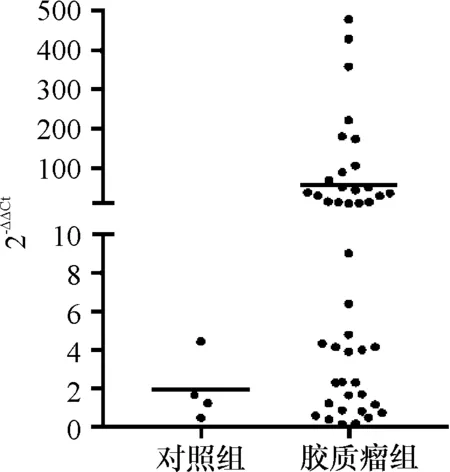
图1 GBM患者EGFR的表达
2.3 TCGA数据库中EGFR表达情况及其关联网络 本研究筛选TCGA数据库中520个样本的EGFR mRNA表达情况进行分析。二倍体几乎无突变,相比之下高表达的样本中有大量错义突变(图3)。EGFR与BIK3CA、PTEN、LAT2、P3GFA、FGF6、STAT6、EPHB3、AP2M1、SH3GL2、ACTA2、FGF23、CPSF6、LAT2等蛋白有紧密联系(图4)。

图2 44例GBM患者的生存曲线

图3 TCGA数据库中EGFR拷贝数变化
2.4 TCGA数据库中EGFR表达与预后的关系 根据TCGA数据库资料分析得出,GBM平均存活时间只有14个月,无论是EGFR高表达还是非高表达,30个月后其生存率已非常低,在纳入分析的TCGA数据库的520个病例中,402例患者已死亡。而通过对TCGA数据库中两组总生存率对比,EGFR高表达组明显低于非EGFR高表达组(log-rank检验P=0.003 64)。然而,对于无进展生存时间差异的分析发现,两组之间无进展生存时间之间差异无统计学差异(log-rank检验P=0.163)(图5)。

图4 TCGA数据库中EGFR关联蛋白网络

A:总生存曲线;B:无进展生存曲线
2.5 本组病例与TCGA数据库数据对比 通过对我院44例GBM的分析,进一步证实了520例TCGA数据库中EGFR在GBM中高表达的结果。但在生存期方面,由于样本量有限,暂时没有未发现差异有统计学,而TCGA数据库中两组总生存率对比,EGFR高表达组明显低于非EGFR高表达组(log-rank检验P=0.003 64),无进展生存时间差异无统计学意义(log-rank检验P=0.163)。
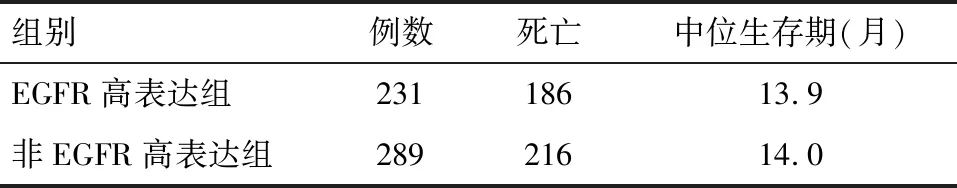
表2 TCGA数据库中EGFR高表达组与非高表达组中位生存期
3 讨论
目前临床对于GBM患者采用以手术切除为主,放化疗为辅的综合治疗方法[8]。然而,虽然GBM患者的中位生存期得到延长,但近年来仍未发现更好的治疗方法[9]。现如今,分子靶向治疗和免疫治疗在临床越来越受到重视,但临床实际开展的项目较少[10]。我院针对少量GBM患者开展CAR-T治疗,其疗效正进一步观察中。
EGFR在许多实体瘤异常表达,其与肿瘤细胞的增殖、侵袭、转移及细胞凋亡的抑制有关[11-12]。本研究旨在探索EGFR作为胶质瘤的致病因素,在肿瘤的发生发展过程中起关键作用。在TCGA数据库中我们研究了520例胶质瘤患者,对他们已录入TCGA数据库的数据进行分析,并在本院40余例临床标本中进一步证实。除了GBM患者的样本分析,本实验室在其他级别胶质瘤中也对EGFR进行初步分析,发现其表达可能与胶质瘤级别相关。目前,GBM根据基因表达谱可以分为4型:前神经元型(26%)、神经元型(17%)、经典型(27%)及间质型(29%)[13-14]。不同分型预后不同,而在不同分型中EGFR的表达水平也不尽相同,这提示GBM中EGFR的表达可能与不同分子分型及预后相关[15]。TCGA数据库中对于不同EGFR扩增水平的患者标本进行分析,发现EGFR高表达组,其患者预后要明显差于非EGFR高表达组,这提示EGFR表达与患者预后相关。而针对这一改变,可能是EGFR的扩增使其蛋白表达水平升高,进而影响下游相关信号通路,从而对GBM的生长、侵袭、迁移和凋亡等细胞过程产生决定性影响。从本研究的分析来看,EGFR与BIK3CA、PTEN、LAT2、P3GFA、FGF6、STAT6、EPHB3等密切相关,因此与之相关的蛋白可能是EGFR上下游的信号通路上的蛋白[16],后续进一步的研究可以从这一系列蛋白着手,例如EGFR的扩增通常伴随着PTEN的扩增,那么二者之间是否有相应信号通路相互作用,影响GBM的生长、凋亡与耐药等。
我院近年来收治了非常多的胶质瘤患者,通过不断对患者术后情况进行随访以及对患者术后标本的分析研究,以期能进一步探寻GBM的分子机制和关键靶点。GBM是胶质瘤中恶性度最高,预后最差,平均生存期最短的肿瘤。本研究对44例GBM的分析,与TCGA数据库中EGFR在GBM中高表达的结果基本一致,但在生存期方面,由于样本量有限,暂时没有发现统计学上的差异。
总而言之,EGFR在GBM中异常表达,且作为独立因素对患者预后有明显影响。因此EGFR可能在GBM中起到至关重要的作用,而以EGFR蛋白及其相互关联蛋白为突破口,可以进一步对GBM的发生发展有更进一步的了解,并通过对其分子机制的进一步研究来改变其迁移、侵袭及耐药等特性,以期望能找到更好的治疗方法并有效改善胶质瘤患者预后。

