响应面法提高植物乳酸菌和嗜酸乳杆菌发酵椰奶的活菌数
谢雨婷,宋明慧,马毛毛,陈茏,杨俊,文学方,3,曽哲灵,3,余平,3*
1(南昌大学 食品学院,江西 南昌,330031) 2(南昌大学 资源环境与化工学院,江西 南昌,330031) 3(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330047)
椰子是热带主要果品之一,椰奶中富含中碳链甘油三酯[1-3]、低聚糖[4]、植物蛋白[5]、锌、钙、铁等对人体有益的微量元素[6]和多种必需氨基酸[7],且不含乳糖,具有快速提供能量,益气生津,祛暑解渴[8]的功能。目前市场上的椰子饮品主要是椰子原汁饮料和风味酸奶,因其特有的浓郁椰香、圆润口感而广受消费者喜爱,而针对椰奶的益生菌风味饮品的开发研究较少[9-10]。椰汁富含利于乳酸菌生长的天然营养物质,可提供优良的发酵环境[8, 11-13]。植物乳杆菌与嗜酸乳杆菌可共生定殖于人体肠道而改善机体健康[10-17]。相比较于传统单一的椰子榨汁饮料及市场上常用的嗜热链球菌与乳酸杆菌的菌种配方,选用嗜酸乳杆菌与植物乳杆菌对新鲜椰奶进行混合发酵,将产生全新的风味[18-19],酸味口感更强,不仅胆固醇含量更低[20],营养物质更利于人体吸收[11]。因此,本实验通过优化椰奶发酵条件,为研制出具高活菌数的益生菌饮料提供支持。
1 材料与方法
1.1 实验材料与试剂
新鲜椰子,购于海南文昌;嗜酸乳杆菌(Lactobacillusacidophilus)与植物乳杆菌(Lactobacillusplantrum),中国工业微生物菌种保藏管理中心(CICC);葡萄糖和蔗糖(市售,食品级);乳酸杆菌琼脂培养基与乳酸杆菌肉汤培养基,北京索莱宝科技有限公司。
1.2 实验仪器与设备
冷冻干燥机(FD-1),北京德天佑科技发展有限公司;恒温培养振荡器(UZWY-2102C),上海智城分析仪器制造有限公司;紫外可见分光光度计(TU-1950),北京普析通用仪器有限责任公司;电子天平(BSA223S),赛多利斯科学仪器(北京)有限公司;电热恒温鼓风干燥箱(DHG-9101-2SA),上海鸿都电子科技有限公司;低速大容量多管离心机(LXJ-IIB),上海安亭科学仪器厂;电热恒温水浴锅(XMTE-8112),上海精宏实验设备有限公司;循环水式多用真空泵(SHB-III),武汉世纪超杰实验仪器有限公司;九阳多功能榨汁机(JYL-C022E),九阳股份有限公司;胶体磨(CRM-50),廊坊市成瑞机械设备有限公司;立式压力蒸汽灭菌器(YXQ-LS),上海博讯实业有限公司医疗设备厂;电热恒温培养箱(SKP-02.420),黄石市恒丰医疗器械有限公司
1.3 实验方法
1.3.1 椰子预处理工艺流程

1.3.2 椰奶制备
取新鲜椰子引流出椰子水,再开椰壳取椰肉,以质量比1∶3加入蒸馏水榨汁,过滤后与椰子水混合,经均质过滤制得新鲜椰奶,呈均匀乳白色,具浓郁椰香,储存于4 ℃冰箱。
1.3.3 前调配及灭菌
根据嗜酸乳杆菌和植物乳杆菌的最优碳源[21-23],选择蔗糖及葡萄糖为前调配辅料[24-25],根据酸甜口感适量添加。90 ℃,灭菌10 min[8-9]。
1.3.4 菌种活化
商用菌种干粉先用乳酸杆菌肉汤培养基溶解,混匀,在乳酸杆菌琼脂培养基划线培养,挑取单菌落于乳酸杆菌肉汤培养基中扩培,37 ℃活化12 h,活化2~3次。取一部分活化后菌液与30%甘油等体积混合均匀,分管保存于-20 ℃。
1.3.5 菌粉及菌液制备
取另一部分活化的种子液加入3 L乳酸杆菌肉汤培养基中扩培16 h,随后将菌液在4 000 r/min离心10 min,弃上清取菌泥,加入保护剂配方[26],于-80 ℃预冻4 h,再真空冷冻干燥48 h。采用平板稀释涂布法测定菌粉活菌数[27],其中嗜酸乳杆菌菌粉菌含量达1.8×109CFU/g,植物乳杆菌菌粉菌含量达2.4×109CFU/g。
以灭菌生理盐水溶解菌粉,适当稀释后使菌悬液菌体浓度为108CFU/mL,用于椰奶发酵接种。
1.3.6 单因素实验
以活菌数为评价指标,分别对发酵温度35、37、39、41、43和45 ℃,发酵时间14、16、18、20、22和24 h,接种量1.5%、3%、4.5%、6%、7.5%、9%与植物乳杆菌与嗜酸乳杆菌添加比例(Z/S)为0.5、1、1.5、2、2.5进行单因素实验,采用平板计数法稀释涂布,在37 ℃下培养48 h,观察并记录总菌数,确定各因素的影响效果与适宜范围。
1.3.7 响应面法实验因素水平设计
以单因素实验结果为基础,采用Design expert-8软件应用Box-Behnken设计方法,选择发酵温度(A)、发酵时间(B)、接种量(C)、菌比例(D)作为响应变量,编码水平为-1、0和1,且以活菌数(Y)作为响应值,对椰奶的发酵条件进行优化。
2 结果与分析
2.1 单因素实验
2.1.1 发酵温度对发酵椰奶的活菌数的影响
取若干洁净干燥的50 mL灭菌锥形瓶编号,分别加入30 mL的灭菌椰奶,适量灭菌糖液,接种等量混合菌液后,分别在35、37、39、41、43、45 ℃下恒温培养20 h后,采用平板计数法稀释涂布,在37 ℃下培养48 h,观察并记录总菌数,结果如图1所示。

图1 发酵温度对发酵椰奶活菌数的影响
Fig.1 Effects of fermentation temperature on viable count of the coconut milk beverage注:不同字母表示组间差异显著(P<0.05),下同。
由图1可以看出,37~43 ℃是嗜酸乳杆菌和植物乳杆菌的较适生长温度范围,乳杆菌生长旺盛;39 ℃时总活菌数达到最高,随后发酵温度继续增加,饮料活菌数下降;45 ℃时,菌种生长受明显抑制。可能是由于在适当的范围内温度升高有利于催化各种酶反应[28-29],提高了乳杆菌增殖速率和发酵产酸速率[1]。因此,基于能量及活菌数的优化考虑,选用发酵温度为39 ℃为椰奶益生菌饮料最佳发酵温度。
2.1.2 发酵时间对发酵椰奶活菌数的影响
取若干洁净干燥的50 mL灭菌锥形瓶编号,分别加入30 mL的灭菌椰奶、适量灭菌糖液,接种等量混合菌液后,在37 ℃下分别恒温培养14、16、18、20、22和24 h,采用平板计数法稀释涂布,将涂布后的平板在37 ℃下培养48 h,观察并记录总菌数,结果如图2所示。

图2 发酵时间对发酵椰奶活菌数的影响
Fig.2 Effects of fermentation time on viable count of the coconut milk beverage
由图2可以看出,随着发酵时间的增加,椰奶中的乳杆菌大量增加,18 h时,活菌数达到最大,随后趋于平缓,再逐渐下降。这可能是因为起初随着时间增加,营养物质充足,乳杆菌繁殖加快,菌数升高;而随着时间延长,饮料中的营养物质消耗过多,限制了乳杆菌的生长,其死亡速率超过增殖速率,因此菌数在保持稳定后逐渐下降[3, 13,28,30]。综合考虑,选择发酵时间为18 h。
2.1.3 接种量对发酵椰奶的活菌数的影响
取若干洁净干燥的50 mL灭菌锥形瓶编号,分别加入30 mL的灭菌椰奶、适量灭菌糖液,分别接种1.5%、3.0%、4.5%、6%、7.5%、9%的混合菌液,在37 ℃下恒温培养20 h,采用平板计数法稀释涂布,在37 ℃下培养48 h,观察并记录总菌数,结果如图3所示。

图3 接种量对发酵椰奶活菌数的影响
Fig.3 Effects of f inoculation quantity on viable countof the coconut milk beverage
从图3可知,随着接种量的增加,椰奶发酵饮料活菌数呈现逐渐增加的趋势,当接种量为7.5%时,活菌数达最大值且随后趋于平缓。这是由于随着乳杆菌数的增加,乳杆菌对底物利用加快,增殖速率加快;而在有限的发酵营养环境内,乳杆菌对底物的利用水平有限,其增殖速率达到最大值后趋于稳定[31]。因此,基于菌成本和活菌数优化的考虑,选择椰奶发酵饮料的最佳接种量为7.5%。
2.1.4 菌种添加比例对发酵椰奶活菌数的影响
取若干洁净干燥的50 mL灭菌锥形瓶编号,分别加入30 mL的灭菌椰奶、适量灭菌糖液,接种菌比例(Z/S)分别0.5、1.0、1.5、2.0和2.5的等量混合菌液后,在37 ℃下恒温培养20 h,采用平板计数法稀释涂布,在37 ℃下培养48 h,观察并记录总菌数,结果如图4所示。

图4 菌比例(Z/S)对发酵椰奶活菌数的影响
Fig.4 Effects of f bacteria ratio(Lactobacillus plantarum/Lactobacillus acidophilus)on viable count of the coconut milk beverage
由图4可知,随着菌比例(Z/S)的增加,椰奶益生菌饮料活菌含量先增加后减少,当菌比例(Z/S)为1~1.75时,饮料活菌含量保持较高的水平;当菌比例(Z/S)为1.5时活菌数达到最大值,继续增加菌比例(Z/S),活菌含量下降。这可能是因为当植物乳杆菌与嗜酸乳杆菌的比例接近时,产生的竞争抑制较小,对营养底物的利用实现较平衡的优化,由于嗜酸乳杆菌产酸及耐酸综合能力更强[32-33],因此,选择菌比例为(Z/S)为1.5。
2.2 Box-Behnken实验设计
2.2.1 根据单因素实验结果
响应面实验因素编码及水平设计见表1。

表1 响应曲面实验因素水平设计
2.2.2 模型建立与显著性检验
综合单因素结果,选择发酵温度(A)、发酵时间(B)、接种量(C)、菌比例(Z/S)(D)4个因素,通过4因素3水平的Box-Behnken实验设计和响应面分析方法,确定椰奶发酵最佳工艺条件,所得实验方案与结果见表2。
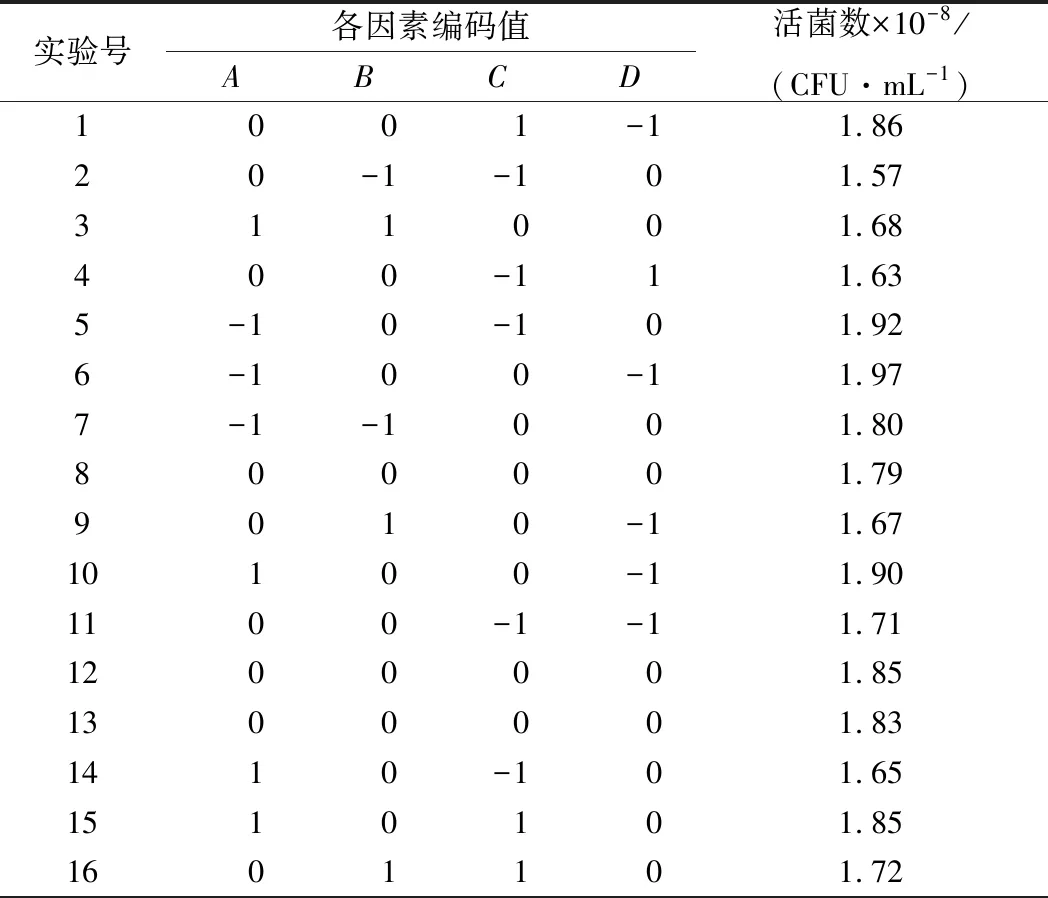
表2 响应面分析实验方案与结果
续表2

实验号各因素编码值ABCD活菌数×10-8/(CFU·mL-1)1700111.8018-10102.211901011.762001-101.82210-1101.82220-1101.76231-1001.7724-10012.2025-11002.332610011.572700001.852800001.81290-1011.56
以活菌数(Y)为响应值,应用Design expert-8软件进行多元回归拟合分析,各实验因素对响应值的影响可用如下多元二次回归方程表示:
Y=1.83-0.17A+0.058B+0.080C-0.029D-0.16AB-0.023AC-0.14AD-0.088BC+0.072AD+5.000E-003CD+0.13A2-0.070B2-0.031C2-0.054D2
(1)
2.2.3 响应因素水平的优化及模型验证
通过Design expert-8软件分析得到椰奶发酵的最佳条件为:发酵温度(A)为41 ℃、发酵时间(B)为18 h、接种量(C)为9%、菌比例(Z/S)(D)为1。采用此优化条件进行发酵椰奶验证实验,重复3次,椰奶饮料活菌数含量达2.011×108CFU/mL,与预测值相近,重复性好,表明此模型能较好地优化得到椰奶发酵最佳条件。

表3 响应面分析实验方差分析结果
续表3

方差来源自由度平方和均方F值P值显著性D210.0190.0197.220.017 7∗残差140.0372.614E-003失拟项100.0343.423E-0035.800.052 5残差140.0372.61E-03失拟项100.0343.42E-035.80.0525纯误差42.362×10-35.904×10-4总和280.930.064R2=96.08%RMSE=0.051CV=2.81
由表3可知,该模型效应极显著(P<0.01)。该模型的决定系数为96.08%,修正决定系数为92.16%;模型的变异系数CV=2.81,模型变异较小;模型的失拟项差异不显著,说明回归方程拟合程度高,可用于椰奶发酵条件的优化。该模型的一次项A、C、二次项A2和AB、AD是极显著项,B、BC、B2和D2是显著项,其他为非显著项。因素D的P值为0.069 6>0.05,说明菌比例(Z/S)对活菌数影响不显著。影响椰奶发酵优化条件的因素顺序为:发酵温度>接种量>发酵时间>菌比例(Z/S)。
3 结论
本文对发酵椰奶活菌数条件进行了响应面优化。以新鲜椰子为原料,嗜酸乳杆菌和植物乳杆菌为菌种,优化椰奶发酵饮料活菌数最佳工艺条件为:发酵温度为41 ℃、发酵时间为18 h、接种量为9%、菌比例(Z/S)为1,椰奶饮料活菌数含量达2.011×108CFU/mL。现行国标中关于活性乳酸菌数值的指标要求为出厂时不小于100万个/mL,远低于1 000万个/mL的国际标准。该款椰奶饮料活菌数不仅远高于市场标准,也达到了国际乳酸菌类饮料活菌数标准。另外,发酵后的椰奶保留了较纯正的椰香,颜色偏乳白色,口感细腻,质地均匀,有利于进一步市场利用与开发。
由于本款椰奶发酵饮料仅添加了蔗糖与葡萄糖做辅料,口味纯正较单一,酸味强,发酵终点pH在3.32~3.49,在实际生产中,可将在此条件下发酵的椰奶适当稀释,有利于降低成本,提高经济效益;另外,可针对市场需求,添加多种不同辅料以创新更丰富的口感。综上所述,本文针对椰奶益生菌饮料生产工艺的活菌数优化实验,对开发椰奶发酵产品提供了良好的参考意义及广阔的市场前景。

