利用响应面法优化发酵乳杆菌AR497电转化条件
韦云莹,赵燕,庄金伟,李江,帕米拉·乃则木丁,陆祎晟,艾连中,熊智强
(上海理工大学 医疗器械与食品学院,上海食品微生物工程研究中心,上海,200093)
发酵乳杆菌(Lactobacillusfermentum)是一种异型发酵乳酸菌,在发酵食品的制作和功效方面具有特殊作用,还具有众多益生功能[1-3]。目前对发酵乳杆菌益生作用研究主要集中在胃肠道的耐受性、抗菌活性、降胆固醇、增强免疫活性[4-5]、抗氧化、缓解肝脏和肠道损伤等方面[6]。这些益生功能与发酵乳杆菌相关基因的调控密不可分,而基因的调控和功能研究依赖于菌株遗传操作的建立和发展。因此,确定最佳电转化条件是建立发酵乳杆菌遗传体系的前提。发酵乳杆菌AR497是本实验室前期筛选出的1株能有效改善小鼠肠炎的乳酸菌,为研究其抗炎机理和解析抗炎相关基因,建立高效的电转化方法至关重要。
由于目前报道的乳酸菌电转化方法不能成功应用于AR497中,本研究首先建立了发酵乳杆菌AR497的电转化方法,采用Plackett-Burman试验筛选出电转化方法中的关键因素,利用响应面试验对关键因素进行优化,确定最优电转化条件。
1 材料与方法
1.1 材料与培养基
1.1.1 菌株与质粒
实验所用的菌株与质粒如表1所示。
1.1.2 培养基
MRS培养基:用于AR497的活化、培养和活菌计数。LB培养基:用于E.coli的培养。MRSMC1复苏培养基:含有0.8 mol/L山梨醇的MRS培养基。MRSMC2复苏培养基:含有0.8 mol/L山梨醇,2 mmol/L CaCl2,20 mmol/L MgCl2的MRS培养基。MRSMC3复苏培养基:含有0.8 mol/L蔗糖的MRS培养基。MRSMC4复苏培养基:含有0.8 mol/L蔗糖,2 mmol/L CaCl2,20 mmol/L MgCl2的MRS培养基。
1.2 发酵乳杆菌AR497感受态制备方法
MRS液体培养过夜,3%接种量接种至含质量浓度20 g/L甘氨酸的MRS液体培养基至OD600为0.3~0.4。 4 ℃,4 000×g离心弃上清,体积分数为10%甘油洗涤2次并重悬分装[7]。每管分装100 μL保藏-80 ℃,电转化备用。
1.3 发酵乳杆菌AR497感受态效率检测及鉴定方法
取一定量质粒与100 μL感受态细胞混匀,迅速转入预冷无菌的电转杯中,设置好电转参数后电击。电击完毕后,立即加入900 μL液体复苏培养基,37 ℃静置4 h后涂布抗性平板,37 ℃倒置培养48 h后,观察并记录转化子个数。挑取上述转化子进行菌落PCR鉴定,采用引物Cm-F(5’-ggaggcatatcaaatgaactttaataaaattgatttagac-3’)/Cm-R(5’-attatctcatattataaaagccagtcattaggcc-3’)进行PCR扩增氯霉素抗性基因。同时做阴性对照(以AR497为模板)和阳性对照(以质粒pNZ44为模板),琼脂糖凝胶电泳鉴定PCR产物。实验3次重复。根据加入质粒的量,计算每微克质粒所得转化子的数目,计算如公式(1)所示:
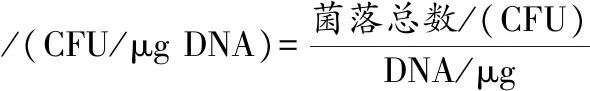
(1)
1.4 单因素试验对电转化效率的影响
其他步骤不变的情况下,选择不同的洗涤缓冲液来洗涤感受态细胞,比较电转化效率,确定合适的洗涤缓冲液。
在获得最佳洗涤缓冲液的基础上制备感受态,分别将质量浓度10、20、40、60、80、100 ng/μL的pNZ44质粒电转到发酵乳杆菌AR497感受态中,观察不同质粒浓度对电转化效率的影响,确定最佳质粒质量浓度。
将制备好的感受态在相同条件下电击,选择不同复苏培养基(MRSMC)在相同的时间里复苏细胞。比较电转化效率,确定合适的复苏培养基。
1.5 Plackett-Burman 试验设计
选择甘氨酸质量浓度、OD600、电场强度、复苏时间和山梨醇浓度为考察因素,利用Minitab软件设计15次PB试验,进行关键因素筛选。结合前期试验结果分别设每个因素高低2个水平。因素水平见表2。
1.6 最陡爬坡试验设计
根据Plackett-Buman试验结果,对筛选得出的关键因素进行合理设计,正效应的关键因素其梯度为递增,负效应的关键因素其梯度为递减,测定发酵乳杆菌AR497的电转化效率,寻找最优电转化效率区域。
1.7 Box-Behnken响应面优化试验设计
对发酵乳杆菌AR497电转化条件的关键因素作进一步优化,获得其最佳电转化效率。Box-Behnken设计见表3。
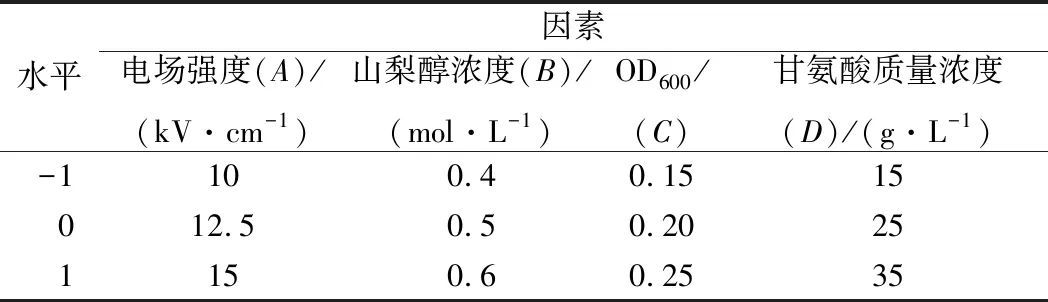
表3 Box-Behnken 响应面试验因素水平和编码
2 结果与分析
2.1 发酵乳杆菌AR497电转化方法的筛选
前期利用纸片法对发酵乳杆菌AR497进行耐药性评价[8],发现AR497对氨苄西林、阿莫西林、米诺环素、萘啶酸、氯霉素和红霉素有较高的敏感性。由于乳酸菌基因工程操作中常用的抗生素一般为红霉素和氯霉素,因此本研究选择具有红霉素或氯霉素抗性的5种质粒。根据文献中报道的乳酸菌电转化方法[9-13],尝试将5种质粒分别电转化至AR497感受态中,但均未成功。基于王巧惠等[7]制备干酪乳杆菌感受态的方法,本研究改变了接种量、生长培养基中甘氨酸的质量浓度和菌体生长状况,使AR497能够成功吸收外源质粒。但仅有质粒pNZ44和pMG36e能够成功转化至AR497中,其他质粒未能成功,这可能是由于这些质粒的复制子不能够在AR497中自主复制。KIM等[14]研究也表明,菌株之间的特异性和质粒的来源会影响转化效率。
为验证上述转化后得到的克隆为阳性,随机挑选9个含有pNZ44的转化子,选用pNZ44上的氯霉素抗性基因片段引物进行菌落PCR验证,电泳图显示均有条带且与目的片段(~700bp)大小一致(图1),表明pNZ44质粒已转化至发酵乳杆菌AR497中。由于pNZ44在AR497中的电转化效率最高,后续试验选择此质粒进行电转化条件优化。
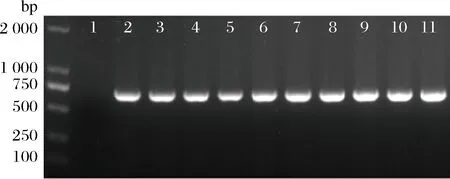
M-DL 2000 marker;1-阴性对照;2-阳性对照;3~11-转化子氯霉素(Cm)抗性基因PCR结果图1 转化子PCR验证
Fig.1 Transformants verified by PCR
2.2 不同洗涤缓冲液对电转化效率的影响
制备感受态时,洗涤缓冲液通过洗涤细胞使感受态处于理想的离子环境浓度[15]。洗涤缓冲液中通常含有渗透保护剂,用于维持细胞渗透压,避免细胞因电穿孔过度溶胀而破裂,从而提高细胞存活率。本研究选择了4种制备乳酸菌感受态常用的洗涤缓冲液,考察其对AR497电转化效率的影响。洗涤缓冲液I的电转化效率远低于洗涤缓冲液II和III(图2),这说明加入渗透保护剂确实有利于转化效率的提高。同时还发现,利用蔗糖作为保护剂能获得更高的转化效率,约为3×104CFU/μg DNA,与曹晓梅等[16]研究结果一致。
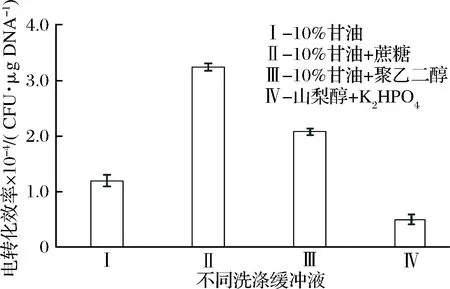
图2 洗涤缓冲液对发酵乳杆菌AR497电转化效率的影响
Fig.2 Effect of washing buffer on the electroporationefficiency of L. fermentum AR497
2.3 不同质粒浓度对电转化效率的影响
外源质粒浓度会影响电转化效率,细胞浓度一定时,添加不同浓度的外源质粒得到的转化子数目不同。质粒浓度过大时,电转化产生的电阻较大,易于击穿电转杯[17]。本研究选择添加不同浓度的pNZ44质粒进行电转化,考察其对AR497电转化效率的影响。由图3可知,加入不同浓度质粒对电转化效率有一定的影响。质粒质量浓度在20 ng/μL左右时,电转化效率最高达3.8×104CFU/μg DNA;质粒浓度再升高时,转化效率反而下降。
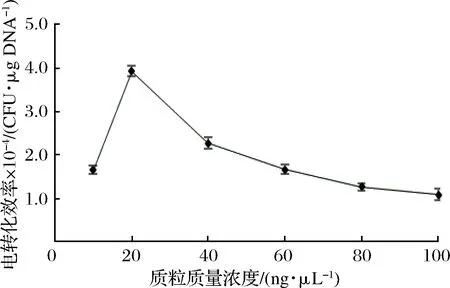
图3 不同质粒质量浓度对发酵乳杆菌AR497电转化效率的影响
Fig.3 Effect of different plasmid content on the electropor-ation efficiency of L. fermentum AR497
2.4 不同复苏培养基对电转化效率的影响
细胞经电击后很容易大量死亡,在高渗环境中复苏能够明显提高细胞的存活率[18]。采用4种高渗培养基来复苏电转化后的AR497细胞,结果表明,在MRSMC2的培养基中电转化效率最高,达5.6×104CFU/μg DNA(图4)。相同浓度山梨醇的转化效率明显高于蔗糖,说明山梨醇更有利于AR497细胞膜的恢复。
图4 不同复苏培养基对发酵乳杆菌AR497电转化效率的影响
Fig.4 Effect of different medium component on the electro-poration efficiency of L. fermentum AR497
MRSMC2恢复培养基比MRSMC1恢复培养基的转化效率更高,这可能是CaCl2和MgCl2的存在会促进外源DNA的吸收,获得更多的转化子。
2.5 Plackett-Burman 试验筛选关键因素
在上述单因素试验基础上,本研究采用5因素3水平的Plackett-Burman试验设计对电转化方法中甘氨酸质量浓度、OD600、电场强度、山梨醇浓度和复苏时间进行关键因素筛选。利用Minitab软件对Plackett-Burman试验结果(表4)进行拟合和方差分析,拟合方程如下:
Y=25 833+17 433X1-18 792X2+22 792X3+4 225X4-18 817X5
影响电转化效率的关键因素显著性排序为:电场强度>山梨醇浓度>OD600>甘氨酸质量浓度>复苏时间(表5)。其中电场强度(X3)、山梨醇浓度(X5)、OD600(X2)和甘氨酸浓度(X1)对电转化效率影响显著(P<0.05),基于此结果进行最陡爬坡试验。
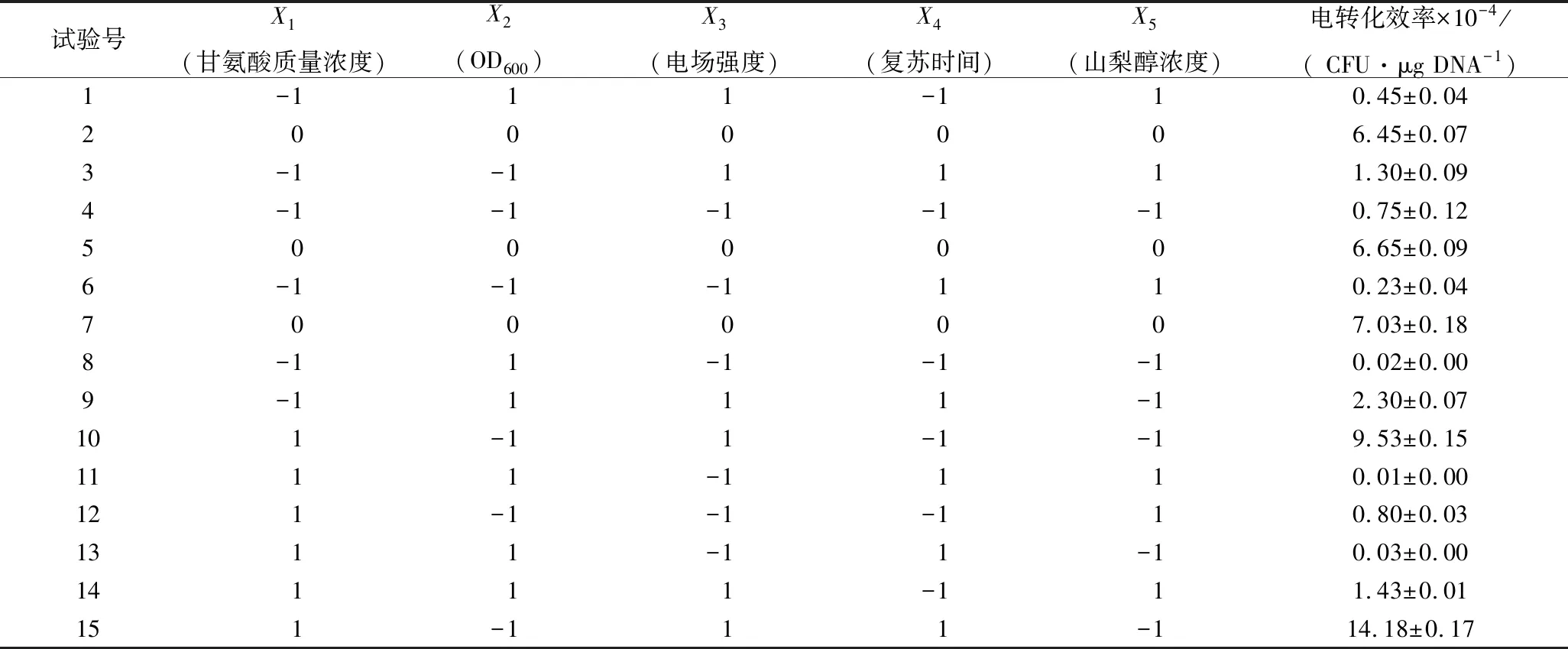
表4 Plackett-Burman 试验设计及结果
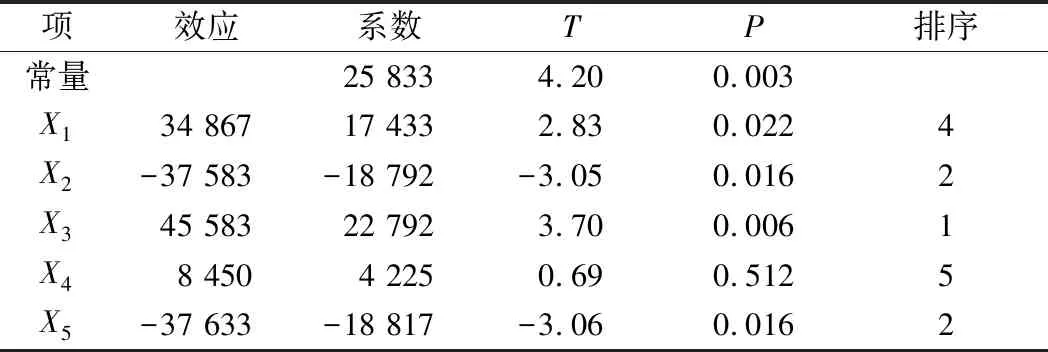
表5 Plackett-Burman 试验各种因素的影响
2.6 最陡爬坡试验结果与分析
随着甘氨酸质量浓度、OD600、电场强度及山梨醇浓度的变化,电转化效率呈先增大后减小的趋势(表6)。当甘氨酸质量浓度为25 g/L,OD600为0.2,电场强度12.5 kV/cm,山梨醇浓度0.5 mol/L时,AR497的电转化效率最高,说明此时接近最佳响应区域。因此,Box-Behnken试验将此条件作为中心点,对电转化条件进一步优化。
表6 最陡爬坡试验设计及结果
Table 6 Experimental design and results of steepest ascent
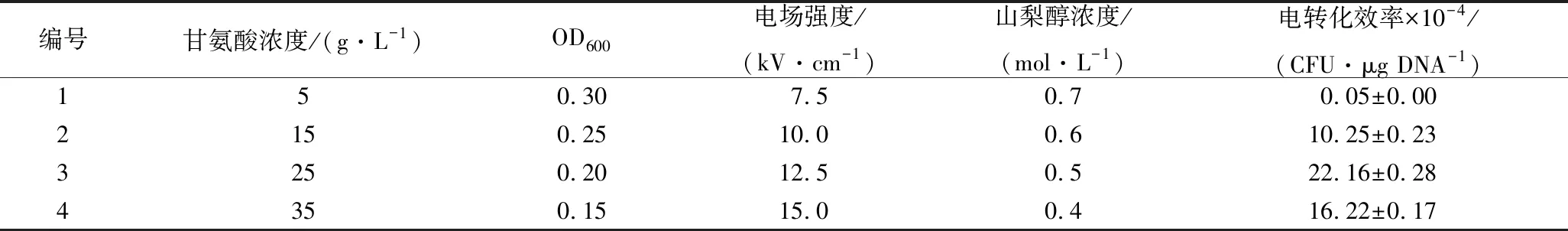
编号甘氨酸浓度/(g·L-1)OD600电场强度/(kV·cm-1)山梨醇浓度/(mol·L-1)电转化效率×10-4/(CFU·μg DNA-1)150.307.50.70.05±0.002150.2510.00.610.25±0.233250.2012.50.522.16±0.284350.1515.00.416.22±0.17
2.7 Box-Behnken响应面试验结果与分析
在最陡爬坡试验的基础上,采用Box-Behnken响应面设计对以上4个显著因素进行优化。利用Design Expert软件对试验结果(表7)进行方差分析及二次多项回归拟合(表8),得到发酵乳杆菌AR497电转化效率对电场强度(A)、山梨醇浓度(B)、OD600(C)和甘氨酸质量浓度(D)的多元回归方程为:
Y=227 500.00+58 208.33A+14 479.17B+10 386.25C+12 407.08D-20 943.13A2-31 411.87B2-158 800.00C2-49 020.00D2+26 562.50AB+13 250.00AC+187.50AD+
4 500.00BC-1 375.00BD+5 158.75CD
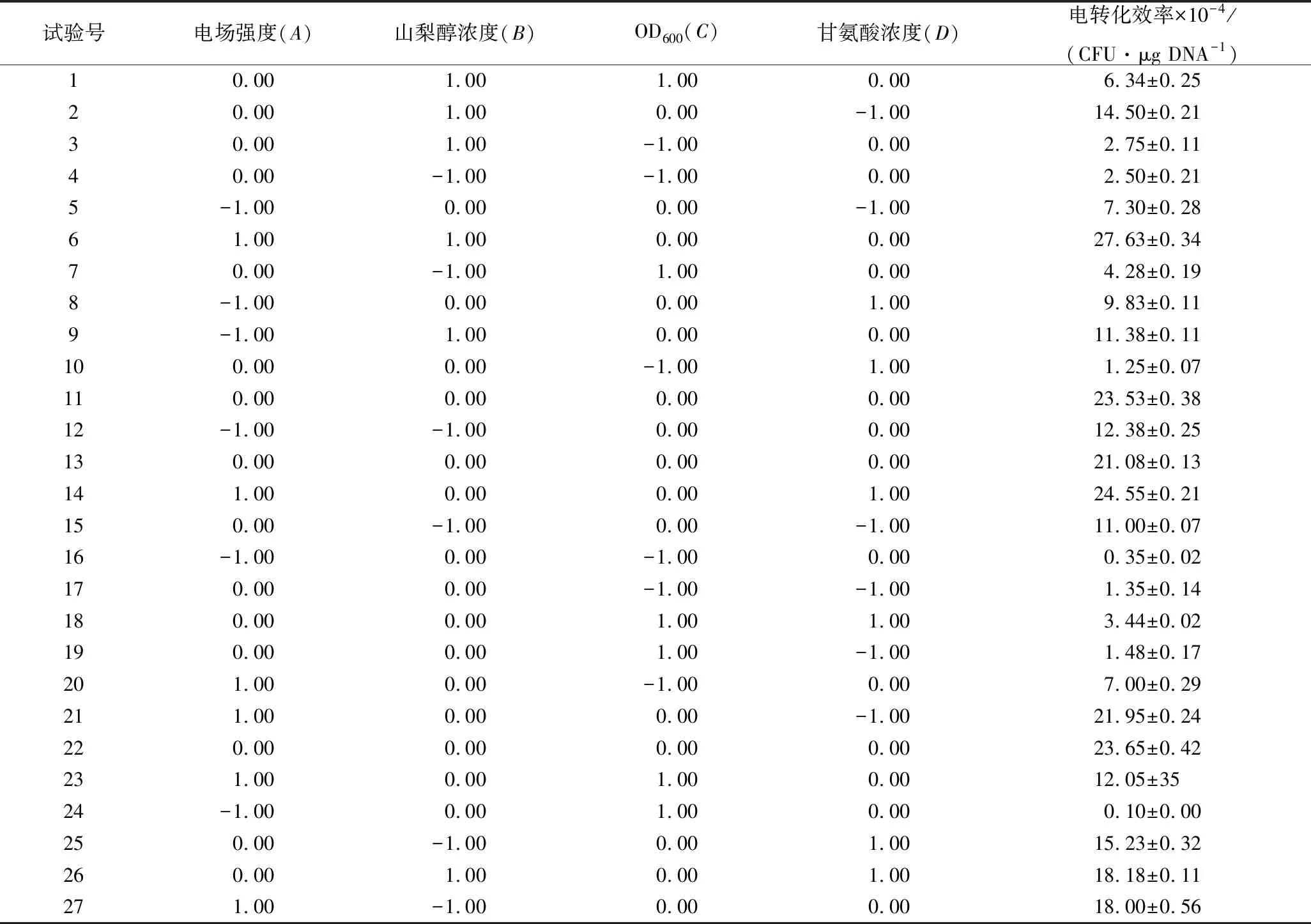
表7 Box-Behnken 试验设计及结果
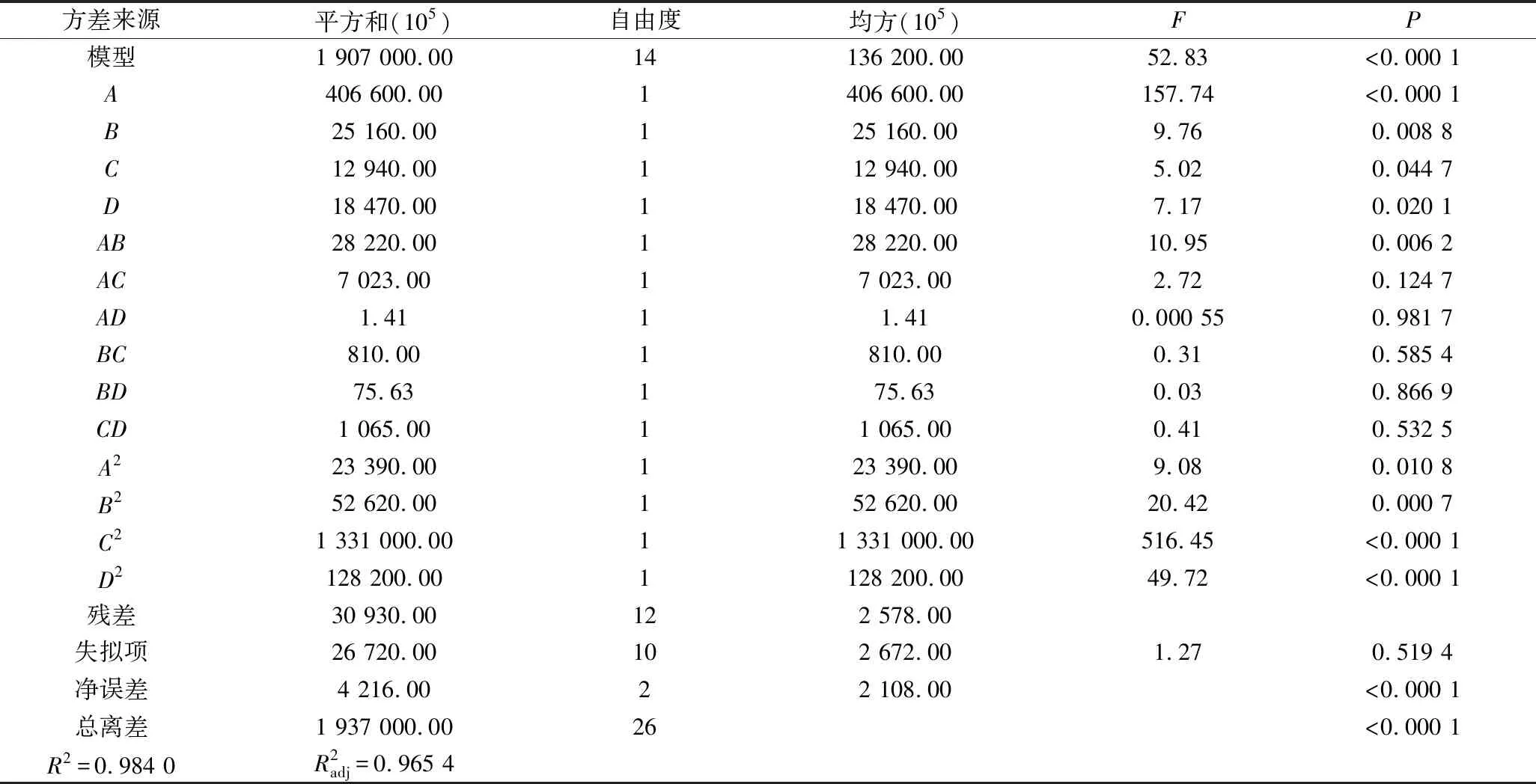
表8 回归方程模型显著性分析
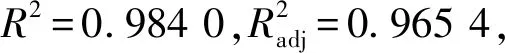
图5直观反映了各因素间交互作用对电转化效率的影响,其中,电场强度(A)和山梨醇浓度(B)交互作用的曲面图斜度更为陡峭,说明其交互作用显著。而其他交互项之间的曲面图斜度较为平缓,交互作用不显著。
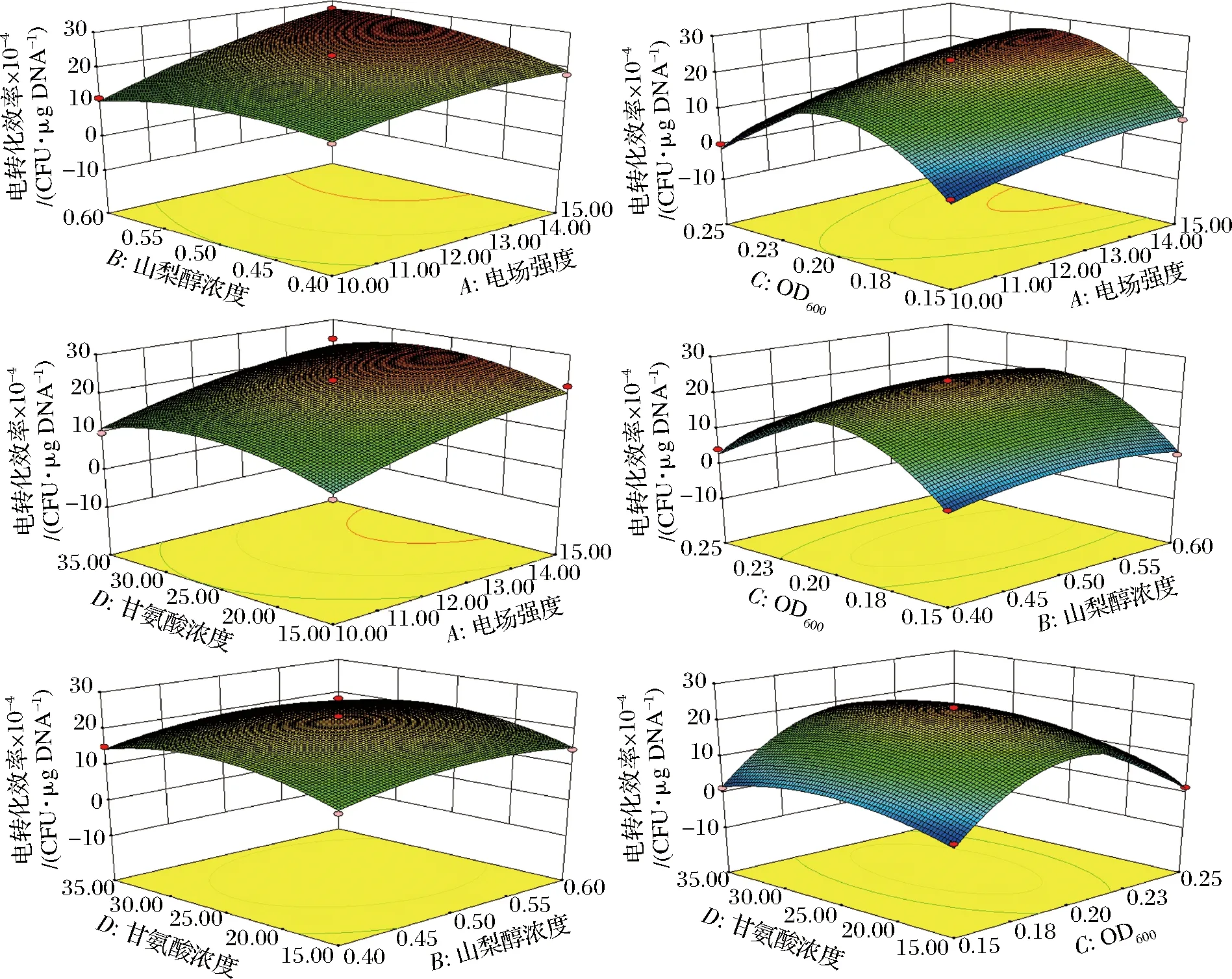
图5 各因素交互作用对发酵乳杆菌AR497电转化效率的影响
Fig.5 The effect of the factors on the electroporationefficiency of L. fermentum AR497
运用Design Expert软件分析得到发酵乳杆菌AR497最优电转化条件为:电场强度15 kV/cm,山梨醇浓度0.57 mol/L,OD600为0.2,甘氨酸质量浓度26.23 g/L,预测在此条件下发酵乳杆菌AR497的电转化率达到2.8×105CFU/μg DNA。为了方便操作,将上述预测的参数修改为:电场强度15 kV/cm,山梨醇浓度0.6 mol/L,OD600为0.2,甘氨酸浓度26 g/L。按此电转化条件实际电转化效率为(2.78±0.25)×105CFU/μg DNA,与理论值非常接近,说明条件参数可靠,能够较好的预测发酵乳杆菌AR497电转化效率。
3 讨论
本研究确立了发酵乳杆菌AR497的电转化方法,使质粒pNZ44和pMG36e可成功转化至AR497中。采用单因素试验、Plackett-Burman试验、最陡爬坡试验和Box-Behnken响应面法对电转化条件进一步优化,确定了制备发酵乳杆菌AR497的感受态方法和最佳电转化条件,即3%接种量接种至含有质量浓度26 g/L甘氨酸的MRS液体培养基,37 ℃培养至OD600约0.2,用体积分数10%甘油和0.5 mol/L蔗糖溶液洗涤重悬细胞2次,电场强度15 kV/cm,电击后用0.6 mol/L山梨醇,2 mmol/L CaCl2和20 mmol/L MgCl2的MRS培养基复苏,在此条件下发酵乳杆菌AR497电转化效率高达2.78×105CFU/μg DNA。
LUCHANSKY等[13]研究表明,使用质粒pGK12电转至L.fermentum1750中,转化效率高达9.7×105CFU/μg DNA,但该电转化方法不适用于发酵乳杆菌AR497,造成转化能力差异的原因可能是质粒pGK12和pNZ44的复制子不同,复制方式存在的差异,影响了菌株的转化能力;另一种可能就是宿主菌株存在特异性。SERROR等[19]研究也发现,电转化效率可能与菌株的特异性有关,他们尝试用同一种方法制备不同的德氏乳杆菌感受态并转化,结果有些菌株没有转化子,但有些菌株的转化效率高达104CFU/μg DNA。RUSH等[10]研究使用质粒pNZ17电转至L.fermentumBR11中,转化效率仅为2.0×103CFU/μg DNA,而WEI等[20]研究通过改变筛选平板上的抗生素浓度,使L.fermentumBR11电转化效率最高达4.5×104CFU/μg DNA,说明抗生素筛选的浓度也会对电转化效率产生影响。除上述因素外,影响电转化效率的因素还包括质粒来源、大小,抗生素种类,载体与内源质粒的相容性等,后期可针对这些因素进行优化,有望进一步提高AR497的电转化效率。

