不同培养基浓度对土壤耐低温微生物分离效果的影响
武凤霞,张淑彬,应梦真,刘建斌
不同培养基浓度对土壤耐低温微生物分离效果的影响
武凤霞,张淑彬,应梦真,刘建斌*
北京市农林科学院植物营养与资源研究所, 北京 100097
从环境中分离筛选具有特定功能的纯培养微生物是微生物应用研究的基础,而提高环境微生物的可培养性是筛选纯培养微生物的关键。本研究以常规微生物分离培养基营养浓度为基础,对贫营养、富营养培养基在低温条件下(8℃)获得的培养物进行比较分析,了解培养基营养浓度对低温土壤微生物分离培养的影响,以期为特殊培养基的设计及多培养基组合提高土壤低温微生物的可培养性提供思路和依据。结果表明在低温培养条件下,稀释培养基营养成分可以提高耐低温可培养性微生物种类,但会降低耐低温可培养微生物的数量。通过比较低温条件下实验室分离培养方法和16 sRNA高通量测序法对常年低温环境土壤微生物多样性分析,通用常规方法无法分离和培养出土壤中的绝大部分微生物,且通过常规方法分离培养出来的微生物也不一定是土壤环境的优势菌群。
稀释营养; 微生物多样性; 培养基; 可培养性
地球生态环境低温区占80%以上,这些环境里生存着种类繁多且分布广泛的微生物,但被我们发现的微生物只占整个低温微生物中的冰山一角,还有很多低温微生物因为我们技术及设备的原因尚未被发现[1]。微生物的分离、纯化、培养计数等纯培养技术一直是微生物学研究的基石,也是微生物应用研究的基础,但是,研究表明自然界中绝大多数微生物尚不能被目前的纯培养技术所培养[2,3]。低的环境微生物可培养性使获得纯培养菌株特别是有特殊功能的新的菌株变得更不容易,因而对这类微生物形态、生理特性、代谢功能等生命活动规律的研究受限,纯培养技术的局限已经成为微生物应用研究特别是低温微生物应用研究的主要瓶颈[4,5]。在改进微生物培养方法、开发新型培养技术方面国内外开展了较多的研究工作,分离获得了一批新的微生物菌株。如通过改变培养基的配方、降低培养基营养成分、添加某些微生物生长因子可显著提高平板培养的土壤微生物种类和数量;采用多种培养基组合亦可提高土壤微生物的可培养性。这些基于可培养层面上的发现及近年来发展起来诸如宏基因组学等分子生物学技术和手段极大地推动对自然界中微生物功能资源的开发和应用[6]。本研究以常规微生物分离培养基营养浓度为研究基点,对贫营养、富营养培养基在8℃条件下获得的培养物进行分析比较,以了解营养浓度对低温土壤微生物分离培养的影响,从而为特殊培养基的设计及多培养基组合提高土壤低温微生物的可培养性提供思路和依据。
1 材料与方法
1.1 材料来源
1.1.1 土壤样品采集于新疆赛里木湖湖畔,年平均气温8~10 ℃,无菌袋取样后冰箱4 ℃保存备用。
1.1.2 培养基本实验所用培养基是LB、TSB、R2A、PDA、YPD、高氏培养基(G)及该6种培养基1/4稀释液、1/10稀释液培养基。根据培养基营养物质浓度把LB、TSB、PDA、YPD、G定为富营养培养基,LB、TSB、PDA、YPD、G培养基1/4稀释液和R2A定为中度营养培养基、LB、TSB、PDA、YPD、G培养基1/10稀释液、1/4R2A定为贫营养培养基,R2A1/10稀释液为极贫营养培养基,以上培养基均购置于Coolaber公司。
1.2 低温微生物驯化培养及稀释涂布分离
涉及培养基5%接种土壤后在8 ℃、150 r/min振荡培养7 d,连续转接驯化4次。取1 mL培养液进行梯度稀释涂布后置于8 ℃培养4 d,每天定时统计各平板菌落数、菌种类别,菌种类别用平板菌落形态观察和显微镜革兰氏染色相结合的方法。
1.3 低温可培养微生物的分离鉴定
分离获得的耐低温菌纯化后用细菌基因组提取试剂盒(Tiangen Biotech CO.,LTD)提取DNA后进行16 SrDNA基因扩增(引物为27 f和1492 R),PCR产物由上海美吉生物医药科技有限公司测序。测序数据在NCBI进行Blast比对后初步确定分离菌株种类。
1.4 土壤样品微生物组成高通量测定
-80 ℃保藏土壤样品由美吉生物医药科技有限公司进行土壤细菌16 SrRNA Illumina Miseq平台测序。测序公司负责将测序结果进行OTU划分并进行基础分析。
2 结果与分析
2.1 8 ℃培养条件下不同培养基分离土壤微生物种类
土样经连续4次驯化后在相应培养基平板8 ℃培养96 h分离获得微生物全部为细菌,各培养基分离获得细菌种类见图1。从图1看出经1/4稀释的R2A培养基获得的细菌种类最多,YPD、LB、TSB培养基1/10稀释处理筛选获得的细菌种类均高于原培养基。本实验结果表明在低温(8 ℃)条件下,培养基贫营养更有利于分离获得更多的微生物种类。

图 1 8 ℃培养条件下不同培养基分离土壤微生物种类

图 2 8 ℃培养条件下不同培养基分离土壤微生物菌落总数
2.2 8 ℃培养条件下不同培养基分离土壤微生物菌落总数
8 ℃培养条件下6种培养基不同浓度在不同时段内分离获得的土壤耐低温菌株平板计数结果见图2。从图中可以看出,耐低温菌株在6种培养基生长菌落数量差别较大,YPD、高氏一号、TSB、R2A培养基原浓度平板获得有效活菌数量最高,而且稀释浓度越高处理获得的有效活菌数数量越小,说明高浓度营养成分有助于提高平板的有效活菌数获得。LB培养基1/4稀释的培养基处理分离获得的可培养微生物数量最多,PDA培养基则为1/10倍稀释的培养基处理获得的微生物数量最多。分析可见低温条件下(8 ℃)培养基富营养有助于微生物菌落数量获得。
2.3 低温可培养微生物的分离鉴定结果
新疆土经连续4次驯化后在相应培养基稀释分离获得微生物全部为细菌。根据平板菌落形态和革兰氏染色显微镜观察分离获得10株不同的细菌,经分离、纯化和基因测序对比结果如表1所示。8 ℃条件驯化分离获得细菌主要集中在变形菌门,-变形菌纲下的假单胞属、沙雷菌属和节杆菌属。
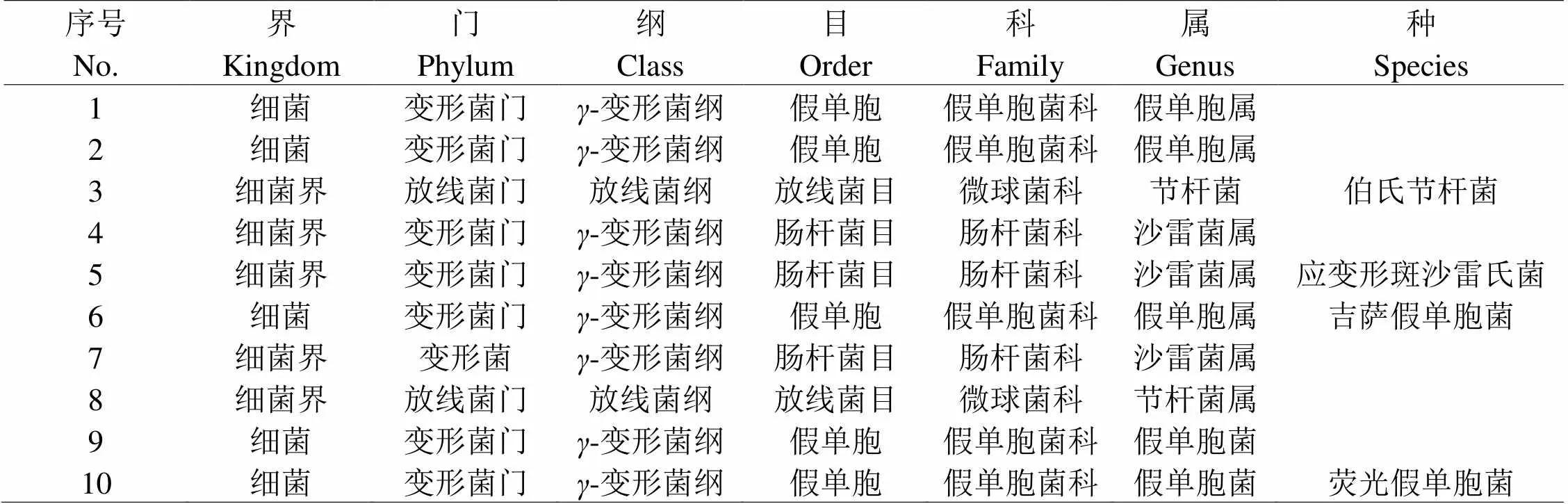
表 1 低温可培养细菌16 SrRNA比对结果
2.4 土壤样品细菌组成高通量测定结果

图 3 不同分类水平上(门、纲、目、科、属)的细菌分类
土壤样品进行细菌高通量测序后,获得46069条有效序列,依据Barcode标签进行序列拆分共获得422个OUT(97%相似度),在纲、目、科、属水平上进行分类(见图3),纲水平上百分含量最多的是(放线菌纲)的细菌,约占总量的33.59%,其它占比在5%以上的依次是(甲型变形菌纲)、(酸杆菌门)、(芽单胞菌门);目上平上能够比对的占比最多的是(根瘤菌目),约占总量的8.53%,其次占比在5%以上的依次有(酸杆菌目)、(放线菌目)、(黄单胞菌目);科水平上能够占比大于4%的依次是(酸杆菌)、(放线菌)(芽单胞菌科)、(微球菌科)、(黄单胞菌科);属水平上占比最多的细菌分别是(酸杆菌)、(放线菌)、(芽单胞菌科)、(微球菌科)。
3 讨论
常规的微生物分离筛选培养基营养成分丰富但相对单一,而自然环境多数属于“贫营养”但营养元素丰富。因此,利用富营养但营养元素少的普通培养基从自然环境中筛选分离适应了寡营养状态的微生物,往往在一定程度上会变现出不可培养性[7]。本研究基本印证了这一结果,在低温(8 ℃)条件下1/4倍稀释的R2A培养基筛选分离到的细菌种类最多,高氏一号、LB、TSB、YPD培养基均表现出1/10倍稀释的培养基处理较原浓度培养基可以分离更多微生物种类的特点。可见稀释培养基营养成分即中度或贫营养培养基更有利于提高环境微生物的可培养性。
4 结论
一些研究者提出有些条件下,培养基中过高的营养物质会抑制一些微生物的生长,因此利用富营养的常规培养基进行环境微生物分离,筛选获得的微生物数量并非最多[8]。本研究结果显示在8 ℃培养条件下YPD、高氏一号、TSB、R2A培养基原浓度平板获得有效活菌数量最高,而且稀释浓度越高处理获得的有效活菌数数量越小,只有LB培养基1/4稀释的培养基处理分离获得的可培养微生物数量最多,PDA培养基则为1/10倍稀释的培养基处理获得的微生物数量最多。说明培养基营养成分浓度对环境耐低温微生物可培养性和数量获得同样具有重要的影响。通过连续驯化和培养基稀释分离获得土壤优势菌群分布在变形菌门、-变形菌纲、假单胞目、假单胞科的假单胞属、变形菌门、-变形菌纲、肠杆菌目、肠杆菌科的沙雷菌属和变形菌门、放线菌纲、放线菌目、微球菌科的节杆属,没有筛选分离到真菌。
利用分子生物学方法对采集土样进行细菌高通量测序,获得的46069条有效序列经Barcode标签法拆分为422个OTU,在纲的水平上含量最多的(放线菌纲),约占总量的33.59%,其次是(甲型变形菌纲);在目的水平上占比最多的是(根瘤菌目),其次是(酸杆菌目);在科水平上占比最大的是(酸杆菌)、其次是(放线菌),在属水平上占比最多是(酸杆菌)、其次是(放线菌);比较低温条件下实验室分离培养方法和分子生物学方法对常年低温环境土壤微生物多样性分析结果可以看出,培养方法分离获得的土样优势菌群分布在变形菌门、-变形菌纲中,而分子生物学法分析的细菌类群在变形菌门、变形菌纲中均有分布,但多样性更高。比较两种方法分析结果在分类学目水平以下几乎没有共同类群,说明通过常规微生物分离方法无法分离获得土壤中的绝大部分耐低温微生物,且分离筛选获得的耐低温微生物也不一定是土壤环境的优势菌群。
[1] Alikunju, AP, Joy S, Salam JA,. Functional Characterization of a New Cold-Adapted-Galactosidase from an Arctic Fjord Sediment Bacteria Enterobacter ludwigii MCC 3423[J]. Catalysis Letters, 2018,148(11):1–13
[2] 张璐洁,屈建航,符运会,等.环磷酸腺苷对太湖界面沉积物可培养细菌多样性的影响[J].微生物学通报,2018,45(2):284−292
[3] Pandey A, Dhakar K, Jain R. Cold Adapted Fungi from Indian Himalaya: Untapped Source for Bioprospecting, Proceedings of the National Academy of Sciences[J]. India Section B: Biological Sciences, 2018,7(29):1–8
[4] 王萍,崔中利,刘标,等.培养方法对土壤可培养细菌多样性的影响[J].土壤学报,2009,46(6):1096-1101
[5] 郭斌,吴晓磊,钱易.提高微生物可培养性的方法和措施[J].微生物学报.2006,46(3):504-507
[6] 袁志辉,王健,杨文蛟,等.土壤微生物分离新技术的研究进展[J].土壤学报,2014,51(6):1183-1188
[7] 代先祝,梁晓丽,邱勤.低营养浓度培养基分离培养生物膜中的细菌及其鉴定[J].微生物学通报,2010,37(7):951-955
[8] 周楠,姜成英,刘双江.从环境中分离培养微生物:培养基营养水平至关重要[J].微生物学通报,2016,43(5):1075-1081
Effects of Nutrient Medium Concentrations on Isolation of Cold Adapted Microorganisms
WU Feng-xia, ZHANG Shu-bin, YING Meng-zhen, LIU Jian-bin*
100097,
Improving the culturability of soil microorganism and isolating pure strains are the base of the study of applied microbiology. The cold-adapted microorganisms was isolated from the soil of SayramLake by using traditional nutrient medium and dilution of traditional nutrient medium and six traditional nutrient medium were used for this study. Results showed that the approach of dilute the traditional nutrient medium could increase the culturability of cold-adapted microorganism in the conditionof 8 ℃. But the amount of the cold-adapted microorganism cultured on dilution of traditional nutrient medium was lower than those on traditional nutrient medium. The results of the 16S rRNA sequencing showed that only a small proportion of cold-adapted microorganisms in the sample was recovered by culturing techniques.
Dilute nutrient broth; microbial diversity; culturemedium; culturability
S18
A
1000-2324(2019)02-0315-04
10.3969/j.issn.1000-2324.2019.02.030
2018-03-12
2018-04-25
北京市农林科学院青年基金(QNJJ201707);北京市农林科学院科技创新能力建设项目(KJCX20190407);国家重点研发计划(2017YFD0201607)
武凤霞(1980-),女,硕士,助理研究员,主要从事土壤微生物应用研究. E-mail:wufengxia0570@163.com
Author for correspondence. E-mail:liujianbin1981@126.com

