新型光敏剂光动力治疗耐药胃癌的实验研究
陈靖京,洪 阁,刘姝萍,刘天军
(1.长治医学院药学系药理学教研室,山西 长治 046000;2. 中国医学科学院生物医学工程研究所分子设计与纳米技术实验室,天津 300192;3.长治医学院附属和平医院皮肤科,山西 长治 046000)
多药耐药(multidrug resistance,MDR)是导致临床胃癌化疗失败的重要原因[1]。经典的耐药机制与细胞膜上P糖蛋白(P-glycoprotein,P-gp)过表达有关。P-gp由MDR1基因编码,能够将进入细胞内的化疗药物主动泵至细胞外,导致化疗失败而产生耐药[2]。光动力学疗法(photodynamic therapy,PDT)是利用光敏剂在瘤组织的特异蓄积及对瘤组织进行激光照射,产生单线态氧(1O2)等活性氧物质,杀灭瘤细胞[3]。PDT对机体影响较小,目前已用于多种肿瘤的治疗[4-5]。另有研究报道,PDT可用于多药耐药肿瘤的治疗[6-7]。Cheung等[8]报道,脱镁叶绿酸a-PDT可以进一步抑制耐药子宫肉瘤细胞P-gp表达,逆转耐药。然而,关于PDT对长春新碱(vincristine,VCR)耐药胃癌细胞的治疗作用及与P-gp之间的关系,目前尚未有研究。
光敏剂是PDT的核心元素。本实验室长期致力于研究和开发新型光敏剂,尤其是水溶性卟啉的研究。前期研究我们筛选出一种疗效较好的新型水溶性卟啉类光敏剂,其化学名称为中位取代的5-对二乙基三胺五乙酸基-氨基苯基-10,15,20-三苯基卟啉(meso-5-[q-DTPA-aminophenyl]-10,15,20-triphenyl-porhyrin,DTP)。本实验以VCR耐药的胃癌细胞株为研究对象,探索DTP介导的光动力学治疗对耐药胃癌的作用,并揭示DTP-PDT与P-gp之间的关系及相关机制。
1 材料与方法
1.1 材料
1.1.1实验动物 ♀裸鼠,4~6周龄,体质量16~20 g,由北京华阜康动物实验中心提供,动物生产许可证号:SCXK(京)2014-0004。实验过程中动物的使用符合动物伦理委员会的要求。动物均在无特殊病原体条件下饲养,使用垫料为无菌垫料,食用无菌饲料和无菌水。饲养环境温度26~28 ℃,湿度40%~60%,饲养笼具均进行消毒。
1.1.2细胞株 人VCR耐药胃癌细胞株SGC7901/VCR,购自中国科学院细胞库,为P-gp高表达。
1.1.3药物与试剂 新型光敏剂DTP,由中国医学科学院分子设计与纳米技术实验室合成并提供(结构见Fig 1),纯度大于97%;VCR(批号:20161203),购自深圳万乐药业有限公司;四甲基偶氮唑盐(MTT)、RPMI 1640培养液,购自北京索莱宝公司;胎牛血清为Gibco公司产品;二苯基苯并呋喃(DPBF)、二甲基亚砜(DMSO)为Sigma公司产品;Annexin V-FITC/PI凋亡检测试剂盒、抗氧化剂生育酚,购自碧云天公司;P-gp单克隆抗体为BD公司产品。
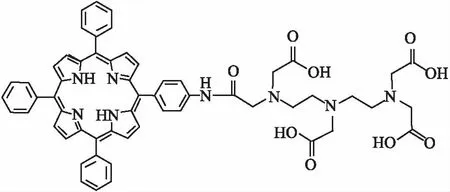
Fig 1 Chemical structure of DTP
1.1.4仪器 半导体激光器(美国Intense公司);酶标仪(芬兰Thermo 3001公司);流式细胞仪(美国BD Biosciences公司);qTOWER 2.2实时荧光定量PCR仪(德国ANALYTIKJENA公司)。
1.2 方法
1.2.1DTP紫外吸收光谱测定 用RPMI 1640培养液稀释DTP母液,使其终浓度为3.12 μmol·L-1。取100 μL药液加入96孔板内,酶标仪上检测药物在350~750 nm范围内的吸收光谱。实验同时取100 μL不含DTP的RPMI 1640培养液,以排除稀释溶剂本身对药物吸收光谱的影响。
1.2.2DTP-PDT对SGC7901/VCR细胞生长的影响 将SGC7901/VCR细胞接种于96孔板内,贴壁后,用不同浓度(0~6.25 μmol·L-1)的DTP药液孵育24 h。行激光照射,光照波长650 nm,能量密度15 J·cm-2,时间15 min,光照后继续孵育细胞24 h。取20 μL MTT溶液加入各孔,孵育3 h。倾去溶液,各孔加入180 μL DMSO,酶标仪上振荡5 min,检测各孔在490 nm处的吸光度值(OD),计算细胞存活率和半数有效浓度IC50。实验同时设暗毒性组(DTP孵育细胞,无光照)。
1.2.3体内抗肿瘤实验 肿瘤模型制备方法参考文献[9]。收集1×107个SGC7901/VCR细胞,接种于裸鼠右后背部。1周后,肿瘤体积大约为150 mm3,将16只裸鼠随机分为对照组(生理盐水,1次)和治疗组(DTP,10 mg·kg-1,1次)。生理盐水或者DTP通过尾静脉给药,避光饲养动物。24 h后,用浓度为0.5 mg·kg-1的乌拉坦将动物麻醉,对肿瘤部位进行激光照射(其余部位避光),光照波长650 nm,能量密度100 J·cm-2。21 d后,两组裸鼠的肿瘤大小用游标卡尺进行测量,并用以下公式计算体积:V(cm3)=d2(cm2)×D(cm)/2,d和D分别为肿瘤最短径和最长径。
1.2.4DTP-PDT后凋亡检测 将6孔板中SGC7901/VCR细胞用不同浓度(0、0.78、1.14、1.56 μmol·L-1)的DTP药液孵育24 h,行激光照射,波长650 nm,能量密度25 J·cm-2,光照时间15 min。光照后细胞继续培养3 h,离心、洗涤并收集细胞。在室温且避光的条件下,先用浓度为200 mg·L-1的Annexin V-FITC染液染色细胞10 min,后用30 mg·L-1的PI进行染色。随即用流式细胞仪分析各样品细胞的荧光强度,分析细胞数为104个。
1.2.5DTP-PDT后细胞内单线态氧产率测定 将100 μL浓度为20 μmol·L-1的DPBF溶液与100 μL不同浓度(0.39~6.25 μmol·L-1)的DTP溶液混匀,同时加入或不加80 μmol·L-1单线态氧捕获剂生育酚。混合溶液接受激光照射,光照条件同“1.2.2”。实验另设DPBF和DTP混合溶液无光照为对照组(二者浓度同上)。各组均加入1 mL氯仿提取DPBF,以得到DPBF的氯仿溶液,用酶标仪测定DPBF在410 nm波长处的吸光度值(OD)。DPBF为已知的1O2捕获剂,在410 nm处有吸收峰。DPBF消耗的相对速率即为1O2的相对产率。计算公式为:(OD0-OD1)/OD0,OD0为对照组DPBF的OD值;OD1为DTP-PDT组DPBF的OD值。
1.2.6流式细胞术检测DTP-PDT后P-gp表达变化 光照后3 h,收集6孔板中DTP-PDT处理(DTP浓度为0.78、1.56 μmol·L-1;DTP孵育时间24 h;光照条件:波长650 nm,能量密度为15 J·cm-2,光照时间15 min;80 μmol·L-1的生育酚有或无)和未处理(细胞未经任何处理,对照组)的SGC7901/VCR细胞。将细胞重悬于100 μL的PBS中,加入20 μL PE标记的P-gp单克隆抗体,在室温中染色细胞30 min。PBS洗涤细胞,用流式细胞仪检测各样本荧光强度,每个样本分析104个细胞,荧光强度与细胞表面P-gp表达水平呈正比。
1.2.7qPCR检测DTP-PDT后MDR1 mRNA表达变化 光照后3 h,收集6孔板中DTP-PDT处理(DTP浓度为0.78、1.56 μmol·L-1;药物孵育时间24 h;光照波长650 nm;能量密度15 J·cm-2,时间15 min;80 μmol·L-1生育酚有或无)及未处理(对照组)的SGC7901/VCR细胞。用UNIQ-10柱TRIzol总RNA提取试剂盒,根据说明书提取各组细胞总RNA。引物使用Primer Premier 5.0软件设计,MDR1引物上游序列为:5′-GGAACTCAGCTCTCTGGTGG-3′,下游序列为:5′-CTTCTCTGGCTTTGTCCAGG-3′。使用下列循环条件:95 ℃,5 min;95 ℃,进行5 s,共40个循环;60 ℃,共30 s,在60 ℃这步获得荧光数据。本实验以GAPDH为内参照基因,结果使用2-ΔΔCt法进行计算[10]。
1.2.8DTP-PDT与VCR联合治疗作用 将SGC7901/VCR细胞接种于96孔板内,预先用不同浓度(0.20~6.25 μmol·L-1)的DTP溶液孵育 24 h。行光动力学治疗,能量密度10 J·cm-2,时间15 min。然后细胞用不同浓度(1~31.25 μmol·L-1)的VCR溶液孵育24 h。倾去药液,取100 μL不含血清的RPMI 1640培养液和20 μL MTT溶液依次加入各孔,继续孵育3 h,再次倾去液体,每孔加入180 μL DMSO,酶标仪上振荡5 min,检测各孔在490 nm波长处的吸光度值(OD),计算细胞存活率。实验分组如下:VCR组、DTP-PDT组及VCR+DTP-PDT组。
1.2.9生育酚对联合治疗的影响 实验步骤与“1.2.8”大致相同,不同之处在于各组用上述药物孵育同时,用80 μmol·L-1的生育酚进行孵育,时间24 h。

2 结果
2.1 DTP紫外吸收光谱分析如Fig 2所示,药物在不同波长处均有吸收峰,考虑到实际治疗时,光的组织穿透深度与波长呈正比,选择650 nm作为PDT时的光照波长。
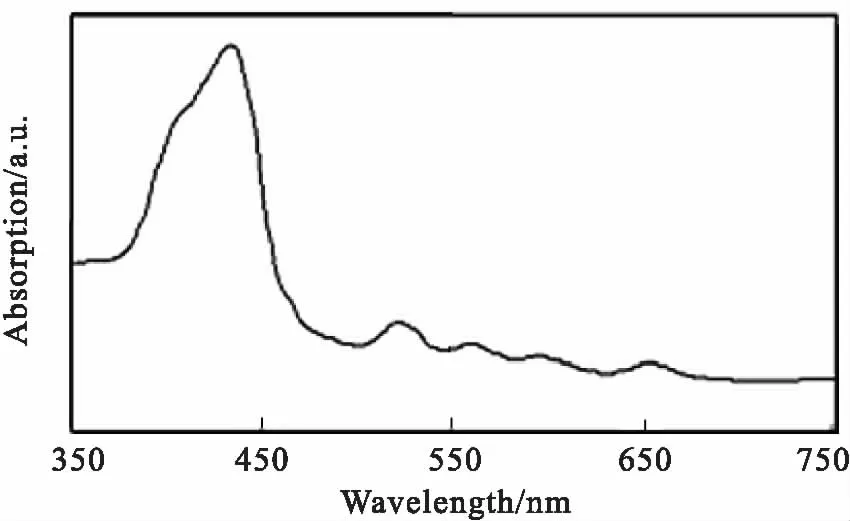
Fig 2 Spectrum property of DTP
2.2 DTP-PDT对SGC7901/VCR细胞生长的影响Fig 3的MTT结果显示,DTP-PDT对SGC7901/VCR细胞生长有抑制作用,呈明显的浓度依赖性,IC50值为1.45 μmol·L-1。当细胞仅用DTP孵育而无光照时,细胞存活率始终>90%,表明DTP本身毒性较小,安全性好。
2.3 体内抗肿瘤实验结果如Fig 4所示,DTP介导的光动力学治疗能够明显抑制耐药肿瘤瘤体的生长。d 21对照组肿瘤体积约为d 0的(190.0±23.2)%,DTP-PDT处理组肿瘤体积约为d 0的(61.0±8.1)%,二者相比差异有显著性(P<0.05)。
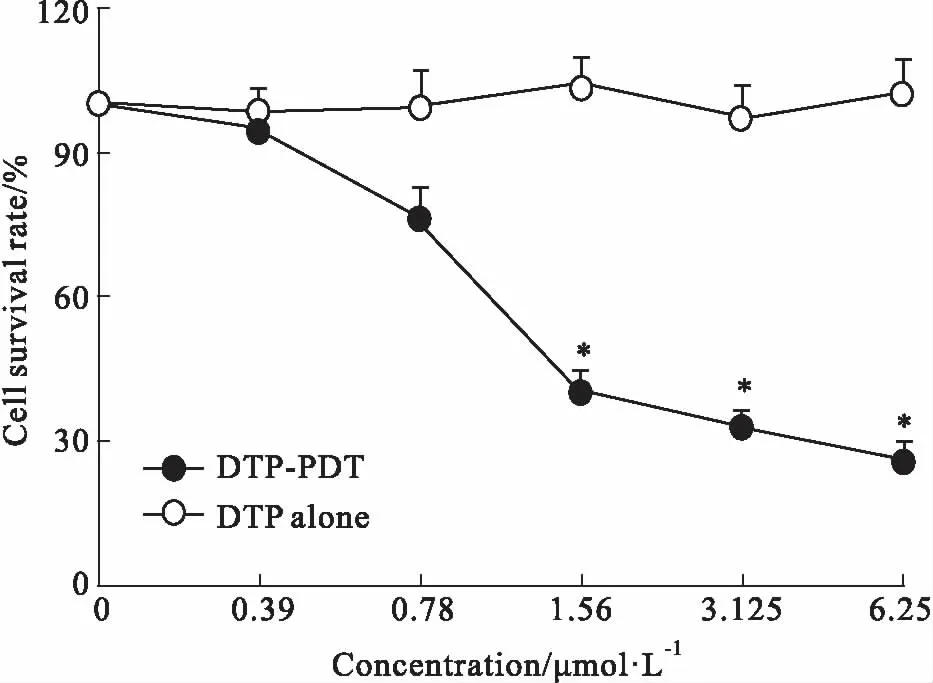
Fig 3 Effects of DTP-PDT and DTP on
*P< 0.05vscontrol
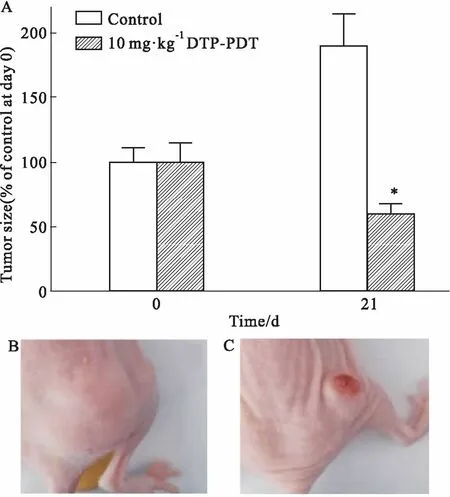
Fig 4 In vivo effects of DTP-PDT in nude mice bearing SGC7901/VCR cells n=6)
A:Tumor inhibition rate after DTP-PDT;B,C:Images of SGC7901/VCR tumors from control and DTP-PDT groups at the 21st day.*P<0.05vscontrol.
2.4 凋亡检测Fig 5显示,用不同浓度的DTP-PDT处理细胞后,SGC7901/VCR细胞死亡方式主要为凋亡,且呈明显的量效关系。
2.5 单线态氧测定从Fig 6可以看出,随着DTP浓度的增加,DTP-PDT介导的细胞内单线态氧产率也随之增加。加入80 μmol·L-1抗氧化剂生育酚,可以明显抑制细胞内单线态氧的产生。

Fig 5 Apoptosis detection by flow cytometric analysis n=3)
*P<0.05,**P<0.01vscontrol
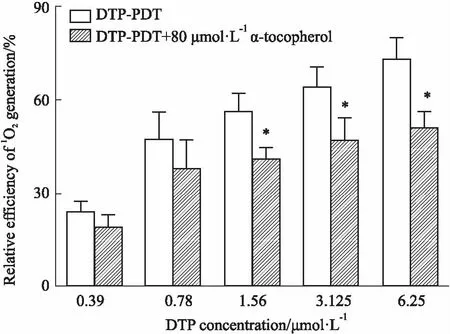
Fig 6 Determination of singlet oxygen generation n=3)
*P<0.05vsDTP-PDT group
2.6 DTP-PDT对P-gp和MDR1 mRNA表达的影响细胞膜上过表达的P-gp对细胞内化疗药物的外排,是导致肿瘤多药耐药形成的重要原因。本实验研究了DTP-PDT对SGC7901/VCR细胞膜P-gp表达的影响。Fig 7结果显示,在蛋白水平DTP-PDT可以剂量依赖性地抑制SGC7901/VCR细胞P-gp的表达。如Fig 8所示,在基因水平DTP-PDT可以剂量依赖性地抑制P-gp编码基因MDR1 mRNA的转录和表达,与Fig 7结果一致。
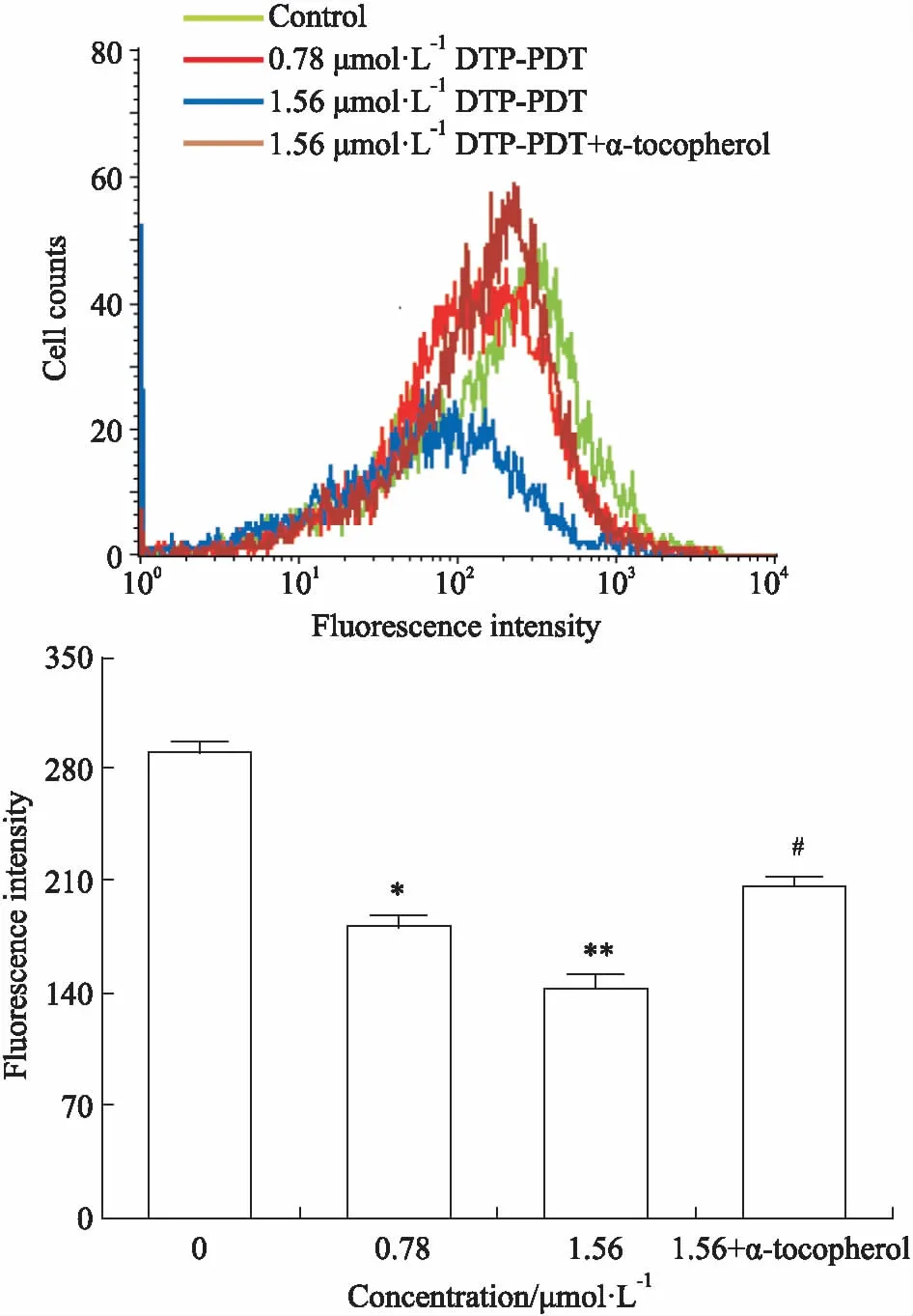
Fig 7 P-gp expression after DTP-PDT and effects of α-tocopherol n=3)
*P<0.05,**P<0.01vscontrol;#P<0.05vs1.56 μmol·L-1DTP-PDT
2.7 生育酚对DTP-PDT后P-gp和MDR1表达的影响Fig 7、8结果显示,生育酚可以明显削弱DTP-PDT对P-gp和MDR1 mRNA表达的抑制作用。
2.8 DTP-PDT与VCR联合治疗作用本实验用于评价DTP-PDT和VCR联合治疗的性质:协同、相加还是拮抗。Fig 9结果表明,在VCR组、DTP-PDT组及VCR+DTP-PDT组(5 ∶1),细胞存活率均随着药物浓度的增加而明显下降,且VCR + DTP-PDT联合治疗组的细胞存活率明显低于同等浓度两药的单独治疗组。采用CalcuSyn软件对量效曲线图进行分析,并计算联合指数(CI):CI< 1.0表示两药作用协同;CI= 1.0表示两药作用相加;CI> 1.0表
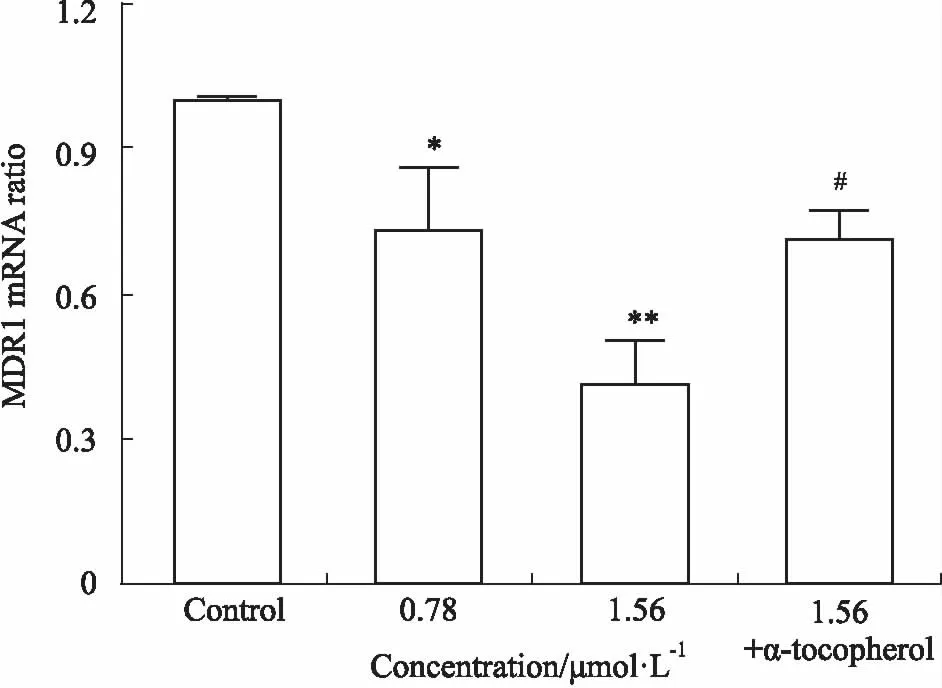
Fig 8 MDR1 mRNA level after DTP-PDT and effects of α-tocopherol n=3)
*P<0.05,**P<0.01vscontrol;#P<0.05vs1.56 μmol·L-1DTP-PDT示两药作用拮抗。本实验结果发现CI< 1.0,表明两药合用具有协同治疗作用(Tab 1)。
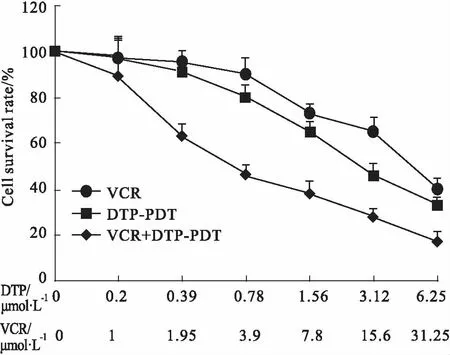
Fig 9 Combined therapy with DTP-PDT and VCR
2.9 生育酚对联合治疗的影响Fig 10结果显示,80 μmol·L-1的生育酚能够明显减弱DTP-PDT对SGC7901/VCR细胞的增殖抑制,但不影响化疗药VCR对细胞的抑制作用。同时,生育酚能够增加联合治疗的CI指数(Tab 2),表明可以一定程度上减弱DTP-PDT与VCR的协同治疗作用。

Tab 1 CI of combined treatment with DTP-PDT and VCR

Tab 2 Effects of α-tocopherol on CI of combined treatment with DTP-PDT and VCR
3 讨论
P-gp介导的药物外排是导致胃癌化疗失败的常见原因,寻求有效的P-gp抑制剂是解决肿瘤耐药问题的关键。由于PDT作用机制与化疗药物完全不同,被认为在克服多药耐药肿瘤上有巨大潜力[6-7]。本实验研究了一种新型卟啉类光敏剂对VCR耐药胃癌细胞SGC7901/VCR的治疗作用,以及对P-gp表达的影响和相关机制,能够为耐药胃癌治疗新策略的寻找提供理论依据。
本实验首先评价了DTP-PDT对SGC7901/VCR细胞增殖的影响。结果表明,DTP-PDT对体内外培养的耐药细胞均有明显的生长抑制作用,IC50为1.45 μmol·L-1,仅为敏感株(SGC7901细胞)的1.3倍(数据未显示)。暗毒性结果表明,DTP在无光照时对细胞生长无影响,药物较安全。
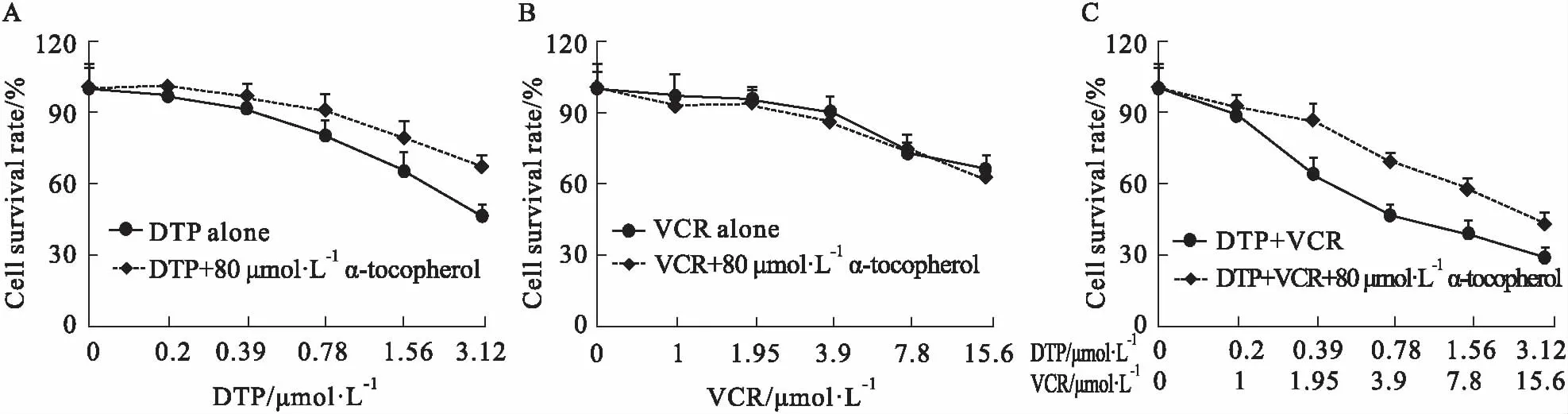
Fig 10 Effect of α-tocopherol on combined therapy with DTP-PDT and VCR n=3)
PDT主要是通过产生的单线态氧来杀伤肿瘤细胞。本研究测定了细胞内1O2产率。结果显示,DTP-PDT后细胞内有1O2产生。给予1O2捕获剂生育酚后,1O2产生减少,同时DTP-PDT对耐药细胞的杀伤作用亦减弱。PDT可通过多种途径杀伤癌细胞,如坏死、凋亡、自噬等[11]。Fig 5结果表明,DTP-PDT后,SGC7901/VCR细胞死亡方式为凋亡。因此认为,DTP-PDT可通过产生1O2,诱发耐药细胞凋亡而介导癌细胞死亡。
过表达的P-gp对药物的外排是导致化疗失败的重要原因。本实验研究了DTP-PDT对SGC7901/VCR细胞P-gp及编码基因MDR1表达的影响。结果表明,DTP-PDT能够有效抑制耐药细胞MDR1 mRNA转录和P-gp表达,有望逆转耐药。生育酚能够减弱DTP-PDT的这种抑制作用,结合生育酚是一种1O2捕获剂,推测DTP-PDT抑制MDR的机制可能为:DTP-PDT→1O2↑→ MDR1 mRNA转录↓→P-gp表达↓,当用生育酚捕获产生的1O2后,MDR1 mRNA转录和P-gp表达抑制均减弱。有研究报道,耐药细胞过表达的P-gp与细胞内1O2水平降低有关,升高1O2水平可以有效抑制P-gp的表达[8,12],本实验研究结果与文献报道一致。
本实验进一步研究了DTP-PDT与VCR合用对耐药细胞的治疗作用。结果显示,单用DTP-PDT治疗有效,单用VCR无效,DTP-PDT/VCR合用比二者单独应用对SGC7901/VCR细胞的杀伤作用更强。为评价两药合用的性质是相加、协同还是拮抗,我们计算了两药合用的联合指数CI。Tab 1结果显示CI值均<1.0,认为DTP-PDT与VCR合用对SGC7901/VCR细胞有协同治疗作用,且这种协同在低浓度时更明显。关于协同机制,结合前面研究结果,推测可能为:DTP-PDT→1O2产生→MDR1 mRNA转录↓→P-gp表达↓→细胞内VCR↑→耐药细胞恢复对VCR的敏感性,因此表现为协同。维拉帕米和环孢素A为已知的P-gp抑制剂,两者长期应用对机体有毒副作用[13]。PDT治疗时由于仅在光照局部产生反应,对机体的毒副作用较小。联合治疗方案不仅可以减少化疗药物用药剂量,减轻副作用,同时可以提高疗效,更有利于耐药肿瘤的治疗。因此,DTP-PDT可以作为一种有效的化疗辅助手段,用于MDR1相关耐药胃癌的治疗。
Fig 10和Tab 2的结果进一步验证了两药协同的机制。当加入生育酚后,两药合用的CI值均较无生育酚时增加,表明生育酚削弱了DTP-PDT与VCR的协同作用。基于前面研究结果,推测原因可能为生育酚捕获产生的1O2后,导致细胞P-gp表达依然很高,细胞内VCR被外排,耐药细胞对VCR的敏感性依然较低,从而减弱协同作用。
综上所述,新型卟啉类光敏剂DTP-PDT对VCR耐药胃癌细胞及其移植瘤的生长有明显抑制作用,细胞死亡方式为凋亡;DTP-PDT可以通过产生1O2,抑制耐药细胞MDR1基因mRNA和P-gp过表达,减少P-gp对化疗药物的外排,与化疗药物合用对耐药细胞有协同治疗作用。因此,DTP可以作为一个有潜力的光敏剂,用于临床多药耐药胃癌化疗的辅助治疗。
(致谢:本研究主要在长治医学院中心实验室完成,动物实验部分在中国医学科学院生物医学工程研究所动物实验中心完成。感谢长治医学院附属和平医院皮肤科梁艳玲老师在激光器使用过程中给予的技术指导。)

