腹腔镜食管裂孔疝修补术联合不同抗反流术式治疗食管裂孔疝合并胃食管反流病的临床比较
彭延春,刘祥尧,赵司卫
(贵州医科大学附属兴义市人民医院 普通外科,贵州 兴义 562400)
胃食管反流病(gastroesophageal reflux disease,GERD)是临床常见的消化道疾病,是由反流入食管的胃和十二指肠内容物引起的一系列症状,可引起食管症状和食管外症状。有研究[1]指出,GERD还可能引起心律失常和心房颤动等。有调查[2]显示,西方国家GERD患病率高达10.00%~20.00%,中国发病率低于该水平,但近年来发病率有明显上升趋势,部分地区接近欧美水平。食管裂孔疝(hiatal hernia,HH)是一种常见的解剖缺陷,指腹段食管、食管胃连接部和部分胃组织通过膈食管裂孔进入胸腔,是GERD发病的重要病因之一,故HH合并GERD在临床上并不少见。手术是治疗HH合并GERD的重要手段,其中腹腔镜食管裂孔疝修补术具有微创优势,能够恢复膈食裂孔处解剖结构,联合胃底折叠术可增强抗反流效果[3]。临床应用较多的抗反流手术主要包括Nissen、Toupet和Dor胃底折叠术,3种手术各有优劣,选择何种抗反流手术一直存在争议。本研究回顾性分析近3年接受腹腔镜食管裂孔疝修补术联合不同抗反流术式的HH合并GERD患者的病例资料,比较Nissen、Toupet和Dor胃底折叠术的效果,为临床选取合适抗反流术式提供依据。现报道如下:
1 资料与方法
1.1 一般资料
选取2014年1月-2017年1月本院行腹腔镜食管裂孔疝修补术联合抗反流术式治疗的HH合并GERD患者67例作为研究对象。纳入标准:符合2013年美国胃肠内镜外科医师协会HH指南[4]提出的HH诊断标准,符合“2014年中国胃食管反流病专家共识意见”[5]提出的GERD诊断标准,且均经临床诊断确诊;经规范内科治疗失败,或难以耐受内科治疗自愿选择手术治疗;符合手术适应证,且均可耐受;美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅰ或Ⅱ级。排除标准:有既往腹部手术史;合并严重心肺疾病无法耐受手术;肥胖者体质指数(body mess index,BMI)为28~32 kg/m2;合并有巨大HH,或已行其他抗反流手术治疗;术后未行电子胃镜复查和食管24 h pH阻抗检测等;有凝血功能障碍和急慢性感染史,术前诊断出发现其他病变需改变或联合其他手术方式治疗;失访患者。根据手术方法将患者分为3组,29例采用腹腔镜Nissen胃底折叠术(Nissen组),18例行腹腔镜Toupet胃底折叠术(Toupet组),20例行腹腔镜Dor胃底折叠术(Dor组),3组性别、年龄和BMI比较,差异均无统计学意义(P>0.05)。见表1。
1.2 术式选择
腹腔镜全包绕抗反流手术(Nissen胃底折叠术)适应证:①经正规内科治疗无效或出现食管炎、食管狭窄和Barrett食管等并发症;②经药物(最大治疗剂量)治疗后症状改善不明显;③合并有症状的食管旁疝;④患者拒绝质子泵抑制剂(proton pump inhibitor,PPI);⑤无法耐受药物副作用;⑥疾病严重影响生活质量。
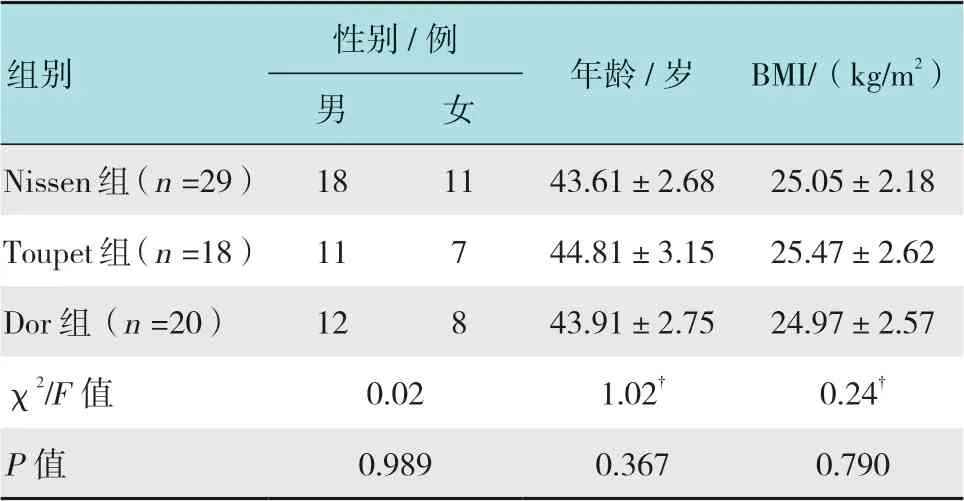
表1 3组患者基本资料比较Table1 Comparison of general data among the three groups
腹腔镜部分包绕胃底抗反流手术(Toupet和Dor胃底折叠术)适应证:①食管清除能力下降及食管蠕动异常;②严重吞气症;③无法达到全包绕胃底折叠术的条件;④无法耐受胃底折叠术的副作用;⑤对于贲门失弛缓症患者,行部分包绕胃底折叠术以保护切开的Heller肌;⑥食管下括约肌(lower esophageal sphincter,LES)压力正常或偏高;⑦以胸痛为主要症状,术前24 h pH检测正常。
1.3 手术方法
1.3.1 术前检查及治疗 所有研究对象均完善术前血常规、生化检查、凝血功能检查、心电图检查和常规肺功能检查等,评估患者能否耐受全麻、气腹手术和完善上消化道气钡双重造影、电子纤维胃十二指肠镜和食管24 h pH监测等检查,明确食管、胃底情况等;术前如存在高血压、糖尿病等,积极给予干预治疗,将血压、血糖控制在正常范围内。
1.3.2 手术方法 所有患者均行气管插管全麻,头高脚低位,术中根据手术情况调整体位;术者站在患者两腿之间,常规建立5孔气腹,分别位于右锁骨中线肋缘下、剑突下、左右腋前线肋缘下和脐上。如合并HH,则先将疝入胸腔的胃拖至腹腔。超声刀游离左三角韧带、肝外左叶并离断食管韧带和肝胃韧带,避免损伤迷走神经分支和食管壁,充分显露食管下段贲门两侧膈肌脚和胃底部,留出3 cm的空隙;再离断脾胃韧带直至胃底,游离胃近端大弯侧和胃近端小弯处,切断胃短动静脉;放置引流管1根绕食管一圈收紧,将食管下段向左下方牵扯,充分暴露两侧膈肌脚,剪短缝合,缩小食管裂孔,最后1针与食管留1 cm的空隙,如裂孔疝环>5 cm,用无张力补片修补,补片应覆盖疝环缘超过2 cm左右,疝修补缝合器固定布片。
1.3.3 抗反流手术方式 打开全膈食管筋膜,钝性游离食管下段及后方,自脾下极离断脾胃韧带至食管左侧膈食管筋膜。无损伤抓钳夹持胃底大弯边缘胃壁组织,经食道后方将胃底大弯侧部分胃壁拉至食管右侧,非吸收聚糖线于食管下段间断缝合2或3针,完成宽约2 cm的胃底360°折叠术,胃底缝合同定于两侧膈肌脚。Nissen手术用胃底完全包绕食管下段,缝到食管右侧小弯侧。Toupet手术将食管180~270°包绕,右侧胃底于食管前壁保留食管暴露缝合固定,而不是相互缝到一起。Dor手术在完成左右膈肌脚固定后无需继续分离食管,直接将胃底从食管前方拉至右侧,固定在右膈肌脚上,完成180°包绕食管。
1.3.4 术后处理 术后密切监测生命体征,进行心电监护,密切关注有无手术并发症,术后预防性使用鼻胃管至术后第2天上午,无腹部胀气或已排气后拔出胃管,先进食流质食物逐步向软食、普食过渡,少食多餐,术后早期下床活动。术前服用抑酸剂,如H2受体拮抗或质子泵阻滞药物,术后应继续服用2或3周。术后出现咳嗽、恶心和呕吐症状,及时给予针对性治疗,预防咳嗽、呕吐引起腹内压升高。出院后可恢复日常活动,6~8周内避免从事重体力劳动,注意饮食。
1.4 观察指标
1.4.1 手术情况及术后恢复情况 比较3组患者手术时间、术中出血量、术后进食时间、住院时间,并行使胃镜检查,观察手术前后食管黏膜恢复情况。
1.4.2 高分辨率食管测压及24 h食管pH监测 术前及术后第1年(保证停用影响食管运动的药物48 h以上,PPI停用72 h以上)行高分辨率食管测压及24 h食管pH监测。测压导管经鼻孔插入食管,远端孔全部至胃腔内。检查前禁食6 h以上,取平卧位,将4个通道置于食管体部LES上的3、8、13和18 cm处,定点牵拉法结合吞水试验(干咽或湿咽37℃温开水,100 ml/次),测LES功能、食管体部收缩蠕动功能,观察LES静息压、食管下段蠕动压。再插入pH导管,将pH电极固定于LES上缘的上方5 cm处,参考电极固定于胸前区。将食管内电极连接到体外的电子记录仪上,记录食管内24 h pH变化,监测期间不改变患者习惯,但避免进食pH<5的食物,并结合24 h食管内pH监测的各项参数计算DeMeester评分。
1.4.3 评分方法 出院后按时门诊随访,随访至术后第1年,发放GERD-Q症状评分评估患者GERD症状,回忆过去7 d中的症状,包括:阳性症状发作(烧心、反流)频率、阴性症状(上腹痛、恶心)发作频率、阳性影响(睡眠、额外用药)情况,无症状记为0分,症状出现1 d记为1分,症状出现2或3 d记为2分、症状出现4~7 d记为3分),累积总分0~18分,分值越低提示症状改善越明显;发放GERD相关生命质量量表(GERD-HROL)评估患者生活质量,评估内容包括:烧心程度、平卧或直立的烧心程度、餐后烧心程度、烧心症状引起的饮食变化、烧心对睡眠的影响、吞咽困难、吞咽有无引起疼痛和药物治疗对日常生活的影响等9项,按照程度分为0~5分,总分为0~45分,分值越低提示生活质量越高。
1.5 统计学方法
采用SPSS 18.0统计学软件进行数据分析,计数资料用率表示,采用χ2检验,等级资料采用秩和检验,计量资料采用均数±标准差(±s)表示,3组间比较采用单因素方差分析,进一步两两组间比较采用SNK-q比较;同组治疗前后采用配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者手术情况及术后恢复情况比较
3组患者手术时间、术中出血量、术后通气时间、术后进食时间和住院时间比较,差异均无统计学意义(P>0.05)。见表2。
2.2 3组手术前后胃镜检查结果比较
3组术后胃镜检查分级均较术前改善,差异有统计学意义(P<0.05)。术后第1年,Nissen组、Toupet组和Dor组胃镜检查分级为0级的分别为75.86%、77.78%和75.00%,明显高于3组术前的13.79%、16.67%和15.00%,差异有统计学意义(P<0.05),但3组术后1年组间比较,差异无统计学意义(P>0.05)。见表3。
2.3 3组患者手术前后高分辨率食管测压及24 h食管pH监测指标比较
3组术后第1年LES静息压最小值、LES静息呼吸平均值高于术前,反流时间、反流次数、24 h pH阻抗监测和DeMeester评分低于术前,差异均有统计学意义(P<0.05),Nissen组和Dor组无效吞咽较术前降低,Toupet组较术前增高,差异有统计学意义(P<0.05);Toupet组术后第1年LES静息呼吸平均值低于Nissen组和Dor组,反流时间、反流次数和无效吞咽高于Nissen组和Dor组,差异均有统计学意义(P<0.05),但Nissen组和Dor组比较,差异无统计学意义(P>0.05)。3组术后1年LES静息压最小值、24 h pH阻抗监测、DeMeester评分比较,差异均无统计学意义(P>0.05)。见表4。
2.4 3组手术前后GERD-Q症状评分和GERDHROL量表评分比较
术前3组患者GERD-Q症状评分和GERDHROL量表评分比较,差异均无统计学意义(P>0.05),术后第1年,GERD-Q症状评分和GERD-HROL量表评分均较术前下降,差异有统计学意义(P<0.05),但3组术后第1年上述评分比较,差异无统计学意义(P>0.05)。见表5。
2.5 3组术后并发症发生率、手术无效率和术后复发率比较
3组患者术后并发症发生率、手术无效率及复发率比较,差异均无统计学意义(P>0.05)。见表6。
表2 3组患者手术情况及术后恢复情况比较 (±s)Table2 Comparison of the operation and postoperative recovery among the three groups (±s)
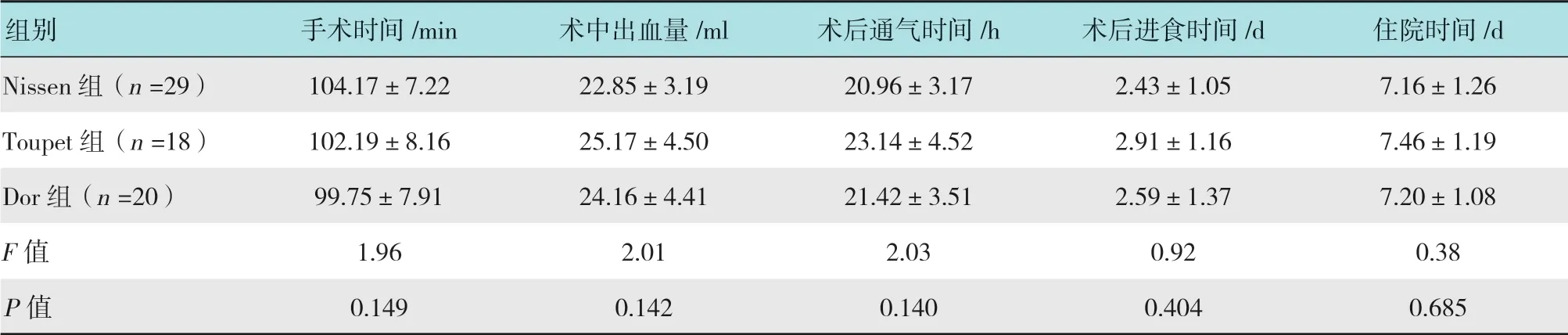
表2 3组患者手术情况及术后恢复情况比较 (±s)Table2 Comparison of the operation and postoperative recovery among the three groups (±s)
组别 手术时间/min 术中出血量/ml 术后通气时间/h 术后进食时间/d 住院时间/d Nissen组(n =29) 104.17±7.22 22.85±3.19 20.96±3.17 2.43±1.05 7.16±1.26 Toupet组(n =18) 102.19±8.16 25.17±4.50 23.14±4.52 2.91±1.16 7.46±1.19 Dor组(n =20) 99.75±7.91 24.16±4.41 21.42±3.51 2.59±1.37 7.20±1.08 F值 1.96 2.01 2.03 0.92 0.38 P值 0.149 0.142 0.140 0.404 0.685
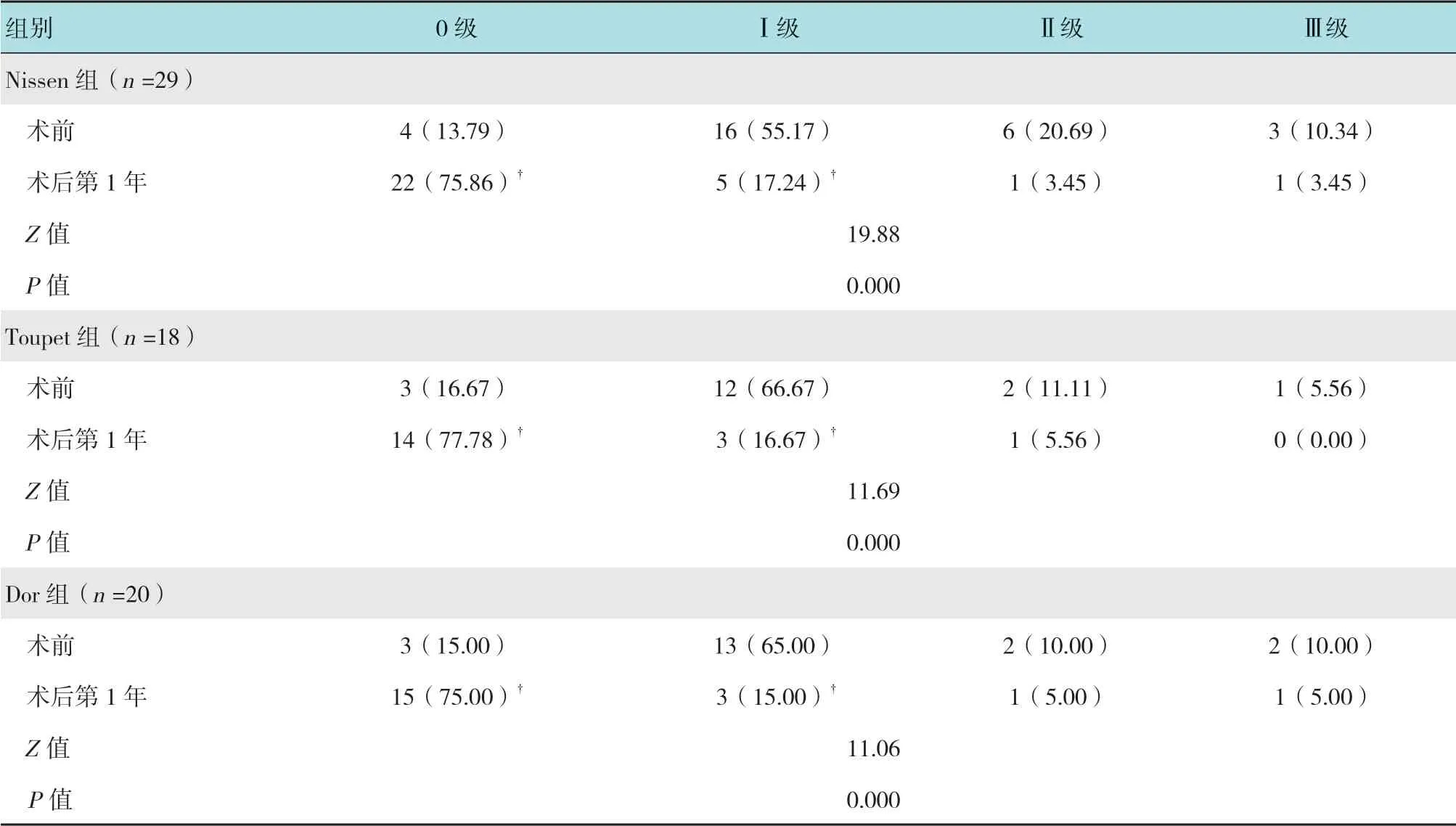
表3 3组手术前后胃镜检查结果比较 例(%)Table3 Comparison of the results of gastroscopy among the three groups before and after operation n(%)
表4 3组患者手术前后高分辨率食管测压及24 h食管pH监测指标比较 (±s)Table4 Comparison of high resolution esophageal manometry and 24 h esophageal pH monitoring among the three groups before and after operation (±s)

表4 3组患者手术前后高分辨率食管测压及24 h食管pH监测指标比较 (±s)Table4 Comparison of high resolution esophageal manometry and 24 h esophageal pH monitoring among the three groups before and after operation (±s)
注:1)与术前比较,差异有统计学意义(P <0.05);2)与Nissen组术后第1年比较,差异有统计学意义(P <0.05);3)与Toupet组术后第1年比较,差异有统计学意义(P <0.05)
DeMeester评分/分Nissen组(n =29) 术前 0.15±0.04 6.28±4.16 2.13±1.06 109.34±24.16 17.34±5.16 176.34±25.70 53.16±8.13 术后第1年 14.13±4.631) 19.34±3.691) 0.19±0.031) 10.34±2.271) 7.13±1.561) 7.67±1.341) 5.23±1.641) t值 32.24 17.92 19.17 40.34 16.36 67.18 52.84 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000 Toupet组(n =18) 术前 0.79±0.12 7.05±3.84 2.01±1.18 116.34±27.13 6.28±1.34 169.34±23.34 31.18±9.02 术后第1年 10.05±3.341) 13.57±2.191)2) 1.54±0.361)2) 23.05±3.681)2) 10.39±1.821)2) 8.26±1.521) 8.31±1.521) t值 22.71 9.17 2.59 25.69 11.04 54.98 18.41 P值 0.000 0.000 0.011 0.000 0.000 0.000 0.000 Dor组(n =20) 术前 1.49±1.12 7.81±3.91 0.65±0.23 104.19±31.20 16.05±1.64 164.13±25.35 19.13±8.96 术后第1年 13.69±4.311) 20.64±2.681)3) 0.21±0.101)3) 12.39±5.371)3) 8.07±1.721)3) 8.37±1.671) 6.15±1.811) t值 20.10 17.41 11.93 22.45 21.24 51.56 10.78 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000组别 LES静息压最小值/mmHg LES静息呼吸平均值/mmHg反流时间/h反流次数/次无效吞咽/%24 h pH阻抗监测
表5 3组患者手术前后GERD-Q症状评分和GERD-HROL量表评分比较 (分,±s)Table5 Comparison of GERD-Q symptom scores and GERD-HROL scale scores among the three groups before and after operation (score,±s)
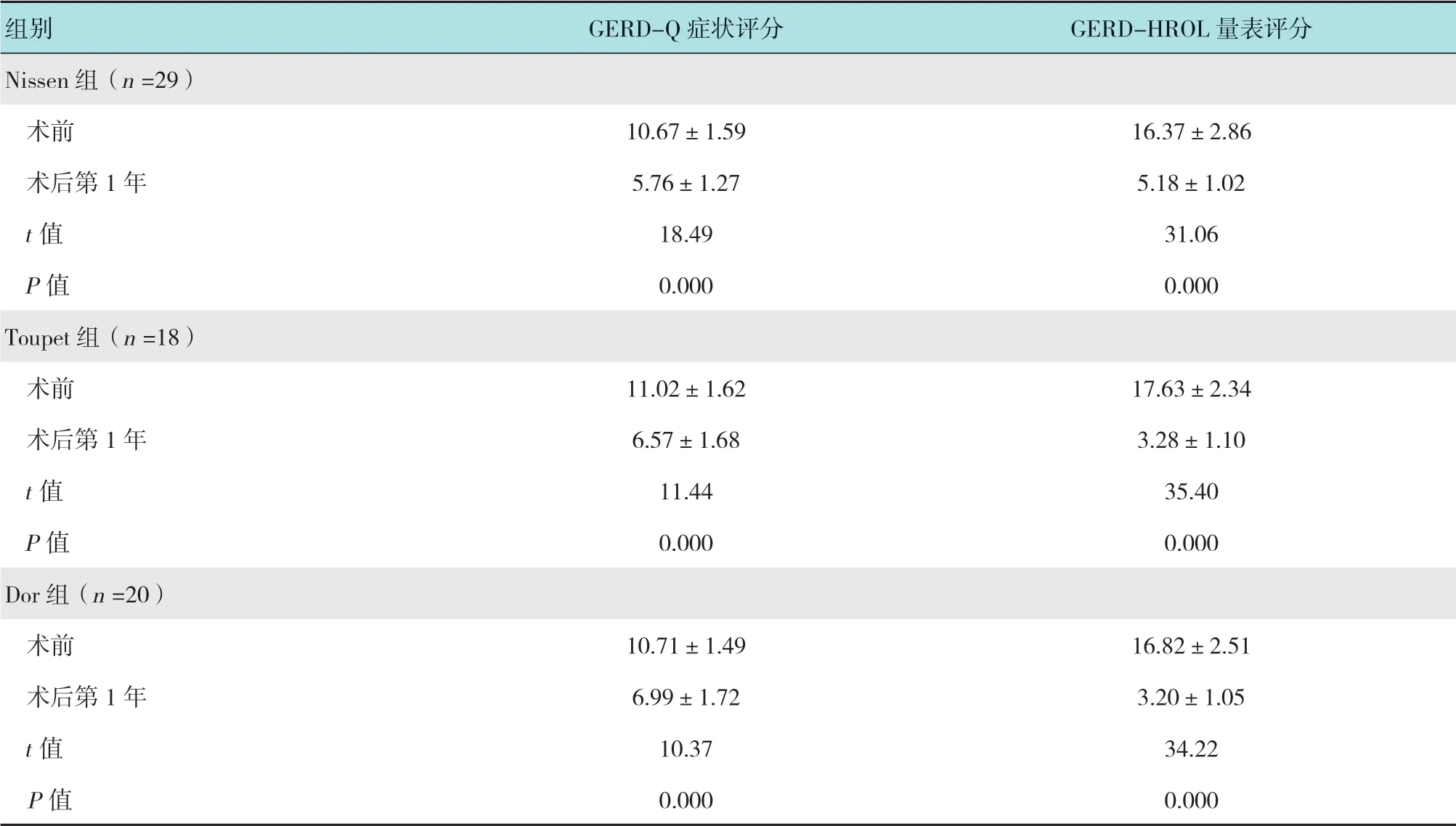
表5 3组患者手术前后GERD-Q症状评分和GERD-HROL量表评分比较 (分,±s)Table5 Comparison of GERD-Q symptom scores and GERD-HROL scale scores among the three groups before and after operation (score,±s)
组别 GERD-Q症状评分 GERD-HROL量表评分Nissen组(n =29) 术前 10.67±1.59 16.37±2.86 术后第1年 5.76±1.27 5.18±1.02 t值 18.49 31.06 P值 0.000 0.000 Toupet组(n =18) 术前 11.02±1.62 17.63±2.34 术后第1年 6.57±1.68 3.28±1.10 t值 11.44 35.40 P值 0.000 0.000 Dor组(n =20) 术前 10.71±1.49 16.82±2.51 术后第1年 6.99±1.72 3.20±1.05 t值 10.37 34.22 P值 0.000 0.000
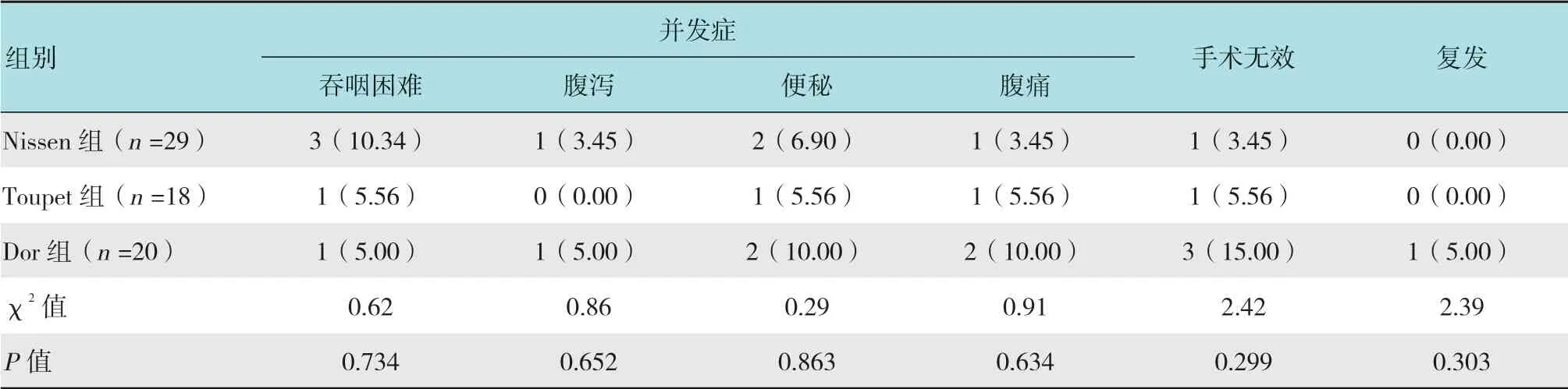
表6 3组患者术后并发症发生率、手术无效率和术后复发率比较 例(%)Table6 Comparison of the incidence of postoperative complications,operative failure rate and postoperative recurrence rate among the three groups n(%)
3 讨论
HH发病并不少见,40以上为疾病高发人群,发病率随年龄增加而增加。HH的危险因素较多,如食道发育不良、肥胖、慢性便秘以及其他引起腹腔压力长期增高的因素。HH可单独存在,也可合并GERD同时出现,HH中合并GERD患者有24.00%~64.00%,GERD患者中合并HH的有32.00%~52.00%。有研究[6]报道了HH与GERD的关系,明确了HH与GERD的密切关系,为外科手术治疗由HH引起的GERD提供了理论基础。
不同的胃底折叠术各有优缺点,国内外指南中并未明确关于胃底折叠术方式的选择。Nissen胃底折叠术最早由RUDOLPH NISSEN设计,经多次改进成熟后,于1977年形成最终成熟版手术方式,它是抗反流的经典术式,临床应用较为广泛[7]。Nissen手术可关闭HH复位贲门,同时通过瓣膜形成术,将胃内正压传到围绕食管的新建防反流瓣膜,并压迫食管,发挥抗反流的作用;此外,其还可通过升高LES压力、保持高LES静息压水平、增加腹内食管长度和防止胃底扩张等发挥抗反流作用。DESIDERIO等[8]指出,Nissen手术效果确切,但360°折叠会导致食管下段胃底包绕过于紧密,造成食管蠕动困难,增加术后吞咽困难和上段食管扩张等并发症发生率,可能影响患者术后生存质量。TOUPET和DOR等对Nissen进行改进,并提出了腹腔镜部分包绕胃底抗反流手术(Toupet和Dor式胃底折叠术),这些手术胃折叠角度低于360°,且多数情况下无需游离切断胃短血管,不仅可取得满意的抗反流效果,还可一定程度上预防吞咽障碍的发生[9-10]。有研究[10]提到,MATTIA等国外学者指出Toupet和Nissen式胃底折叠术治疗HH的抗反流效果基本一致。一项动物实验研究[11],分别采用Nissen、Toupet和Dor胃底折叠术治疗HH小猪,均可取得满意的抗反流效果。梁明强等[12]采用3种胃底折叠术治疗HH,3组患者术后恢复情况、术后并发症和术后复发率比较,差异均无统计学意义。本研究结果显示,3组患者术后LES静息压最小值、LES静息呼吸平均值、反流时间、反流次数、24 h pH阻抗监测和DeMeester评分比较,均较术前改善,差异有统计学意义(P<0.05),说明这3种手术均有抗反流的作用,但Toupet组LES静息呼吸平均值、反流时间、反流次数改善情况差于Nissen组和Dor组,说明Nissen组和Dor组在抑制反流的远期效果中更好。尹兴瑞等[13]指出,3种胃底折叠术均可取得满意的抗反流效果。
目前,对于这3种手术方式,多数研究焦点集中在术后吞咽困难的发生情况上。本研究发现,Nissen吞咽困难发生率略高于其余两组,但差异无统计学意义(P>0.05),这是因为Toupet和Dor手术折叠胃无张力,可减少胃、食管、脾损伤,从而减少吞咽障碍发生率,与丁轶人和刘宁等[14-15]研究结果相符,还可能与医生丰富的手术经验以及积极的术后饮食指导等有关。刁海鑫等[16]研究指出,术后近期吞咽障碍多与患者术后过早进食固体食物并维持以往饮食习惯有关,术后给予积极饮食指导,改善以往饮食习惯和饮食结构,多数患者症状可消失。另外,本研究结果显示,3组患者术后无效吞咽次数存在差异,其中Nissen和Dor手术患者均减少,Nissen最为显著,而Toupet较术前增加,结果说明,胃底折叠术并非导致术后吞咽障碍的全部因素,术前食管运动功能障碍、膈肌脚缝合过紧也可能增加术后吞咽困难的发生率。在手术无效率和复发率方面,Dor组略高于Nissen组和Toupet组,原因可能为Dor仅包绕180°与膈肌缝合,恢复贲门的反应能力有限。
手术过程中应注意以下几点:严格把握手术适应证,根据每位患者的实际情况实施胃底折叠术。对于术前食管运动功能良好、且术前食管24 h pH值监测结果显示为重度GERD的患者,选择Nissen胃底折叠术手术效果更好,对于术前食管运动功能欠协调或24 h pH值监测结果显示为中度GERD的患者,选择Toupet胃底折叠术手术效果更佳;手术期间暴露视野时操作应谨慎、小心,减少对肝脏、周围迷走神经的损伤;术中闭合食管裂孔宽度应适中,以一横指通过为宜,过紧可能导致术后吞咽功能障碍,过松可能造成手术失败;术中尽可能充分游离食管,广泛游离纵隔内食管,以增加腹段食管长度,还可在修补HH缺损时,从食管后方进行缝合以增加食管长度,预防术后复发;术中胃底折叠瓣与膈肌脚缝合固定3或4针,防止术后胃底折叠瓣或胃底组织向食管裂孔疝入,降低术后复发率。加强术后指导,术后第1天尽量避免用力排便和咳嗽等,术后2~4周可恢复正常活动,术后饮食遵循循序渐进的原则,如出现吞咽功能障碍,可先进行饮食指导,改变既往饮食习惯和结构,如仍未见改善,则行针对性手术治疗。
综上所述,腹腔镜食管裂孔疝修补术联合Nissen、Toupet和Dor胃底折叠术,治疗HH合并GERD均安全、有效,其中Nissen术后出现吞咽障碍的概率相对较高,但在缓解术后反流上,Nissen、Dor手术效果优于Toupet手术。临床应根据患者个体情况和手术医生技术水平等合理选择手术方式,以提高手术效果,降低术后并发症发生率。不足之处:本研究病例数较少,有待扩大研究对象,进行大范围、多中心和前瞻性研究,提高研究结果的客观性;有待延长随访时间,观察3种手术的远期效果。

