外科手术根治心脏再同步化治疗后感染性心内膜炎一例
李宗斌 张常莹 承燕 赵晓溪 李晓燕 焦国庆 王如兴
患者,男,57岁,因“活动后胸闷、气促3年余,再发1天”于2011年8月26日入院。心电图:窦性心律,完全性左束支传导阻滞(CLBBB),QRS波宽度162 ms。经胸心脏超声心动图(TTE):左房(LA)内径46 mm、左室(LV)内径75 mm、左室射血分数(LVEF)0.32、二尖瓣及主动脉瓣中度返流。冠状动脉CTA:未见冠状动脉狭窄病变。NT-pro-BNP:666.7pg/ml。诊断为“扩张型心肌病,二尖瓣、主动脉瓣关闭不全,CLBBB、心功能Ⅲ级”,于2011年09月08日进行心脏再同步化治疗(CRT),成功植入CRT-P系统,脉冲发生器型号:St. Jude Frontier II 5596,左室电极St. Jude 1258T,右房电极St. Jude 1642T,右室电极St. Jude 1688T(图1A)。术后程控优化起搏参数并予强心、利尿、拮抗交感和改善心室重构等药物治疗,恢复良好。2012年11月TTE:LA43 mm、LV60 mm、LVEF 0.49;并因“口干、消瘦”经葡萄糖耐量试验诊断为“2型糖尿病”,予口服降糖药物治疗,血糖控制在正常范围。
CRT后41个月患者发现左胸部脉冲发生器囊袋外下缘局部皮肤破溃(图2A),无红肿疼痛,无渗血渗液,无畏寒发热。无周围血管体征,无心脏杂音变化。血常规:正常。血培养:阴性。TTE:心腔内、电极上未见异常回声。诊断为“起搏器囊袋感染”,给予静脉滴注抗生素,并建议患者经导管介入拔除全套CRT-P系统。患者及家属拒绝拔除CRT-P系统,仅同意行脉冲发生器囊袋清创及重置术。术后继续静脉滴注抗生素,手术切口愈合良好(图2B),术后一周拆线出院。
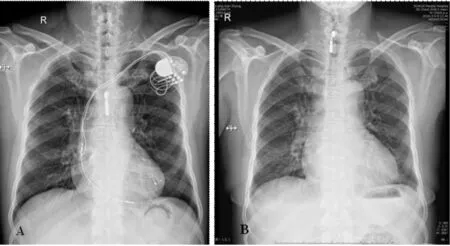
A:拔除CRT-P系统前;B:拔除CRT-P系统后胸片证实未遗留异物于心腔、血管内
图1拔除CRT-P系统前后胸片比较

A:左胸部脉冲发生器囊袋外下缘局部皮肤破溃;B:左胸部三处手术切口愈合良好
图2脉冲发生器囊袋及手术切口照片
CRT后48个月患者因“咳嗽、畏寒、发热两天”入院。体温最高38.5℃,左胸部三处手术切口愈合良好,脉冲发生器囊袋无红肿触痛,无周围血管体征,无心脏杂音变化。血常规:白细胞及中性粒细胞比例增高。血培养:阴性。TTE:心腔内、电极上未见异常回声。肺部CT:双肺下叶间质性改变。诊断为“肺部感染”,予静脉滴注抗生素一周体温正常、咳嗽消失、血常规恢复正常,予出院。
CRT后53个月再次因“畏寒、发热两周”入院。体温最高40.1℃,左胸部三处手术切口愈合良好,脉冲发生器囊袋无红肿触痛,无周围血管体征,无心脏杂音变化。血常规:白细胞及中性粒细胞比例增高。血培养(2次):表皮葡萄球菌。TTE:右房内条索状等回声影大小56 mm×15 mm,附着于电极导线,其尾部可在舒张期经三尖瓣进入右室(图3A)。诊断为“心血管植入式电子器械相关感染性心内膜炎(CIED-IE)”。给予静脉滴注抗生素,序贯应用“头孢西汀联合左氧氟沙星、万古霉素、亚胺培南联合莫西沙星”三种方案,共6周。患者仍有间歇畏寒发热,但间隔期延长、体温高峰下降,复查血培养多次均为阴性结果。复查TTE:右房内条索状等回声影大小18 mm×9 mm,附着于电极导线(图3B)。征得患者家属知情同意后立即于该日由心外科在全麻下开胸拔除全套CRT-P系统。手术经过如下:①经胸骨正中切口开胸,常规建立体外循环,上下腔静脉阻断后切开右心房;②探查右房心内膜一枚赘生物约30 mm×20 mm并缠绕电极导线,三尖瓣环处右房面一枚赘生物约10 mm×10 mm,右心耳处一枚赘生物约20 mm×10 mm,均予清除(图4A);③在右房上腔静脉入口处将三根导线电极剪断,徒手旋转牵拉将心腔内三根电极导线移除;④探查三尖瓣、右房及右室未见赘生物后关闭心房切口并逐层关胸;⑤打开脉冲发生器囊袋,取出脉冲发生器并游离囊袋内电极导线,徒手牵拉将上腔静脉内三根电极导线移除后关闭囊袋(图4B)。术后整理脉冲发生器及电极导线以确认全套CRT-P系统完整取出(图5A),并经胸片证实未遗留异物于心腔、血管内(图1B)。检查取出的赘生物,最大的一枚约60 mm×30 mm,质地坚韧(图5B)。赘生物病理检查报告:炎性纤维素性渗出物。术后继续静脉滴注抗生素,序贯应用“替考拉宁联合莫西沙星、替考拉宁联合亚胺培南”二种方案,共2周。未再出现畏寒发热,复查血培养多次均为阴性结果,手术切口愈合良好。出院后随访至今19个月,患者无畏寒发热,有乏力不适加重,无阵发性呼吸困难及肢体浮肿,服用“地高辛、呋塞米、螺内酯、培哚普利、美托洛尔”中。2017年9月复查心电图:窦性心律,CLBBB。TTE:LA49mm、LV66mm、LVEF 0.34。建议患者可再次进行CRT。
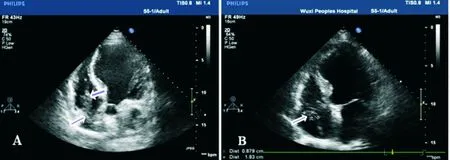
A:2016年01月22日TTE:右房内条索状等回声影大小56 mm×15 mm,附着于电极导线,其尾部可在舒张期经三尖瓣进入右室(箭头示);B:2016年03月04日TTE:右房内条索状等回声影大小18 mm×9 mm,附着于电极导线(箭头示)
图3抗生素治疗前后右房内赘生物经胸心脏超声心动图对比

A:探查右房内赘生物,予清除;B:打开脉冲发生器囊袋,取出脉冲发生器并游离囊袋内电极导线
图4外科手术中照片
讨论感染是心血管植入式电子器械(CIED)治疗的最严重并发症,CIED相关感染的发生率及死亡率各家报道不一,发生率1%~7%,死亡率3%~19%[1]。CIED相关感染的最佳治疗措施是尽早且完全移除全套CIED[1-3]。如果患者拒绝移除全套CIED,则保留电极导线,仅移除脉冲发生器也是可行的[4]。本例患者在CRT后3年多出现脉冲发生器囊袋感染,其诱因可能为糖尿病消瘦、冬季衣服厚以及左上肢较大幅度活动时反复摩擦囊袋外下缘。起搏器囊袋感染往往与电极导线感染及CIED-IE共存,因此,我们依据治疗指南建议患者经导管介入拔除全套CRT-P系统[2-3]。但患者及家属基于如下考虑:①CRT-P治疗效果较好;②拔除手术费用高,有一定的风险;③现用脉冲发生器剩余使用时间有数年,更换新的脉冲发生器费用较高;而拒绝拔除全套CRT-P系统或是更换脉冲发生器,仅行脉冲发生器囊袋清创及重置术。

A:外科手术取出的脉冲发生器及电极导线,确认全套CRT-P系统完整取出;B:外科手术取出的所有赘生物,其中最大的一枚赘生物约60 mm×30 mm,质地坚韧
图5经外科手术取出的CRT-P系统及所有赘生物
该患者在脉冲发生器囊袋清创及重置术后约1年出现畏寒、高热,血培养阳性,TTE发现赘生物,确诊为CIED-IE。CIED-IE多见于免疫功能低下或应用免疫抑制剂的 CIED患者,约占感染性心内膜炎的5%~10%,葡萄球菌属是最常见的致病菌,多侵犯三尖瓣[2]。因该患者赘生物巨大,我们依据指南建议患者经外科开胸手术拔除全套CRT-P系统[2,5-6]。目前指南建议充分抗生素治疗1周以上感染仍未控制、持续三尖瓣赘生物超过20 mm需外科开胸手术拔除[2];也有作者认为只要CIED植入超过1年或赘生物超过10 mm就需外科开胸手术拔除[5-6]。但患者及家属基于如下考虑:①外科开胸手术创伤大;②抗生素应用后如赘生物缩小可以通过经导管介入拔除全套CRT-P系统;而拒绝外科开胸手术,仅给予抗生素治疗。经过6周的抗生素治疗,多次复查TTE提示赘生物持续存在,即感染未能控制,直至此时患者家属终于同意拔除全套CRT-P系统。虽复查TTE发现赘生物较前明显缩小,但是基于如下考虑:①外科开胸手术移除全套CRT-P系统的成功率高于经导管介入拔除,尤其是心房翼状电极;②外科开胸手术的风险低于经导管介入拔除全套CRT-P系统;③外科开胸手术的费用低于经导管介入拔除全套CRT-P系统;④TTE测量可能存在盲区或误差,赘生物实际大小超过TTE测量值,有小的赘生物或是瓣膜损伤,TTE未能发现,需心内直视下探查,与患者家属沟通后最终还是选择外科开胸手术拔除全套CRT-P系统。术中探查见右房内赘生物3枚,最大的一枚头端附着于右房内膜面、尾段缠绕电极,其实际大小明显超过TTE测量值,可能其尾端伸展时可随血流经三尖瓣进入右室,此时TTE测量值较大,而其尾端缠绕电极时TTE测量值就较小。这提示TTE测量赘生物时存在盲区或误差,对其结果需慎重判定,经食管心超对赘生物的测定优于TTE[2],三维心超可能对赘生物的构造及毗邻关系更敏感[7]。而且该患者的赘生物是坚韧的纤维素性渗出物,如经导管介入拔除电极导线时,会有赘生物脱落,造成肺栓塞等严重后果。
个案报道中CRT系统相关的CIED-IE患者经外科开胸手术拔除CRT系统后仍因脓毒血症、多脏器功能衰竭而死亡[7-8]。而本例患者在移除CRT-P系统后,其感染迅速得到控制,距今已有19个月无畏寒发热,复查TTE未见赘生物。虽维持强心、利尿、拮抗交感、改善心室重构等药物治疗,但心功能衰竭又有加重,建议患者可再次进行CRT[2-3]。而外科开胸手术当时也曾考虑预留左室心外膜电极以备日后使用,但因顾虑患者感染不能控制而未施行。

