慢生根瘤菌接种花生的结瘤能力
黄小娜,谭 芳,姜福纯
(黔南民族师范学院 生物科学与农学院,贵州 都匀 558000)
生物固氮主要包括自生固氮和共生固氮。自生固氮是指某些微生物能够独立地完成固定大气中的分子氮的作用,这种固氮方式效率低下,固氮量有限[1]。而共生固氮是指固氮微生物和宿主植物共同完成固氮作用,这种固氮量要远远大于自生固氮,是天然的氮肥制造工厂,以豆科植物与根瘤菌的固氮作用最为明显[2]。根瘤菌是一类生活在土壤中的革兰氏阴性杆状细菌,在合适的条件下,根瘤菌能侵染豆科植物并与之进行共生结瘤固氮,将空气中游离态的氮气转化成植物可以利用的化合态氮。根瘤菌与豆科植物的共生是生物固氮体系中作用最强的体系,所固定的氮约占生物固氮总量的65%,在农业生产中起着极为重要的作用[3]。花生(Arachis hypogasa)属于豆科落花生属,是世界上种植面积最大的油料作物,由于营养丰富而在食品、饲料等领域有着广泛的用途[4]。花生在生长过程中,需要大量的氮素,花生根瘤菌能通过侧根杈口(Crack entry)进入根的皮层,刺激宿主(豆科植物)皮层细胞分裂形成根瘤[5],与花生通过有效的共生固氮作用,可以提供花生生育期所需氮素的50%,花生接种根瘤菌对花生荚果产量均有一定程度的提高[6],而花生慢生型根瘤菌的固氮能力高于同类根瘤菌[7]。如果筛选花生根瘤菌中具有较强结瘤能力和固氮活性的慢生根瘤菌,接种至花生植株,则可以提高花生结瘤固氮量,减少化学氮肥用量,改善环境,还可以提高花生的产量和品质,有效降低种植成本,这在研究豆科植物共生固氮方面有着重要意义。在筛选并检测花生根瘤菌结瘤能力和固氮活性时,一般采用盆栽接种的方法[8],目前BOX-PCR 技术被广泛应用于分析大量的固氮细菌菌株或分离株, 能够较好地揭示各个菌株在接种试验中的不同结瘤能力,为筛选高效菌株和制作混合菌剂或其他生物复合肥提供研究基础[9-10]。
OKAZAKI 等[11]发现光合型慢生根瘤菌(ORS 278)在没有使用结瘤因子而是通过某种未知的机制能在合萌(Aeschynomene indica)植株根际产生固氮根瘤,非光合型慢生根瘤菌(STM 6978)则以依赖性III型分泌系统(T3SS-dependent)产生固氮根瘤,推测菌株ORS 278与STM 6978有可能与花生形成结瘤。为此,笔者等对分离自花生根瘤的3种慢生根瘤菌菌株(DASA 03005、DASA 03183和DASA 03028)与分离自合萌根瘤的2种慢生根瘤菌菌株(ORS 278与STM 6978)进行人工接种,检测其结瘤情况、地表植株生物量及固氮酶活性,并采用BOX-PCR技术,比较分析5种接种菌株DNA指纹图谱与结瘤菌株的DNA指纹图谱之间的差异,为筛选合适的花生根瘤菌菌株及提高花生产量提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 仪器 气相色谱仪、恒温培养箱、摇床、无菌操作台、高压蒸汽灭菌锅、试管、气密微量注射器、pH计、高速离心机、自动PCR仪、电子天平、凝胶电泳仪、电泳槽。
1.1.2 材料 无菌水、0.01%刚果红、花生种子、蛭石、溴化乙锭(EB)以及琼脂糖等。
1.1.3 菌株及培养基 试验菌株为5种慢生根瘤菌菌株。DASA 03005、DASA 03183、DASA 03028菌株分离自花生根瘤;ORS 278、STM 6978菌株分离自合萌根瘤;阳性对照为结瘤菌株U 110、DOA 9和SUTN 9-2[12-14]。菌株皆为泰国苏兰拉里理工大学农业技术研究所生物技术学院NPN实验室保存。菌株培养用YMA培养基+0.01%刚果红,BNM营养液用于植株培养。
1.2 试验方法
1.2.1 盆栽接种试验 采用土培法进行盆栽接种试验,试验参照文献[15]的方法进行。
1.2.2 菌种活化及菌液制备
1) 菌种活化。配制300 mL的YMA培养液,pH为6.8,取200 mL YMA培养液加入3 g琼脂粉,100 mL不加琼脂。培养液用高压蒸汽锅灭菌30 min,温度设置为121 ℃。待200 mL YMA冷却至60 ℃,滴2~3滴0.01%刚果红溶液摇匀,在无菌操作台中倒平板制作5个培养基。用接种环挑选备用菌种单菌落,用平板划线法接种至培养皿并标记,28℃恒温倒置培养5~7 d。
2) 菌液制备。5支塑料试管高压灭菌后,在无菌操作台上各加入10 mL YMA培养液,用接种环分别挑选1~2个单菌落于试管中,封口,摇床培养2~3 d。
1.2.3 种子表面灭菌及催芽 使用蛭石作为基质种植花生,挑选籽粒饱、干净、大小一致花生种子,95%乙醇浸泡10 min,用无菌水清洗3次后弃去废液,3%次氯酸钠浸泡1 min,用无菌水清洗5次后浸泡过夜,次日播种于装满蛭石的铁钵(已作灭菌处理),密封后28℃恒温培养2~3 d。
1.2.4 盆栽试验装置准备 装置为Leonard双层罐子,蛭石经水浸泡后装满Leonard罐子上层,密封后放入高压蒸汽灭菌锅灭菌,冷却待用。配制pH为6.8的BNM(无氮植物营养液)营养液10 L ,密封高压灭菌后冷却待用。
1.2.5 花生播种与菌株接种 待花生种子芽长为2~3 cm,在无菌操作台上移植到已进行灭菌处理的Leonard罐子里,胚根向下,每个1粒,下层装入2/3体积的YMA培养液后把Leonard罐子移入光温室培养。7 d后分别向花生根部接种5种慢生根瘤菌菌株(DASA 03005、DASA 03183、DASA 03028、ORS 278和STM 6978)1 mL菌液,每组菌液接种3株花生,对照组不接种菌液,总计6组18株。培养3周并按时添加BNM营养液。
1.2.6 数据收集
1) 检查结瘤情况及测定植株干重。3周后,从温室移出植株,拔出花生植株清理干净附着在根部的蛭石,检查空白对照组有无结瘤,有结瘤说明对照植株被杂菌污染,接种培养失败,反之则可以继续下一步试验,即计数试验组植株结瘤数并记录。计数结束,用剪刀剪下植株根部,地上植株部分放在恒温箱烘干24 h后称重并记录数据,温度条件为65℃。
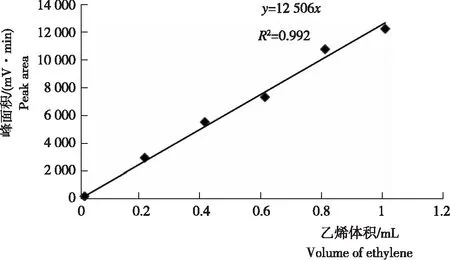
2) 固氮酶活性测定。测定标准乙烯峰面积。取1.0 mL标准乙烯注入气相色谱仪中,记录峰面积并注意出峰时间,测量3次取平均值,作为乙烯定量依据之一。用气密微量注射器分别抽取0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL乙烯标准气体,测定相应体积的峰面积,以保留时间定性分析。绘制体积与峰面积标准曲线图。用清水冲洗干净花生根部,吸掉多余的水分后放入规格为80 mL的试管中并用橡皮塞密封。定时(相邻2个待测样品间隔5 min)用气密微量注射器从试管中吸取1 mL空气后注入等体积乙炔气体,培养1 h。吸取1 mL待测样品注入气相色谱仪开始测定。色谱条件:进样温度86 ℃,FID检测温度200℃。固氮酶活性用乙烯浓度表示,计算公式[16]:N=(hx×C×V)/(hs×常数×t)。式中,hx:样品峰面积;C:标准C2H4浓度(39.499 nmol/mL);V:试管体积(80 mL);hs:标准C2H4峰面积;常数:1 mL(标准乙烯测试体积);t:待测样品培养时间(h);N:产生的C2H4浓度,单位为nmol/(h·mL)。
1.3 BOX-PCRDNA指纹图谱分析
BOX-PCR技术的一般分析过程包括以下3个步骤[17]:基因组DNA的提取,以BoxA1R-1(5′-CCTCGGCAAGGCGACGCTGACG-3′)为引物进行选择扩增,凝胶电泳分析。
1.3.1 细菌总DNA提取 取处于对数期的3 mL菌液于离心管中,用0.5 mL 1×TEN(10 mM Tris8.0,10 mM EDTA,100 mM NaCl)缓冲液清洗2次。依次加入含有20%蔗糖溶液的缓冲液300 μL、10% SDS(100 mg/mL) 100 μL、10 mg/mL核糖核酸酶(RNase)30 μL、2 mg/mL溶菌酶(现配)20 μL。旋涡振荡5 min,混合均匀,然后在37℃下恒温培养60 min,使其完全溶解。加入5M NaCl 75 μL溶液倒置反复摇匀,加入500 μL苯酚/氯仿/异戊醇(25∶24∶1)。旋涡振荡5 min,混合均匀后,14 000 r/min高速离心10 min。收集上清液,加入2体积纯乙醇+0.1体积3M NaOAC反复颠倒5~6次,20℃低温放置30 min。13 000 r/min高速离心10 min后用70%乙醇洗涤2次;13 000 r/min高速离心5 min后室温干燥。用50 μL纯水溶解DNA,放置于-20℃冰箱备用。
1.3.2 琼脂糖凝胶电泳检测DNA 配制1%琼脂糖凝胶(用电子天平称取1 g琼脂糖,100 mL 5×TAE buffer),微波炉加热至完全融化(2 min)。冷却至60℃倒胶,加入4滴EB溶液,待胶凝固后拔出梳子。将凝胶槽转放入电泳槽,加入5×TAE buffer,保证液面高于凝胶表面,将3 μL DNA样品和2 μL上样缓冲液合均匀后加入到凝胶点样孔,在一侧点样孔加5 μL Marker。电泳仪电压设置为100V,跑胶30 min。停止电泳后凝胶成像系统拍照分析。
1.3.3 BOX-PCR扩增条件 以DNA为模板,BoxAIR-1为引物进行选择扩增。扩增反应体系为25 μL,反应物含5 μL 5 × PCR buffer, 2.5 μL MgCl2(25 mM),0.5 μL dNTP(10 mM),0.25 μL DNA聚合酶, 5 μL BoxAIR-1(10 pM)引物,2 μL DNA模板,其中菌株DASA 03028、U 110和SUTN 9-2的DNA量为1 μL,ddH2O补足至25 μL。设置阳性对照和阴性对照,菌株U 110、DOA 9和SUTN 9-2作阳性对照,以不加DNA为阴性对照。BOX-PCR扩增程序为95 ℃预变性5 min, 94℃变性0.5 min, 53℃退火1 min,56℃延伸8 min,进行35个循环反应,69℃最终延伸10 min。扩增结束后PCR产物于-20℃冰箱保存。取7 μL PCR产物进行凝胶电泳,1 kb DNA Marker做参照,1%琼脂糖凝胶。电泳条件:电压80 V,电流400 mA,时间48 min。最后用BIORAD凝胶成像系统拍照分析。
2 结果与分析
2.1 乙烯标准样品线性
在 0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL乙烯标准气体条件下测定相应体积的峰面积,以保留时间(2.5 min)定性分析,绘制体积与峰面积标准曲线图。一般地,当R2在0.95~1.0时表示线性良好。从图1看出,乙烯标准曲线的R2为0.992,表明,乙烯标准样品线性良好。
2.2 试验菌株的基因组DNA
从图2看出,菌株DASA 03028、U 110和DOA 9的DNA浓度较高,但不影响后续试验,只需减少DNA的量即可。

2.3 5种菌株接种花生的结瘤能力
5种菌株接种之后,DASA03005、DASA03028、DASA03183、STM6978和ORS278菌株的单株植株平均结瘤数分别为0、93.7个、91.3个、75.3个和0;其单株植株平均干重分别为1 150.6 mg、1 656.2 mg、1 638.8 mg、1 433.1 mg和808.6 mg。从表1看出,接种ORS 278与DASA 03005菌株的花生根部无结瘤,表明DASA03005、ORS278菌株不能在花生上结瘤。DASA03028的结瘤数略大于DASA03183,STM6978的结瘤数相对前两者较低,表明花生慢生根瘤菌DASA 03028、DASA 03183有较强的结瘤能力。接种DASA 03183、DASA 03028和STM6978菌株的花生植株干重较大,结瘤植株的生物量明显高于无结瘤植株。其中,接种菌株DASA03028植株的生物量居第一位,接种菌株DASA03183植株生物量略低,菌株STM6978的植株生物量相对前两者较低。接种的菌株结瘤数越多,地表植株的生物量也相应的较大。表明根瘤固氮可以为地上部植株的生长提供含氮有机物,提高作物的光合速率及增加光合产物。

表1 接种5种菌株后花生的根部结瘤数及地表植株干重
2.4 5种菌株的固氮酶活性
从图3看出,DASA03005和ORS278的固氮酶活性为0,这是由于株菌DASA03005和ORS278未能与花生形成结瘤。DASA03028和 DASA03183的固氮酶活性较高,代表固氮酶活性的乙烯浓度分别为1 351.01 nmol/(h·mL)和1 241.61 nmol/(h·mL);STM 6978的固氮酶活性相对较低,其代表固氮酶活性的乙烯浓度为1 013.89 nmol/(h·mL)。表明菌株DASA 03028、DASA 03183具有较强的固氮能力。

2.5 BOX-PCR扩增分析
利用BOXA1R引物对5种菌株和对照组菌株进行选择扩增,通过凝胶电泳分析,获得菌株的图谱类型。从图4看出,以DNA Marker作参照,采用BOX引物扩增的多态性条带均在1.0~4.0 kp。其中,DASA03028与对照菌株DOA9和SUTN9-2的图谱基本一致,DASA03183与DOA9在2.0 kb、3.0kb和4.0kb处的条带一致;DASA03005虽然有6条带,但只在3.0 kb和4.0 kb处的2条带是清晰的,与对照组有显著差异;ORS278共有4条清晰的条带,分别位于1.5 kb、2.0 kb、3.0 kb和4.0 kb处,和3个对照组菌株的条带都有显著差异;菌株STM6978共有8条带,其条带与结瘤菌株U110的图谱基本一致。

3 结论与讨论
花生盆栽接种5种慢生根菌株DASA03028、DASA03183、DASA03005、ORS278和STM6978,其中菌株DASA03028、DASA03183和STM6978能与花生形成结瘤,DASA03005和ORS278不能与花生形成结瘤。由此可见,分离自花生的慢生根瘤菌不一定都能与花生形成结瘤。分离自合萌的非光合型慢生根瘤菌菌株STM6978能与花生形成结瘤,很大程度上可能是依赖于T3SS的缘故。菌株DASA03005和ORS278虽不能与花生形成结瘤,却能与合萌形成结瘤[11],至于菌株DASA03005是否与光合型慢生根瘤菌菌株ORS278一样具有某种未知的机制,且这种机制是否只能在特定的宿主范围内发挥作用,有待更进一步的研究。
5种菌株中,菌株DASA03028接种花生具有很强的结瘤能力和固氮活性,DASA03183次之,STM6978较前两者低。DASA03028与DASA03183在接种花生3周后,花生单株植株结瘤达到100个以上,结瘤数相对DASA03183(单株结瘤数最大可达85个)多。乙炔还原法对固氮酶活性进行测定显示,菌株DASA03028和DASA03183的固氮酶活性优于菌株STM6978,表明结瘤数越多,固氮酶活性越强,结瘤数与固氮酶活性之间存在一定的关系,这一规律和张宏等人的研究结论一致[18-20]。通过对地表植株生物量进行测定发现,接种的菌株结瘤数越多,地表植株的生物量也相应较大,表明根瘤固氮可以为地上部植株的生长提供含氮有机物,提高作物的光合速率及增加光合产物[1,12]。接种菌株DASA03028与DASA03183的花生地表植株干重也较接种STM6978的重,表明,根瘤固氮作用越强,植株的干重越重。
通过对5种菌株的BOX-PCR指纹图谱分析表明,5种菌株的扩增条带存在多态性差异,其中菌株DASA03028、DASA03183和STM6978与对照组菌株的DNA指纹图谱基本一致,DASA03005和ORS278则差异较大。BOX-PCR指纹图谱分析技术能有效区分种、属及菌株的遗传差异,尤其是不同菌株间易产生清晰的特异性条带,应用BOX-PCR 技术对根瘤菌菌株进行遗传指纹图谱分析, 可以揭示不同根瘤菌菌株的结瘤能力[10], 如果配合植物的生长性状,则可以准确地筛选高效根瘤菌菌株。

