黑果腺肋花楸原花青素分离纯化工艺研究
滕 飞,李 丽,皮子凤
(1.长春师范大学,吉林长春 130032;2.中国科学院长春应用化学研究所,吉林长春 130022)
黑果腺肋花楸(AroniamelanocarpaElliot)是蔷薇科,腺肋花楸属灌木,原产于北美东北部,是美国特有的一种集食用、生态多种功能于一身的珍贵树种。果实单宁含量较高,使其口感略微酸涩,球形,且果皮紫黑,果肉暗红[1]。黑果腺肋花楸果实具有非常突出的保健作用,果实及其提取物对心脏病、高血压等心脑血管疾病具有特殊的疗效,在欧美地区广泛应用于医药和功能食品工业。1990年,我国从朝鲜引进一个品种,至今我国已拥有了该树种较为丰富的种质资源基础。国内外研究结果表明,黑果腺肋花楸果实中富含黄酮、原花青素等多酚类成分,且多酚类成分是目前已知植物中含量最高的[2],每100 g果子中大约含有2500 mg的多酚类化合物,而其中又以原花青素类物质的含量最高。研究表明,原花青素具有很强的抗氧化能力,对降血压、降血糖[3]以及治疗心血管疾病都有很大的帮助。
大孔树脂吸附纯化法是目前使用最广泛的一种纯化方法,常用于药物以及功能性成分的纯化[4]。本文拟采用大孔树脂吸附纯化法对黑果腺肋花楸果实中的原花青素进行分离纯化。
1 实验部分
1.1 仪器与设备
PHS-2C型数字显示酸度计(上海光学仪器厂);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);分析天平(上海越平科学仪器有限公司);JJ-2匀浆组织捣碎机;KS-5000P离心机(北京东迅天地医疗仪器公司);R100旋转蒸发仪(上海申生科技有限公司);SpectraMax i3酶标仪;SHB-B88型循环水式多用真空泵;层析柱(1.8 cm×30 cm)。
1.2 材料与试剂
黑果腺肋花楸冻果(鲜果洗净沥干放于-20℃冷冻,沈阳睿洋农业有限公司);原花青素标准品(上海融禾医药科技有限公司,生产批号:180326);正丁醇、盐酸、乙醇、甲醇均为分析纯(北京化工厂);硫酸高铁铵溶液(NH4Fe(SO4)2·12H2O)(上海麦克林生化科技有限公司,用浓度为2 mol·L-1的盐酸配置成2%(w/v)的溶液);DM130型大孔树脂、X-5型大孔树脂、AB-8型大孔树脂、D101型大孔树脂、NKA-9型大孔树脂(艾美科健(中国)生物医药有限公司)。
1.3 原花青素含量的测定方法
称取原花青素标准品10 mg溶于10 mL甲醇中,吸取该溶液0、0.6、0.9、1.2、1.5、1.8 mL置于10 mL容量瓶中,加甲醇至刻度,摇匀。将正丁醇与盐酸按95∶5的体积比混合后,取出6 mL置于具塞锥瓶中,再加入0.2 mL硫酸高铁铵溶液和1 mL上述原花青素溶液,混匀,置沸水浴回流,精确加热40 min后,立即置冰水中冷却,在加热完毕15 min后,于546 nm波长处测吸光度[5]。
1.4 黑果腺肋花楸原花青素提取条件优化
根据战伟伟等[6]研究的多种提取剂对原花青素提取的影响结果,本文拟采用正交实验考察不同浓度乙醇、料液比、提取时间和提取溶液pH对原花青素提取率的影响,确定最佳提取工艺。正交实验因素表见表1。

表1 正交实验因素表
1.5 黑果腺肋花楸原花青素分离纯化工艺研究
1.5.1 大孔树脂的预处理
将AB-8、D101、DM130、NKA-9、X-5五种大孔树脂分别置于无水乙醇中进行活化,不断搅拌除去气泡,浸泡24 h,使其充分溶胀。用蒸馏水冲洗至无醇味[7]。
1.5.2 大孔树脂的筛选
称取一定量的果浆,采用最佳提取方法超声提取,离心取上清液,使用旋转蒸发仪于60℃条件下减压浓缩除去乙醇。加水稀释后离心取上清液,沉淀物加水溶解再次离心,合并上清液。测定溶液中原花青素的浓度。
分别称取预处理好的5种大孔树脂各5 g,放于100 mL锥形瓶中,加入50 mL一定质量浓度的黑果腺肋花楸原花青素粗提液,于震荡器中震荡吸附24 h。取上清液测定溶液中原花青素含量,并按公式(1)、公式(2)计算吸附量及吸附率。
使用蒸馏水清洗吸附后的大孔树脂,至表面无黑果腺肋花楸原花青素粗提液残留后,加入50 mL 70%乙醇溶液。放入振荡器中静态解吸24 h[8-9],取上清液测定原花青素含量,并按公式(3)计算解吸率[10]。
(1)
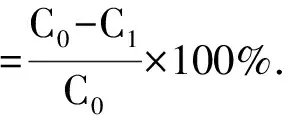
(2)
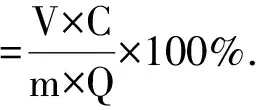
(3)
其中,Q为吸附量(mg·g-1);C0为起始质量浓度(mg·mL-1);C1为平衡质量浓度(mg·mL-1);V1为吸附溶液体积(mL);m为树脂质量(g);C为解吸后溶液中原花青素质量浓度(mg·mL-1);V为解吸溶液体积(mL)。
1.5.3 大孔树脂动态吸附—解吸条件优化
(1)将预处理后的大孔树脂装柱,测定柱体积(BV)和树脂装量。
(2)按照确定的最佳提取工艺提取黑果腺肋花楸,将提取液浓缩至无醇味后上柱,分别将流速控制在0.5 mL·min-1、1 mL·min-1、1.5 mL·min-1、2 mL·min-1、3 mL·min-1,以1BV为单位收集流出液,确定流出液中原花青素浓度,以流出体积为横坐标,原花青素的浓度为纵坐标绘制曲线。以流出液中原花青素的浓度达到上样浓度的1/10为泄漏点,当吸附的过程中达到了树脂的泄漏点时,树脂的吸附达到饱和,此时树脂的吸附量达到最大值。
(3)确定最佳上样流速后,分别将不同浓度的提取液上样,收集流出液,测定流出液中的原花青素含量。以流出体积为横坐标、原花青素的浓度为纵坐标绘制流出曲线。以流出液中原花青素的浓度达到上样浓度的1/10(泄漏点),停止收集,合并流出液,测定流出液中的原花青素含量,从而计算不同浓度下的吸附率,找到最佳上样浓度和上样量。
(4)确定好最佳浓度、最佳上样流速、上样量后,按照该条件上样。上样后静止2 h,用4 BV水冲洗,然后分别以不同浓度(乙醇洗脱),每个浓度洗脱4 BV,合并各浓度洗脱液,分别测定洗脱液中原花青素含量[11]。
2 结果与讨论
2.1 原花青素含量测定标准曲线
标准曲线回归方程为Y=2.4505X+0.0418,R2=0.9918,在0~0.3 mg·mL-1范围内具有良好的线性。标准曲线如图1所示。

图1 原花青素含量测定标准曲线
2.2. 黑果腺肋花楸原花青素提取条件优化
条件优化正交实验结果和方差分析如表2、表3所示。从直观分析及方差分析上述实验结果表明,各项因素对工艺影响为:提取时间>料液比>乙醇浓度>pH。4个因素中提取时间对黑果腺肋花楸原花青素的提取率的影响较为明显。因此从正交表优选的工艺为A2B2C2D1。按照A2B2C2D1的条件进行验证实验,测定提取液的原花青素含量为0.988 mg·mL-1,与正交实验结果相一致。因此,确定黑果腺肋花楸提取条件为pH=3的70%乙醇,料液比1∶15,超声提取30 min。

表2 黑果腺肋花楸原花青素提取工艺正交试验结果表
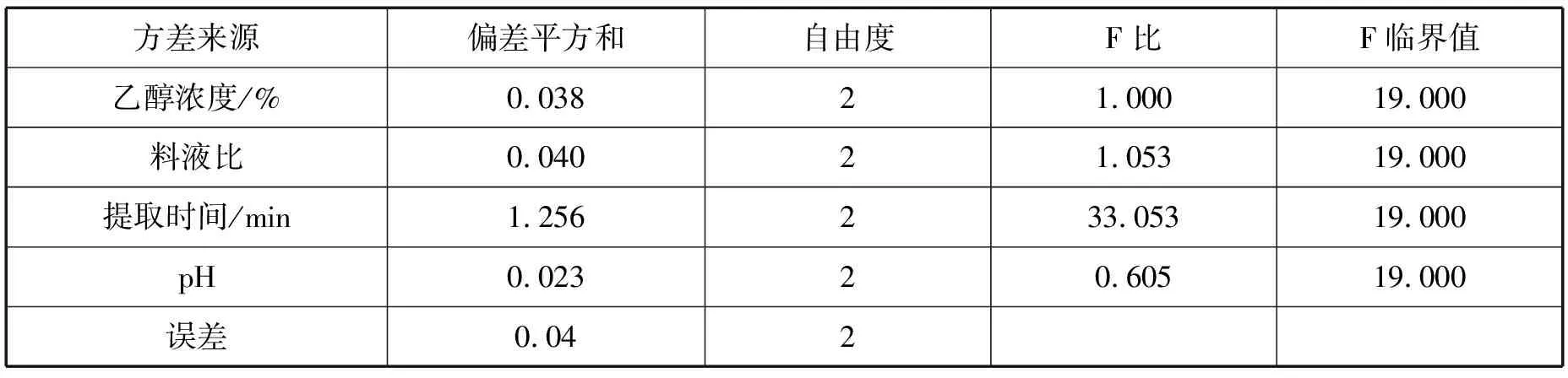
表3 正交实验方差分析结果
2.3 黑果腺肋花楸原花青素分离纯化工艺研究
2.3.1 大孔树脂的优选
通过1.5.2方法对大孔树脂吸附黑果腺肋花楸原花青素吸附能力进行测定,得到各树脂对黑果腺肋花楸中原花青素的吸附率与解吸率如表4所示。

表4 不同大孔树脂对黑果腺肋花楸中原花青素的吸附能力比较
2.3.2 DM130大孔树脂动态吸附—解吸条件优化
2.3.2.1 上样流速对大孔树脂动态吸附能力的影响
当流出液中原花青素质量浓度达到原液中原花青素质量浓度的1/10时,即为泄漏点[12]。将流速分别设为0.5 mL·min-1、1 mL·min-1、1.5 mL·min-1、2 mL·min-1、3 mL·min-1,其泄漏点分别出现在13.5 BV、11 BV、10 BV、7 BV、3.5 BV附近(图2)。随着上样流速的增加,到达泄漏点时的上样量逐渐减小。由于流速过快,会使得黑果腺肋花楸原花青素无法被大孔树脂内表面充分吸附,导致吸附效果降低[12];而流速过低,会大大延长实验周期。综合考虑,选择2 mL·min-1作为最佳上样流速。

图2 上样流速对大孔树脂动态吸附黑果花楸原花青素的影响
2.3.2.2 上样浓度对大孔树脂动态吸附能力的影响
使用原花青素浓度分别为0.25 mg·mL-1、0.5 mg·mL-1、1 mg·mL-1的浓缩液,按照最佳上样流速上样,测定泄漏点。结果如图3所示,泄漏点分别在14 BV、10 BV、6 BV。因0.25 mg·mL-1、0.5 mg·mL-1浓度低,导致上样量变大,上样时间变长,延长试验周期。故选择最佳上样浓度为1 mg·mL-1。

图3 上样浓度对大孔树脂动态吸附能力的影响
2.3.2.3 上样量对大孔树脂动态吸附能力的影响
按照最佳流速与最佳浓度上样,泄漏点在6 BV(图4)。最佳上样流速为2 mL·min-1、最佳上样浓度为1 mg·mL-1,最佳上样量为6 BV。
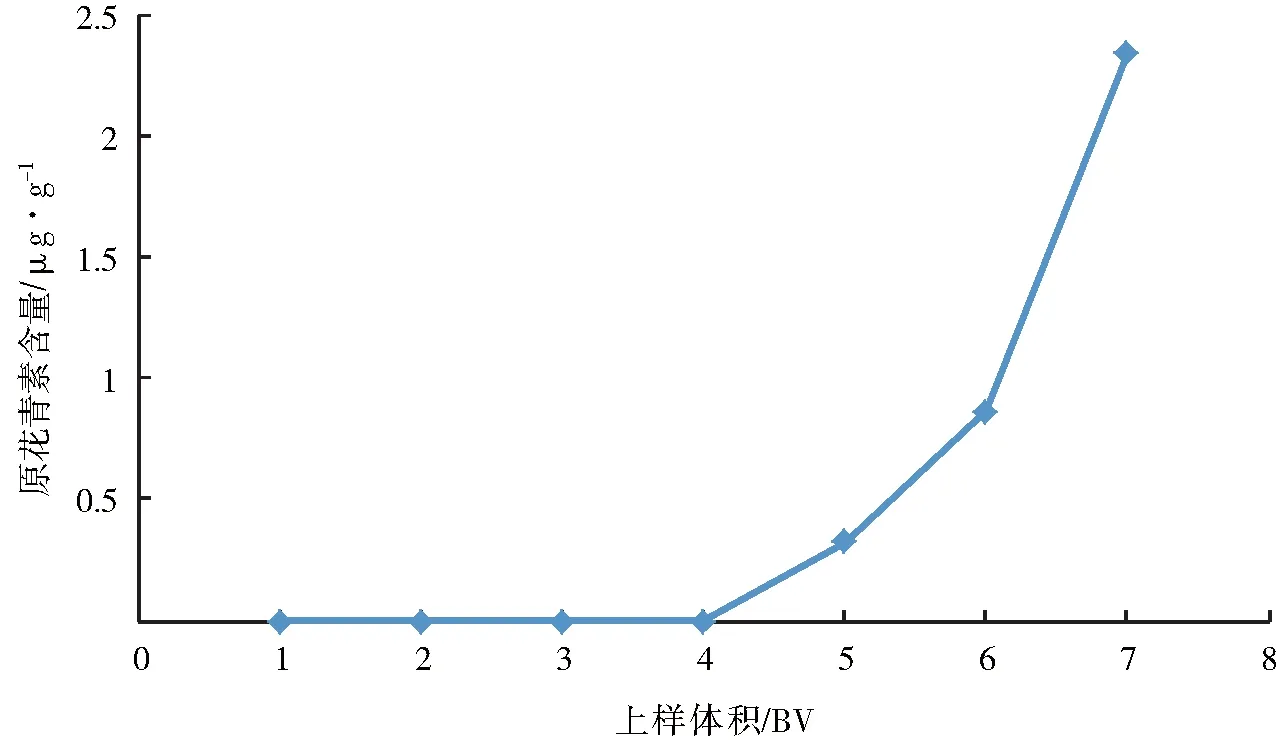
图4 上样量对大孔树脂动态吸附能力的影响
2.3.2.4 梯度洗脱
按照上述实验确定的最佳上样条件,上样结束后,静置2 h,使树脂对原花青素充分吸附后用蒸馏水冲洗柱中杂质及未被吸附的物质,冲洗至流出液无色。分别使用4 BV的20%、30%、40%、50%、60%、70%、80%、90%浓度的乙醇以2 mL·min-1流速对树脂柱进行洗脱,收集洗脱液,测定其中原花青素含量。

图5 不同浓度乙醇洗脱液原花青素纯度
由图5所示,50%乙醇溶液所洗脱下的流出液中原花青素含量低于40%,为了获得纯度较高的原花青素提取物,确定最佳洗脱溶液浓度为40%乙醇溶液。
按照上述优化条件确定的分离纯化条件,收集洗脱液,浓缩冻干,所得提取物中原花青素纯度为78.4%。
3 结论
(1)黑果腺肋花楸原花青素的最佳提取工艺方法为:提取剂是pH为3的70%的乙醇溶液,料液比为1∶15,超声辅助提取30 min。
(2)利用DM130大孔树脂纯化黑果腺肋花楸原花青素的最佳分离纯化条件:上样流速为2 mL·min-1,上样液浓度为1 mg·mL-1,上样量为6 BV,上样后静置2 h用蒸馏水洗脱至无色,采用40%乙醇溶液洗脱,收集洗脱液,浓缩冻干。所得原花青素到纯度为78.4%,可将原花青素大部分洗下,达到精制原花青素的效果。

