重金属Zn2+胁迫下米氏凯伦藻(Karenia mikimotoi)的生长生理响应研究
蔡卓平, 刘伟杰, 段舜山
重金属Zn2+胁迫下米氏凯伦藻()的生长生理响应研究
蔡卓平1,2, 刘伟杰2, 段舜山2
1. 广东省生态学会, 广州 510600 2. 暨南大学, 广州 510632
采用室内培养试验方法, 以米氏凯伦藻()为生物材料, 设置不同浓度梯度的重金属Zn2+(0、1、5、10、15和20 mg·L-1), 主要测定藻细胞密度、光合色素、光合效率、抗氧化酶类、丙二醛(malondialdehyde, MDA)等相关指标, 探讨重金属Zn2+胁迫下米氏凯伦藻()的生长和生理特征。结果发现, 在1和5 mg·L-1的Zn2+浓度下, 米氏凯伦藻细胞依然保持较好生长繁殖, 表明其具有一定的耐受性, 而随着重金属Zn2+浓度的提高, 细胞生长受到毒害抑制。光合色素含量呈现动态变化, 试验结束时(96 h)叶绿素a、叶绿素b和胡萝卜素含量有各自不同的变化趋势, 最大光能转化效率(Fv/Fm)表现出先升后降的趋势。Zn2+浓度为10 mg·L-1时, 超氧化物歧化酶(superoxide dismutase, SOD)活性显著高于对照; 过氧化氢酶(catalase, CAT)活性呈现出先上升后下降的趋势, 且5、10、15和20 mg·L-1Zn2+浓度下米氏凯伦藻的过氧化氢酶(CAT)活性均显著高于对照; 10、15 mg·L-1Zn2+浓度下米氏凯伦藻的总抗氧化能力(total antioxidant capacity, T-AOC)显著高于对照, 而20 mg·L-1Zn2+浓度下的显著低于对照。丙二醛(MDA)呈现出随着Zn2+浓度提高而增加的趋势, 5、10、15和20 mg·L-1Zn2+浓度下米氏凯伦藻的丙二醛(MDA)均显著高于对照。结果可为了解重金属对海洋微藻的毒性作用提供数据参考。
重金属; 米氏凯伦藻; 生长生理; 抗氧化酶类
0 前言
随着人类社会的发展, 一些重金属污染物进入海洋, 给海洋生态系统的结构和功能带来潜在的危害。海洋生态系统中的重金属来源主要有陆源输入、天然源和大气沉降, 其中陆源输入是海洋重金属污染的常见来源。近岸海域是污染物汇入和富集的重要场所[1-2]。持续有相关的研究报道了我国近海海域的重金属污染状况。例如, 对2017年4月采集的安海湾、围头湾表层沉积物中7种重金属Cr、Co、Ni、Cu、Zn、Cd、Pb含量进行测定, 发现这7种重金属的含量平均值依次为96.99、13.35、33.53、39.68、132.87、0. 17、39.10 μg·g-1, 分析表明该区域内的综合潜在生态风险评价为强生态危害, 应该采取相应措施控制污染源加强对该区域的环境保护[3]。微藻是海洋生态系统中最主要的初级生产者, 它们是一类具多样性、广布性和特殊性的微小生物体, 也是海洋食物链的基础生物[4]。当海域受到重金属污染的时候, 它们就可能成为首要的污染毒害生物对象, 并且使得重金属通过食物链进行富集和传递, 进而对食物链各营养级的生物产生有害影响, 甚至最终威胁到人类的健康。重金属锌(Zn)是植物生长生理所必需的一种微量元素, 是机体酶的辅基和维生素等重要的组成成分[5]。水生生物适度摄入锌有助于生长繁殖, 增强免疫力及抗病能力; 然而一旦受到锌污染或过度摄入Zn元素, 水生生物就会产生氧化应激反应, 抗氧化酶防御系统破坏, 生长生理受到影响, 甚至死亡。米氏凯伦藻 ()属于甲藻门, 裸甲藻目, 凯伦藻属, 是世界广布种, 常见于温带和热带浅海水域[6]。该藻具有较强的环境适应力, 其诱发的藻华给我国沿海国民经济造成了巨大的经济损失。本文重点研究重金属Zn2+胁迫下米氏凯伦藻()的生长生理响应, 以期为海洋微藻的生理生态学研究提供一些参照数据。
1 材料与方法
1.1 材料
实验选用的米氏凯伦藻()取自暨南大学生命科学技术学院水生生物研究中心藻种室。微藻培养所用的人工海水, 先经121.3 ℃高压湿热灭菌20 min, 待其冷却后再用于微藻的培养。微藻培养所需的玻璃三角瓶均预先用稀HCl浸泡24 h, 经蒸馏水冲洗干净, 烘干后于121.3 ℃灭菌20 min备用。培养过程中, 将已知起始密度的目标藻种分别接种于添加f/2培养基的灭菌人工海水中, 玻璃三角瓶中置于人工气候光照培养箱中静置培养, 培养温度为(23±1) ℃, 光照强度约为80 μmol·m-2·s-1, 光暗周期为12h: 12h, 每日定期摇晃三角瓶多次, 并随机改变三角瓶位置。实验周期开始前, 先对藻种活化及扩大培养, 并选取处于对数生长期的海洋微藻用于实验。实验所用的ZnCl2购自上海阿拉丁试剂有限公司, 为分析纯, 纯度≥99.8%。
1.2 方法
培养基经高压蒸汽灭菌冷却后, 分装于150 mL玻璃三角瓶中, 每瓶100 mL。选取对数生长期藻种进行接种, 初始接种浓度为1.0×105个·mL-1。重金属离子的工作液由储备液由培养基稀释得到, 根据预实验设置重金属Zn2+浓度梯度, 分别为0、1、5、10、15和20 mg·L-1。每个处理(含对照组)设置3个平行重复。置于原培养条件下96 h, 通过细胞计数观测藻细胞的生长繁殖, 并绘制生长曲线并计算比生长速率(μ)。比生长速率()以藻细胞数均值为基础数据, 按照下面公式进行计算:
= (lnt–lnN) /(–t)
式中:N和N分别为(96 h)时刻和t(初始接种)时的藻细胞数。在比生长率速率基础上, 采用概率单位-浓度对数法绘制曲线, 根据线性回归方程计算96 h的半数抑制浓度(EC50)。
参照有关文献[7-8]测定不同浓度重金属Zn2+对米氏凯伦藻叶绿体色素含量的影响。取10 mL培养96 h的藻液, 经高速冷冻离心机4 ℃, 5000 g离心15 min, 弃上清液, 加入5 mL抽提液(丙酮: 乙醇=1: 1),震荡摇匀之后, 4 ℃黑暗静置24 h后, 同条件离心15 min,取上清液, 用紫外-可见光分光光度计UV2450测定440、645、663 nm波长下上清液的吸光值, 以抽提液作为空白对照, 参照以下公式计算叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)的含量(mg·L-1):
叶绿素a(Chl a)=12.7 OD663– 2.69 OD645
叶绿素b(Chl b)= 22.9 OD645– 4.68 OD663
类胡萝卜素(Car)= 4.7 OD440– 0.27(Chl a + Chl b)
受试藻种不同浓度重金属Zn2+暴露处理96 h后, 取 2 mL藻液转移至专用测量小瓶, 于暗箱中暗适应30 min, 利用植物效率仪(PAM)在室温下进行测定, 由 3000 µmol·m-2·s-1的连续光诱导, 荧光信号记录从10 µs 开始, 至 2 s 结束.记录最大光能转化效率(Fv/Fm)值。重金属Zn2+暴露处理米氏凯伦藻96 h, 测定藻体抗氧化系统相关酶类的活性及含量, 指标包括超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、总抗氧化能力(T-AOC)、丙二醛(MDA)含量, 均采用南京建成公司相应的试剂盒参照操作手册进行测定。
1.3 数据处理
采用SPASS 15.0进行统计分析, 结果以平均值±标准误差(Mean±SE)表示, 两组间数据应用配对t检验进行差异分析。
2 结果与分析
2.1 重金属Zn2+对米氏凯伦藻细胞生长繁殖的影响
米氏凯伦藻在不同Zn2+浓度处理下的细胞生长情况如图1。米氏凯伦藻细胞在较低浓度重金属Zn2+处理(0、1、5 mg·L-1)下能保持一直增长的趋势; 而在较高浓度重金属Zn2+处理(10、15、20 mg·L-1)下细胞生长受到明显的抑制。总体而言, 随着重金属Zn2+处理的增大, 藻细胞增长减缓。从24 h开始, 较高浓度重金属Zn2+处理下的藻细胞密度就显著低于较低浓度重金属Zn2+处理下的藻细胞密度。24 h时, 0、1、5、10、15和20 mg·L-1浓度Zn2+处理下的藻细胞密度分别为15.3×104、13.3×104、12.9×104、11.7×104、10.6×104和8.5×104个·mL-1。此时, 较高浓度重金属Zn2+处理(10、15、20 mg·L-1)下的藻细胞密度与对照(0 mg·L-1)相比存在显著性差异, 随后几次取样时间(48h、72h、96h)下的情况类似。24 h时, 较低浓度重金属Zn2+处理(1、5 mg·L-1)下的藻细胞密度与对照(0 mg·L-1)相比没有显著性差异; 而从72 h开始, 较低浓度重金属Zn2+处理(1、5 mg·L-1)下的藻细胞密度也显著低于对照。实验结束时(96 h), 0、1、5、10、15和20 mg·L-1浓度Zn2+处理下的藻细胞密度分别为51.7×104、42.6×104、37.3×104、20.5×104、18.3×104、15.9×104个·mL-1。可见, 米氏凯伦藻对重金属Zn2+胁迫具有一定的适应性。计算重金属Zn2+对米氏凯伦藻的96 h半数抑制浓度(EC50), 结果为8.76 mg·L-1。

图1 不同浓度重金属Zn2+处理下米氏凯伦藻的细胞密度变化
Figure 1 Change of cell density ofgrown in different concentration of Zn2+
2.2 重金属Zn2+对米氏凯伦藻光合色素含量的影响
不同浓度重金属Zn2+处理下米氏凯伦藻的光合色素含量变化情况如图2。随着重金属Zn2+浓度的提高, 米氏凯伦藻的Chl a含量和Chl b含量呈现降低, 而Car含量呈现增加的趋势。0、1、5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的Chl a含量分别为0.35、0.26、0.25、0.21、0.18和0.12 mg·L-1; Chl b含量分别为0.08、0.08、0.06、0.03、0.03和0.06 mg·L-1; Car含量分别为0.13、0.15、0.23、0.28、0.35和0.48 mg·L-1。
2.3 Zn2+对三种海洋微藻光合效率的影响
如图3所示, 0、1、5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的最大光能转化效率(Fv/Fm)分别为0.52、0.58、0.54、0.54、0.52和0.46, 表明较低浓度重金属Zn2+一定程度上促进了米氏凯伦藻的最大光能转化效率(Fv/Fm); 而随着重金属Zn2+浓度的提高(至20 mg·L-1), 米氏凯伦藻的最大光能转化效率(Fv/Fm)有所降低。
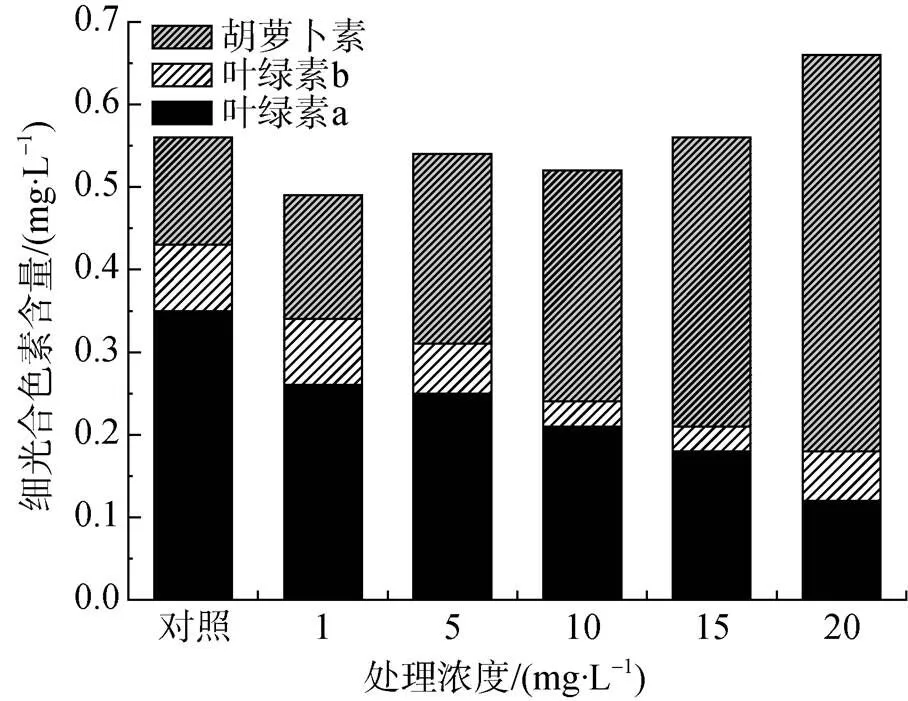
图2 不同浓度重金属Zn2+处理下米氏凯伦藻的光合色素含量变化
Figure 2 Change of photosynthetic pigment content ofunder different concentration of Zn2+
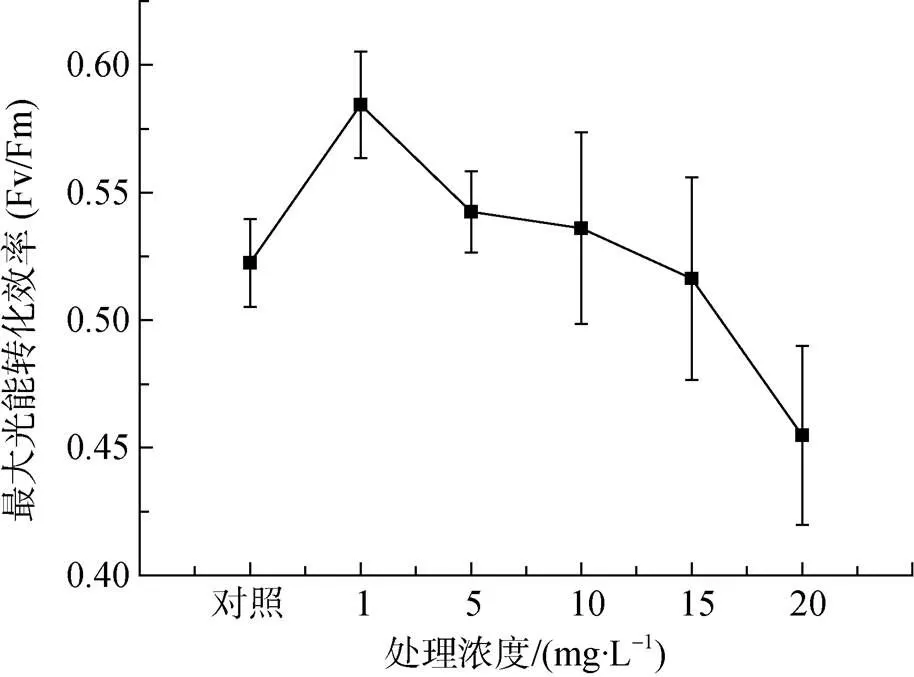
图3 不同浓度重金属Zn2+处理下米氏凯伦藻的最大光能转化效率变化
Figure 3 Change of maximal photochemical efficiency ofin different concentration of Zn2+
2.4 重金属Zn2+暴露处理对米氏凯伦藻抗氧化系统的影响
2.4.1 米氏凯伦藻的超氧化物歧化酶(SOD)活性变化
米氏凯伦藻经不同浓度重金属Zn2+暴露处理96 h, 其体内的超氧化物歧化酶(SOD)活性变化情况如图4所示。较低浓度重金属Zn2+(1和5 mg·L-1)处理下, 米氏凯伦藻的SOD活性与对照组相比无显著性差异; 重金属Zn2+浓度为10 mg·L-1时, SOD活性达到最大值, 与对照组相比有显著性差异, 升高幅度为38.4%; 重金属Zn2+浓度15和20 mg·L-1时, SOD活性与对照组相比没有显著性差异, 维持在35 U·mg-1左右。
2.4.2 米氏凯伦藻的过氧化氢酶(CAT)活性变化
不同浓度重金属Zn2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性变化情况如图5。0、1、5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性分别为6.1、7.4、10.1、12.9、15.0和13.0 U·mg-1, 表明随着重金属Zn2+的浓度的提高, 米氏凯伦藻的过氧化氢酶(CAT)活性呈现出先上升后下降的趋势。其中5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性均显著高于对照。

图4 不同浓度重金属Zn2+处理下米氏凯伦藻的超氧化物歧化酶(SOD)变化
Figure 4 Change of SOD activity ofin different concentration of Zn2+
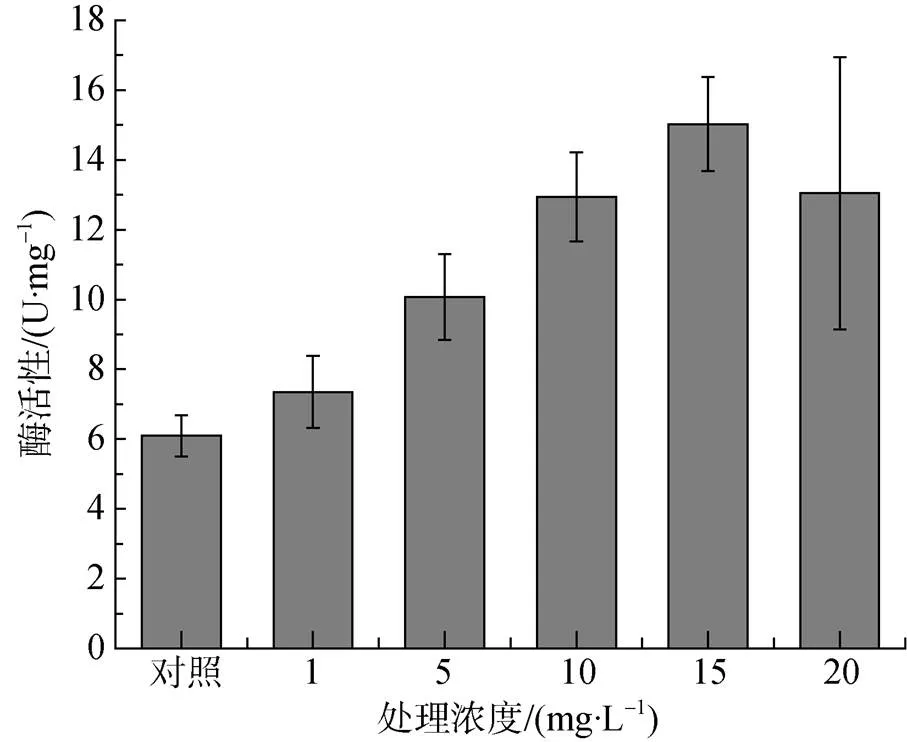
图5 不同浓度重金属Zn2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性变化
Figure 5 Change of CAT activity ofin different concentration of Zn2+
2.4.3 米氏凯伦藻的总抗氧化能力(T-AOC)变化
不同浓度重金属Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)呈现出一定的波动变化(图6)。1和5 mg·L-1浓度Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)与对照组相比无显著性差异, 10和15 mg·L-1浓度Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)与对照相比有显著的提高, 而20 mg·L-1浓度Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)与对照相比有显著的减低。0、1、5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)分别为4.31、4.33、4.8、7.7、7.2和3.5 U·mg-1。
2.4.4 米氏凯伦藻的丙二醛(MDA)变化
米氏凯伦藻丙二醛(MDA)的含量呈现出随着重金属Zn2+浓度的提高而增加的趋势(图7)。1 mg·L-1浓度Zn2+处理下米氏凯伦藻丙二醛(MDA)的含量(0.85)与对照(0.83)相比没有显著性差异, 5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻丙二醛(MDA)的含量均显著高于对照, 增幅达200%—300%。

图6 不同浓度重金属Zn2+处理下米氏凯伦藻的总抗氧化能力(T-AOC)变化
Figure 6 Change of T-AOC activity ofin different concentration of Zn2+

图7 不同浓度重金属Zn2+处理下米氏凯伦藻丙二醛(MDA)的变化
Figure 7 Change of MDA activity ofin different concentration of Zn2+
3 讨论与展望
锌是造纸过程常用的一种重金属元素, 它不易自然降解, 也难以被微生物分解, 因此容易随生成废水的排放流入近海水域, 导致一些近海海域的受污染状况较为严重[9]。基于2017年夏季54个采样点表层沉积物测试资料, 分析象山近海沉积物中Cr、Cu、Zn、Pb、Hg、As、Cd 等7种重金属的污染状况, 结果发现它们的平均质量分数分别为89.860、36.890、108. 740、32.150、0.041、6.090和134μg·g-1[10]; 而有研究测定荣成湾近岸海域14种经济生物体体内Cu、Pb、Zn、Cd、Cr、Hg和As等7种重金属的含量, 评估人体摄食可能存在的健康风险, 结果表明经济生物体的重金属平均含量Zn>Cu>Cr>As>Pb>Cd>Hg, 部分贝类生物体中Zn有超标[11]。因此开展并丰富重金属锌对海洋生物的毒理学研究工作具有紧迫性。
本研究发现, 较低浓度(1和5 mg·L-1)的Zn2+浓度下, 米氏凯伦藻细胞还保持较好的生长繁殖, 表明其对重金属Zn2+具有一定的耐受性; 而随着重金属Zn2+浓度的增大, 细胞生长受到抑制, 表现出明显的毒性效应, 此研究结果与之前的报道基本一致[5]。光合色素是反映植物利用光照进行光合作用的一个重要指标[12], 研究显示, 在重金属Zn2+胁迫条件下, 微藻的叶绿素a和叶绿素b的含量呈现下降的趋势, 而胡萝卜素反而有所提高, 表明它们对重金属Zn2+胁迫可能有不同的响应程度和方式。也有研究报道, 微藻在遭受外界胁迫的时候, 光合色素可能提高, 也可能降低, 推测这与实验条件、胁迫程度以及生物体差异等多种因素有关[12]。Fv/Fm反映的是PS反应中心的内禀光能转换效率或称为PSII的最大光能转化效率。在胁迫条件下, 该参数的变化较大, 因此它可以用来反映微藻生长环境是否良好[13]。本实验中, Fv/Fm表现出一个低浓度受刺激, 高浓度受抑制的现象, 即毒物兴奋效应(hormesis)[14], 说明低浓度重金属Zn2+在一定程度上能提高微藻光合作用, 促进光系统最大光化学转化效率及实际的光能捕获效率; 而高浓度重金属Zn2+则可能迫使PSII反应中心受损, 抑制光合作用的原初反应, 降低最大光化学转换效率及PSII实际的光能捕获效率[15]。类似地, 王山杉等[16]对不同Zn2+浓度条件下培养的固氮鱼腥藻的叶绿素荧光参数Fv/Fm进行了测定, 结果表明, 当Zn2+浓度为1.0 μmol·L-1时, 其Fv/Fm值最高; 随着Zn2+浓度的升高, Fv/Fm值降低, 其生长和光合作用受到明显的抑制, 结果与本研究基本一致。
超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是生物体抗氧化防御系统中重要的酶类, 在预防机体的外界损伤有关键作用[17]。Zn2+暴露对米氏凯伦藻生理生化的影响过程中, SOD是抗氧化防御系统的第一道防线。Zn2+重金属离子进入微藻体内后, 体内产生大量的自由基, 若不及时清除, 则破坏生物体活性氧的平衡, 此时机体内的抗氧化酶系统就会启动, 对抗活性氧的清除和胁迫, 以抵御不良环境的伤害。我们的研究结果表明, 当重金属Zn2+浓度为10 mg·L-1时, SOD活性达到最大值。CAT在保护藻体免受活性氧破坏中也起到重要的作用, 米氏凯伦藻的过氧化氢酶(CAT)活性在10、15 mg·L-1浓度Zn2+处理下较高。过多的活性氧可引发或加剧膜脂过氧化作用, 造成细胞膜系统损伤, 严重时可引起藻细胞的死亡。丙二醛(MDA)是膜脂质过氧化的重要产物, 它能交联脂类、核酸、糖类及蛋白质从而对质膜结构和功能造成不良影响, 所以其含量高低可以反映细胞膜脂过氧化的程度大小[12]。本研究中, 丙二醛(MDA)呈现出随着重金属Zn2+浓度的提高而增加的趋势, 5、10、15和20 mg·L-1浓度Zn2+处理下米氏凯伦藻的丙二醛(MDA)均显著高于对照。
需要指出的是, 本研究是基于重金属Zn2+单一胁迫条件下开展, 但在自然海域环境中, 重金属之间联合作用而构成复合污染, 因此重金属污染常呈现复合性和多样性[18]。重金属之间的相互作用通常分为拮抗、加和或协同作用, 当多种重金属共同暴露于生物体时, 其作用效应与单一重金属暴露往往有很大的不同[19], 因此需要进一步加强重金属复合污染研究, 以更客观体现环境中重金属污染物与生物有机体之间的相互作用规律和机理。此外, 不同的海洋藻类之间对重金属胁迫也存在不同的生长响应特征, 而重金属对藻类生长的胁迫作用还可能受到光照、温度、营养盐、pH环境因子直接影响或间接影响。今后将继续对这些相关的问题进行研究报道。
[1] WOJTKOWSKA M, BOGACKI J, WITESKA A. Assessment of the hazard posed by metal forms in water and sediments[J]. Science of The Total Environment,2016, 15(551/552): 387–392
[2] 林丽华, 魏虎进, 黄华梅. 大亚湾表层沉积物和底栖生物中重金属的污染特征与生物积累[J]. 生态科学, 2017, 36(6): 173–181.
[3] 熊慧, 杨丽虹, 邓永智. 福建省安海湾、围头湾海域表层沉积物重金属含量分布特征及潜在生态风险评价[J]. 应用海洋学学报, 2019, 38(1): 68–74
[4] CAI Zhuoping, DUAN Shunshan, ZHU Honghui. Compensatory growth of the bloom-forming dinoflagellateinduced by nitrogen stress[J]. Oceanologia, 2013, 55(1): 269–276
[5] 于小娣, 师玥, 刘泳, 等. 重金属胁迫对两种海洋饵料微藻的急性毒性效应研究[J]. 中国海洋大学学报, 2014, 44(2): 53–59
[6] 周钦, 马增岭, 袁兴伟, 等. 米氏凯伦藻生长对磷的响应及其吸收动力学研究[J]. 上海海洋大学学报, 2017, 26(4): 546–553
[7] 郝建军, 康宗利. 植物生理学实验术[M]. 北京: 化学工业出版社, 2006.
[8] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[9] 王历瑶, 苏芳莉, 孙权, 等. 重金属锌在芦苇植株中富集、转运及分布特征研究[J]. 沈阳农业大学学报, 2016, 47(5): 621–626.
[10] 李金铎, 虞理鹏, 贺智能, 等. 象山近海表层沉积物重金属分布特征和生态风险评价[J]. 环境科学研究, 2018, 31(10): 1751–1760
[11] 孙玲玲, 宋金明, 于颖, 等. 荣成湾 14 种海洋经济生物体中的重金属水平与食用风险初步评价[J]. 海洋与湖沼, 2018, 49(1): 52–61
[12] 刘易见, 颜韦, 刘春辰, 等. 蒽和镉对米氏凯伦藻的生长及叶绿素a、丙二醛含量的影响[J]. 生态科学, 2016, 35(4): 47–51.
[13] 梁英, 金月梅, 田传远. 磷限制及恢复对小球藻叶绿素荧光特性的影响[J]. 南方水产, 2008, 4(4): 1–7
[14] CALABRESE E J, BAIDWIN L A, HOLLAND C D. Hormesis: a highly generalizable and reproducible phenomenon with important implications for risk assessment[J]. Risk Analysis, 1999,19(2): 261–281.
[15] PARKHILL J, MAILLET G, CULLEN J J. Fluorescence- based maximum quantum yield for PSⅡas a diagnostic of nutrient stress[J]. Journal of Phycology, 2001, 37: 517–529.
[16] 王山杉, 刘永定, 金传荫, 等. Zn2+浓度对固氮鱼腥藻(Ley)光能转化特性的影响[J]. 湖泊科学, 2002, 14(4): 350–356.
[17] 张楠, 张清靖, 贾成霞, 等. 重金属锌对大型溞SOD、CAT酶活性和GSH含量的影响[J]. 西南大学学报(自然科学版), 2017, 39(1): 69–75
[18] RASHDI S, ARABI A A, HOWARI F W, et al. Distribution of heavy metals in the coastal area of Abu Dhabi in the United Arab Emirates[J]. Marine Pollution Bulletin, 2015, 97(1/2): 494–498
[19] KIM B S,SALAROLI A B, FERREIRA P A, et al. Spatial distribution and enrichment assessment of heavy metals in surface sediments from Baixada Santista, Southeastern Brazil[J]. Marine Pollution Bulletin, 2016, 103(1/2): 333–338
Growth and physiological response ofto heavy metal Zn2+stress
CAI Zhuoping1,2, LIU Weijie1,2, DUAN Shunshan1,2
1. Ecological Society of Guangdong Province, Guangzhou 510650, China 2. Jinan University, Guangzhou 510632, China
An indoor experiment with different concentration gradients of heavy metal Zn2+(0, 1, 5, 10, 15 and 20 mg·L-1) was carried out by usingas material, and determining the cell density, photosynthetic pigments, photosynthetic efficiency, antioxidant enzymes and malondialdehyde (MDA) to study the growth and physiological characteristics ofin response to Zn2+stress. The results showed that under the concentration of 1 and 5 mg·L-1Zn2+,cells still maintained good growth and reproduction, indicating that they were tolerant to Zn2+, meanwhile the growth of cells was inhibited by toxicity with the increase of the Zn2+concentration. At the end of the experiment (96 h), the contents of chlorophyll a, chlorophyll b and carotene fluctuated, and the maximal photochemical efficiency (Fv/Fm) showed a trend of first rising and then decreasing. The activity of superoxide dismutase (SOD) was significantly higher when the Zn2+concentration was 10 mg·L-1than that of the control; the activity of catalase (CAT) increased first and then decreased, and its activity was significantly higher than that of thecontrol under the Zn2+concentration of 5, 10, 15 and 20 mg·L-1; the total antioxidant capacity (T-AOC) ofat the Zn2+concentration of 10 and 15 mg·L-1was significantly higher than that of the control, while at the Zn2+concentration of 20 mg·L-1was significantly lower than that of the control. The content of malondialdehyde (MDA) increased with the increase of the Zn2+concentration, and the content of malondialdehyde (MDA) oftreated with 5, 10, 15 and 20 mg·L-1Zn2+concentrations was significantly higher than that in the control. The results can provide data for understanding the toxicity of heavy metals to marine microalgae.
heavy metal;; growth and physiology; antioxidant enzymes
10.14108/j.cnki.1008-8873.2019.02.023
Q494
A
1008-8873(2019)02-176-06
2018-10-07;
2018-12-25
广州市科技计划项目(201707010481)
蔡卓平(1980—), 男, 博士, 副编审, 主要从事生态学研究工作, E-mail: zpcai@scau.edu.cn
蔡卓平, 刘伟杰, 段舜山. 重金属Zn2+胁迫下米氏凯伦藻()的生长生理响应研究[J]. 生态科学, 2019, 38(2): 176-181.
CAI Zhuoping, LIU Weijie, DUAN Shunshan. Growth and physiological response ofto heavy metal Zn2+stress[J]. Ecological Science, 2019, 38(2): 176-181.

