分子蒸馏法富集椰子油中月桂酸工艺条件的优化研究
刘 辉,董家和,张 莹,何东平,2,胡传荣,2
(1.武汉轻工大学 食品科学与工程学院,武汉 430023; 2.国家粮食局粮油资源综合开发工程技术研究中心,武汉 430023)
椰子油脂肪酸以月桂酸为主,含量占45%左右[1]。此外,还含有己酸、辛酸、癸酸、肉豆蔻酸、棕榈酸、硬脂酸等饱和脂肪酸及少量油酸等不饱和脂肪酸,是植物界中月桂酸和中短链脂肪酸最主要的来源[2]。椰子油中碳链长度在C14以下的脂肪酸具有可快速消化吸收、在体内不转化为脂肪、抑菌、抑制病毒、提高人体免疫力等重要的保健功能[3]。
椰子油中的月桂酸具有抗菌和抗病毒的功能性质[4]。当月桂酸被消化时,形成的月桂酸单甘酯可以破坏几种细菌和病毒,包括单核细胞增生李斯特氏菌、幽门螺杆菌和原生动物如兰伯贾第虫、HIV、麻疹、单纯疱疹病毒-1、疱疹性口炎病毒、流行性感冒和细胞巨化病毒等[5]。月桂酸单甘酯天然存在于母乳和美洲蒲葵中, 为优良的食品乳化剂, 同时又是一种国际公认的安全、高效、广谱的抑菌剂[6]。月桂酸等中碳链脂肪酸单甘酯可以加强婴儿对脂肪和Ca2+的吸收,从而促进婴儿骨骼的生长发育,同时也增强婴儿抵抗各种细菌和病毒的能力。
南阳等[7]采用尿素包埋法富集椰子油中月桂酸甲酯。为了提升椰子油中月桂酸的含量,使椰子油更具有营养价值,可采用分子蒸馏技术富集椰子油中的月桂酸。分子蒸馏法是一种在高真空度下利用混合物组分中分子运动平均自由程的差异进行的液液分离操作的过程[8-10]。分子蒸馏技术具有工艺设备简便、操作安全可靠、无污染、无溶剂残留等优点[11]。本文采用分子蒸馏技术对椰子油中月桂酸的富集进行研究,通过单因素实验与正交实验确定分子蒸馏的最佳工艺条件,以期为富含月桂酸的椰子油的生产提供参考。
1 材料与方法
1.1 实验材料
椰子油,以新鲜椰子肉为原料,实验室自制;碳酸钾、甲醇、无水乙醇、正己烷、氯化钠、BF3-甲醇,分析纯,国药集团化学试剂有限公司;正己烷,色谱纯。
分子蒸馏设备,上海益海嘉里有限公司;安捷伦GC-7890气相色谱仪,美国安捷伦公司;DF-101S集热式磁力搅拌器,巩义市予华仪器有限责任公司;PZ-D-5型液体比重天平,上海宜工电子有限公司;TD5A离心机,湖南凯达科学仪器有限公司;DZF-6021真空干燥箱,上海博讯实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 分子蒸馏实验
打开分子蒸馏冷却水系统,设定冷却水温度为35℃,打开真空系统,在冷阱中加入液氮,打开加热器电源进行加热;待真空度和蒸馏温度达到实验所需条件时,加入椰子油,在不同的蒸馏温度、进料速率、刮膜转速下进行蒸馏分离,收集轻相和重相。
1.2.2 理化指标的测定
水分及挥发物,GB/T 5528—2008;酸价,GB/T 5530—2005;过氧化值,GB/T 5538—2005;皂化值,GB/T 5534—2008。
1.2.3 脂肪酸组成分析
甲酯化:取0.1 g(2~3滴)椰子油到10 mL离心管中,加入3 mL 0.5%的NaOH-甲醇溶液,摇匀后在65℃恒温水浴中皂化30 min,加入2 mL BF3-甲醇(1∶3)溶液,65℃恒温水浴3 min后冷却至室温,加入2 mL正己烷(色谱纯)萃取,摇匀后静置分层,取上层有机相在10 mL离心管中离心20 min,过膜后移入气相色谱进样瓶中。
气相色谱条件:Agilent 19091F-433色谱柱(30 m×250 μm×0.25 μm);色谱柱升温条件为50℃初始温度保持2 min,以5℃/min的速率上升至180℃,保持2 min,以8℃/min的速率上升至200℃,保持5 min;载气为高纯度N2,流量3.00 mL/min;空气流量50 mL/min;氢气流量50 mL/min;氢火焰离子化检测器(FID),检测器温度250℃;进样口温度200℃;进样量0.6 μL;分流比30∶1。
2 结果与分析
2.1 单因素实验
2.1.1 蒸馏温度对富集结果的影响
在压力0.1 Pa、刮膜转速250 r/min、进料速率0.2 L/h条件下,改变分子蒸馏的蒸馏温度,研究蒸馏温度对富集结果的影响,结果如图1所示。
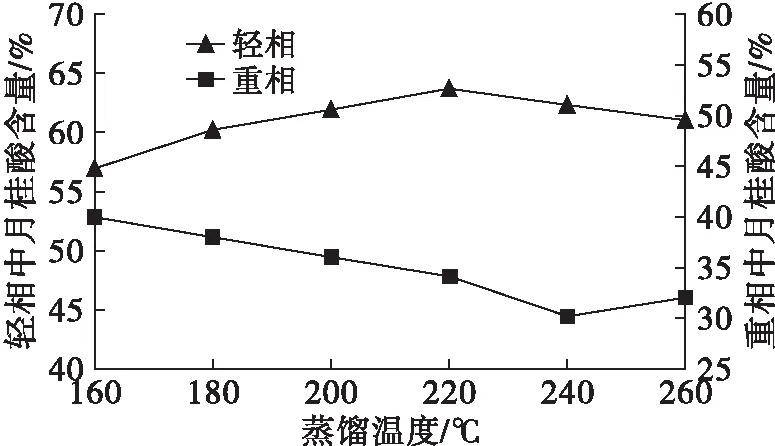
图1 蒸馏温度对富集结果的影响
由图1可知,轻相中月桂酸含量随着蒸馏温度的升高先升高后降低,而重相中月桂酸含量基本随着蒸馏温度的升高持续降低,并且轻相中月桂酸含量明显高于重相中月桂酸含量,这是因为月桂酸相对分子质量较小,在轻相中存在较多。在蒸馏温度为220℃时,轻相中月桂酸含量最高,为63.62%。随着蒸馏温度的继续升高,轻相中月桂酸含量反而降低,这是因为蒸发液膜表面的温度与浓度决定蒸发速率,刚开始蒸馏时,由于液膜表面轻组分的浓度较高,因此蒸发速率大,并且在较高温度下,轻组分获得能量更多,分子运动加剧,轻组分就会不断逸出,导致液膜内轻组分的浓度逐渐降低,而在相同条件下轻组分的蒸发速率大于重组分的蒸发速率,因此月桂酸含量增加。随着蒸馏温度的升高,蒸发不断地进行,液膜表面的轻组分浓度逐渐下降,重组分的浓度逐渐升高,因此轻组分与重组分的蒸发速率之比逐渐减小,并且重组分获得能量增加,导致肉豆蔻酸等重组分也会被蒸发出来,所以月桂酸含量逐渐降低[12]。
2.1.2 刮膜转速对富集结果的影响
在压力0.1 Pa、进料速率0.2 L/h、蒸馏温度220℃条件下,改变分子蒸馏的刮膜转速,研究刮膜转速对富集结果的影响,结果如图2所示。
由图2可知,椰子油中月桂酸含量随着刮膜转速的增大先升高后后降低。在轻相和重相中都符合此规律,轻相中月桂酸含量比重相中高,其中在刮膜转速为270 r/min时,轻相中月桂酸的含量最高,为65.51%。这是因为随着刮膜转速的提高,缩短了液膜表面的形成和更新时间,使形成的液膜表面温度差变小,温度更加均匀,也使得形成的液膜表面的浓度更加均匀。液膜表面的温度和浓度分布更加均匀有助于提高月桂酸的蒸发速率,所以随着刮膜转速的提高椰子油中月桂酸的含量升高。但是刮膜转速过高,会导致转子上的椰子油甩到冷凝器上,导致椰子油中的脂肪酸分离不开。
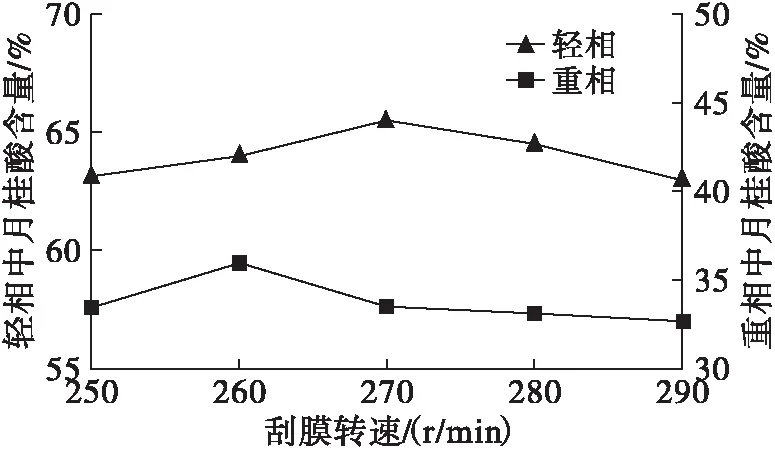
图2 刮膜转速对富集结果的影响
2.1.3 进料速率对富集结果的影响
在压力0.1 Pa、蒸馏温度220℃、刮膜转速250 r/min条件下,改变分子蒸馏的进料速率,研究进料速率对富集结果的影响,结果如图3所示。
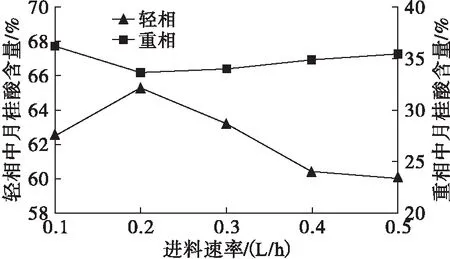
图3 进料速率对富集结果的影响
由图3可知,随着进料速率的增加,轻相中月桂酸含量先升高后降低,重相中月桂酸含量先降低后升高,轻相中月桂酸的含量明显高于重相。在进料速率为0.2 L/h时,轻相中月桂酸含量最高,为65.32%。在进料速率为0.1~0.2 L/h时,进料速率较低,物料在蒸发面上停留时间较长,充分受热,蒸发液膜表面的浓度和温度变化比较剧烈,导致轻组分大量被蒸出,随着进料速率的增加,月桂酸含量增加;在进料速率大于0.2 L/h时,随着进料速率继续增加,物料在蒸发面上的停留时间较短,分离不充分,蒸发液膜表面的浓度和温度变化比较缓慢,分离效果减弱,导致轻组分不能完全被蒸出,以致月桂酸含量降低。
2.2 正交实验
根据单因素实验结果,选取蒸馏温度(A)、进料速率(B)、刮膜转速(C)为因素,富集后月桂酸含量为指标进行正交实验,正交实验因素水平见表1,正交实验设计及结果见表2。
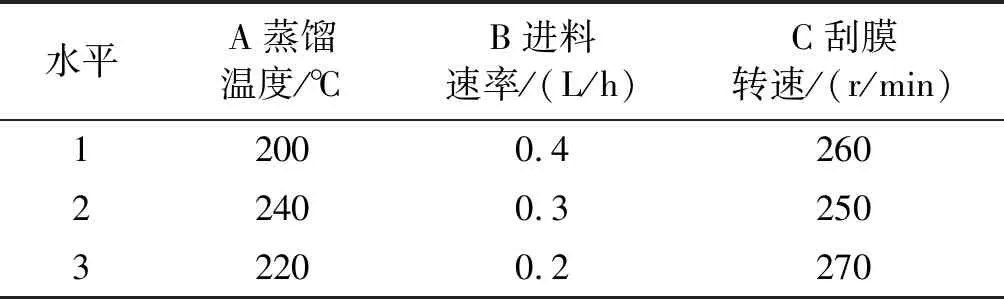
表1 正交实验因素水平
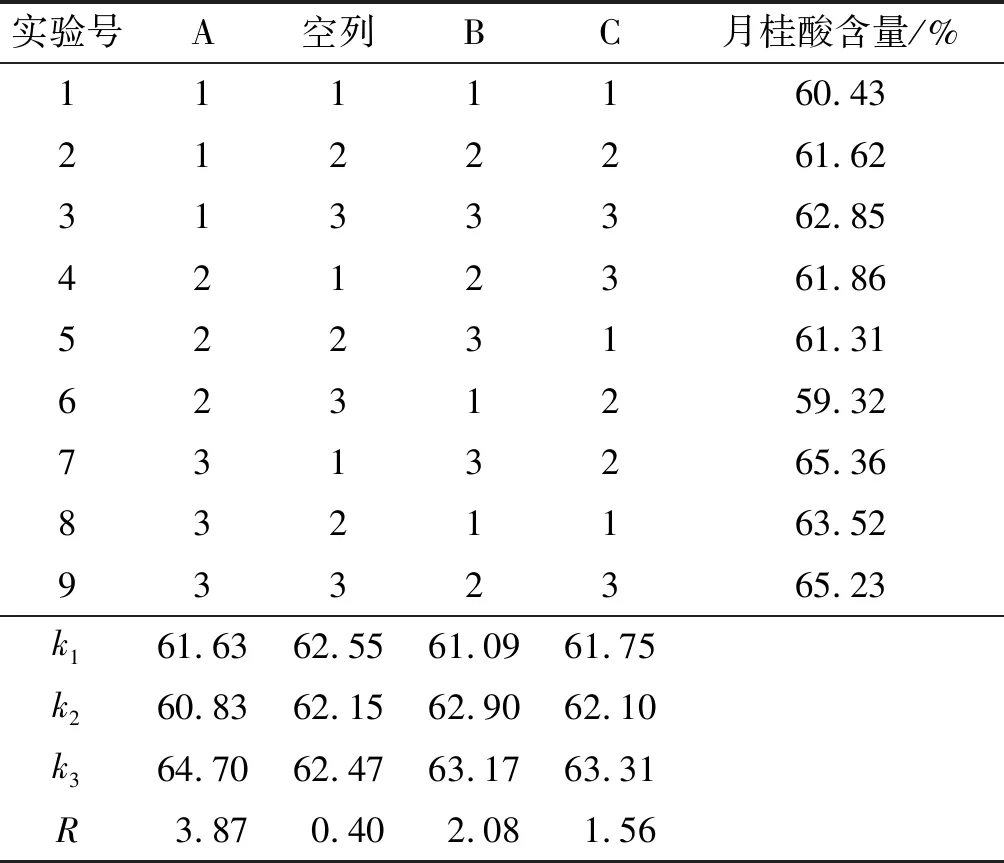
表2 正交实验设计及结果
由表2可知,各因素对分子蒸馏富集后月桂酸含量的影响大小依次为:A>B>C,即蒸馏温度>进料速率>刮膜转速,实验最优方案为A3B3C3,即蒸馏温度220℃,进料速率0.2 L/h,刮膜转速270 r/min。
2.3 优化工艺条件验证
为验证优化工艺条件的可靠性和重现性,对最优工艺条件进行3次重复实验,测得的3次验证实验富集后椰子油中月桂酸平均含量为65.58%,优于正交实验表2中的方案,获得的优化条件较理想和可靠。
2.4 椰子油理化性质
对分子蒸馏后得到的椰子油的理化指标进行检测,结果见表3。

表3 椰子油的理化指标
由表3可知,经过分子蒸馏,椰子油的各项指标都在合理的范围内,不会影响椰子油的食用品质。
2.5 椰子油脂肪酸组成
选取分子蒸馏富集前后的椰子油进行脂肪酸组成的测定,结果见表4。
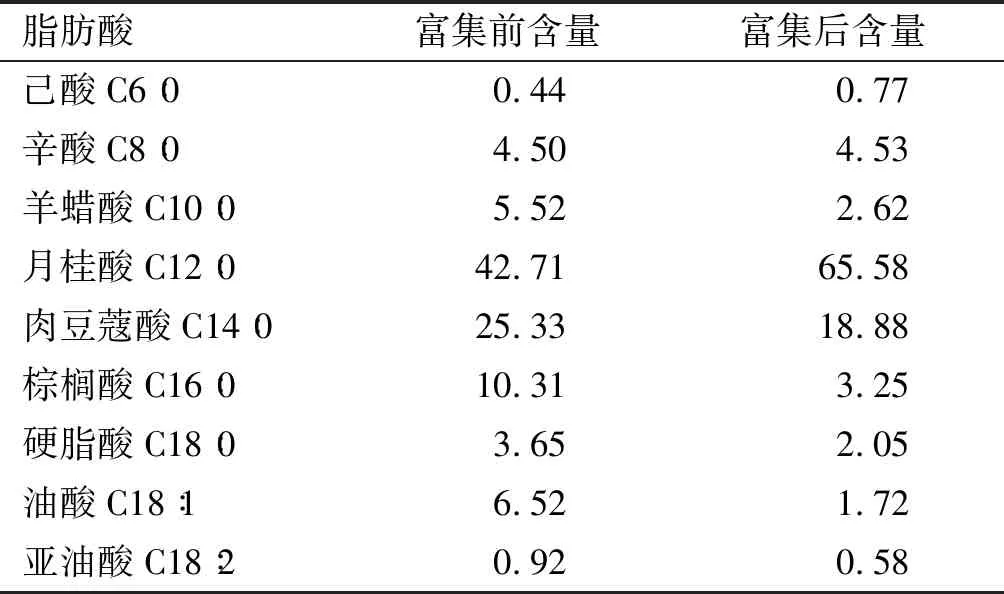
表4 富集前后椰子油脂肪酸组成 %
由表4可知,椰子油通过分子蒸馏技术富集后,月桂酸含量达到了65.58%,相比于原样品油中月桂酸含量为42.71%有了一定的提高。
3 结 论
通过单因素实验和正交实验优化,得到各因素对分子蒸馏富集椰子油月桂酸含量的影响大小依次为蒸馏温度>进料速率>刮膜转速。分子蒸馏法富集椰子油中月桂酸的最优工艺条件为:压力0.1 Pa,蒸馏温度220℃,进料速率0.2 L/h,刮膜转速270 r/min。在最优工艺条件下,富集后椰子油中的月桂酸含量为65.58%。
——头发

