敖汉细毛羊Hoxa5、BMPR1B基因互作研究
张梦瑶,杨 峰,刘积凤,刘开东,贺建宁,柳 楠
(1.青岛农业大学 动物科技学院,山东 青岛 266109;2.青岛畜牧兽医研究所,山东 青岛 266121;3.内蒙古农业大学,内蒙古 呼和浩特 010018)
我国在20世纪80年代开始育种细毛羊,其中的敖汉细毛羊在敖汉、翁牛特旗县开始繁育,父母系均来自于不同的细毛羊品种,父本通常以美利奴羊为主[1]。毛囊是皮肤的一附属结构,它的形成是上皮细胞和真皮细胞间相互作用的结果。在羊毛产量上皮肤和毛囊的性状起到了重要的作用,因此了解皮肤结构和毛囊的发育规律对细毛羊生产显得尤为重要[2]。毛囊的调控也受多种因子影响,因此探究毛囊生长发育的调控基因也显得非常重要。
Hox(Homeobox)基因又称为同源异型盒基因(Homeotic gene),是胚胎复杂的遗传系统的中心,在胚胎发育过程中,它通过相应的信号指挥胚胎的发生[3],发出信号作用于不同部位的细胞,使得细胞在分化的过程中接收到来自Hox基因的信号,能够保证各个部位分化出正常的组织和器官,是发育遗传学研究的前沿阵地[4]。Hox家族是动物基因组内高度保守的一类转录因子[5],目前共有39个[6],不但在动物体轴形成过程中扮演着重要的角色,对毛囊细胞增殖分化也起着重要作用[7-9],是一类重要的发育调控基因。通过对人和小鼠的研究发现,大多数Hox家族的基因均在皮肤和毛囊中表达[10]。Hoxa5能够对毛囊细胞的增殖、分化发出信号[9],从而能够阻断毛囊在退行期时的其他信号的传递,延滞了毛囊的周期发育[11]。Hox基因数目多少、序列的多样性及其表达模式直接决定了动物的生态多样性,因此Hox基因在模式生物系统中的研究相对较广泛。Hoxa5在控制毛生长发育中有重要作用,当缺少或过表达时,小鼠都会表现出毛生长的缺陷[12]。BMPs本身是一种蛋白,BMPs在骨的形成过程中发挥着重要的作用,通过诱导间充质干细胞使其分化成骨,也可以通过诱导促进脂肪细胞向骨细胞分化从而成骨,也有促进胚胎成纤维细胞的分化,进一步分化形成骨骼[13]。有研究表明,BMPs对毛囊细胞的发育也有一定的影响,初步得到对毛囊的发育是抑制作用,至于在哪个时期还有待研究。BMPR1B基因属于BMPs家族的Ⅰ型受体因子,同样它也调节神经细胞、骨细胞等的代谢。近来在绵羊多产基因分子机制上的研究较多,表明骨形态发生蛋白及其受体对动物卵泡发育具有重要影响。在毛囊生长发育上,BMPR1B基因在初级毛囊的毛母质、内根鞘和毛干等均可以表达,在次级毛囊的内根鞘和绒干也将表达[14],这为研究提供了一定的基础。
目前,在敖汉细毛羊身上基因的研究主要集中在肌肉方面,选取优良基因对肌肉肌纤维粗细的影响,对于有关皮肤毛囊的基因研究还相对较少,有一部分研究也只局限在分子水平上,通过基因mRNA的表达量来初步判断基因的作用;还有一部分是与毛囊无关的研究。本研究不仅从单个基因的mRNA水平和蛋白水平上对功能进行鉴定,并且着重对Hoxa5、BMPR1B两基因之间的相互作用关系进行了鉴定,以分析两者之间的上、下调关系,从而进一步为基因通路的研究提供一定的基础,为基因在个体层次上的研究提供坚实的基础。
1 材料和方法
1.1 试验材料
选取健康40日龄的胎羊。
1.2 主要试验试剂及仪器
PeM-T、pcDNA3.1质粒、Lipofectamine2000、高糖培养液等均购自青岛鑫宇恒一有限公司。BB5060UV 型贺氏二氧化碳培养箱购于德国Eppendorf公司,Western Blot、荧光定量PCR系统均购自Bio-Rad公司[15]。
1.3 表达载体的构建
1.3.1 引物设计及扩增 从NCBI中查找绵羊的Hoxa5(GenBank登录号为NM-015095103.2)、BMPR1B(GenBank登录号为NM-001009431.1)基因全序列,选取Hoxa5基因和BMPR1B基因的CDS区,利用软件Primer 5.0设计2个基因的引物。设计同时需在上下游引物5′端加入保护碱基和EcoR Ⅰ、KpnⅠ酶切位点,最终完成的Hoxa5引物序列为:
上游引物:5′-CCGGAATTCATGAGCTCTTATTTT GTAAAC-3′;
下游引物:5′-CGGGGTACCTAAACGCTCAAATA CTCAGG-3′。
在BMPR1B上下游引物5′端加入EcoR Ⅰ、NdeⅠ酶切位点,最终完成的引物序列为:
上游引物:5′-CCGGAATTCATGCTTCAGGTTTG CGAAGT-3′;
下游引物5′-GGAATTCCATATGTCAGATGTCC TGTCTAAGGG-3′[15]。
利用TRIzol裂解成纤维细胞,按照试剂盒说明提取细胞RNA,并将其反转录成cDNA。扩增体系为20 μL:DNA模板1 μL,上下游引物各1 μL,金牌Mix 17 μL。
1.3.2 TA克隆 对PCR产物进行琼脂糖凝胶电泳回收,对DNA片段进行加A,反应体系为:目的片段15 μL、Tailing-A ReactionBuffer 4 μL、TapDNA Polymerase 1 μL。TA克隆连接体系为:T4DNA连接酶2 μL、T4Buffer 1 μL、T载体2 μL、目的片段5 μL、水浴16 ℃ 3 h,4 ℃ 12 h。取50 μL DH5ɑ与5 μL T连接液混匀冰浴20 min;42 ℃热激90 s,冰浴15 min;加入400 μL LB培养基(不含AMP抗生素)37 ℃、200 r/min振荡培养1 h,去上清,将细胞均匀分散在含有AMP抗生素的培养基上,在37 ℃培养箱中倒置12 h,挑取单菌进行10 h摇菌[16]。
1.3.3Hoxa5、BMPR1B基因与pcDNA3.1质粒重组 对TA克隆载体分别进行EcoR Ⅰ、NdeⅠ双酶切和EcoR Ⅰ、KpnⅠ双酶切,酶切体系为:EcoRⅠ内切酶1 μL;NdeⅠ内切酶1 μL;KpnⅠ内切酶1 μL;TA克隆载体和pcDNA3.1 5 μL;Buffer 1 μL加水补足到50 μL体系。37 ℃ 2 h,对Hoxa5、BMPR1B基因及切开的pcDNA3.1质粒进行胶回收,取Hoxa5、BMPR1B基因各5 μL,3 μL pcDNA3.1,加入1 μL T4DNA连接酶及1 μL T4DNA连接酶Buffer,22 ℃金属浴2 h,16 ℃ 3 h,后转入到DH5α感受态细胞中过夜培养,选取单个菌落进行摇菌,利用简单PCR鉴定菌液中是否含有目的基因,对含有的菌液进行测序检测[16]。
1.4 敖汉细毛羊成纤维细胞的培养
从怀孕的母体中取出完整的40日龄胎羊,用75%酒精对胎儿清洗几遍,再用PBS进行清洗并保存。带回细胞间后用75%的酒精清洗,再用含有双抗的PBS清洗。对30日龄的胎羊只留躯干,将躯干分成直径1.0~1.5 cm,并在分离的组织上滴加适当的胎牛血清,覆盖组织即可,37 ℃,5.0% CO2培养箱培养3 h,之后在培养基加入适当的高糖培养液。24 h后先观察细胞生长情况,待细胞生长良好,则给细胞进行换培养液[15]。待细胞密度达95%,去除废旧培养液用预热含有双抗的PBS洗涤几遍,每个平板中加入1 mL的胰蛋白酶,放入CO2恒温培养箱中消化,当大量细胞由梭形变为圆形时加入3 mL的培养液停止消化。根据细胞密度的大小进行分板,继续加入新鲜的培养液进行培养,待细胞密度达95%后,再次进行传代[16]。
1.5 细胞转染
当细胞密度达90%左右时,去除旧的培养液,用不含抗生素的PBS清洗几遍,利用Lipofectamine2000进行转染,共转染组和单转染组分别取其20 μL脂质体试剂,加入480 μL DMEM(不含双抗),混匀,静置5 min,在共转染组中分别加入20 μL的Hoxa5、BMPR1B质粒,460 μL高糖培养基(不含双抗),单转染组加40 μL质粒,460 μL高糖培养基,孵育15~20 min,加入4 mL 高糖培养基,37 ℃培养6 h,换含有双抗的高糖培养液,继续培养36 h[18]。
1.6 实时荧光PCR检测
对转染后细胞继续正常培养48 h,当细胞密度达90%时收集细胞,去除培养基用PBS清洗几遍,每平板中加入 3 mL的TRIzol裂解成纤维细胞,按照试剂盒说明提取细胞RNA。其浓度和纯度处于正常范围时对RNA进行反转录[15-16],反转录成cDNA。通过NCBI查找绵羊Hoxa5、BMPR1B基因的CDS区和绵羊GAPDH的CDS区,利用PrimerPremier 5.0分别设计Hoxa5、BMPR1B和GAPDH基因的特异性荧光定量引物,序列如表1。
利用设计的荧光定量引物和反转录的cDNA对2个基因进行定量检测。试验组和对照组各设置3次重复,2个基因分别点36 μL,每孔总量5 μL;退火温度设置为60 ℃;结果数据利用公式Ct(2-ΔΔCt)计算,从而计算出Hoxa5、BMPR1B的相对表达量。荧光定量的数据结果用SPSS 20.0软件进行差异显著性分析,以P<0.01作为差异极显著性判断标准[15-16]。
表1 引物信息Tab.1 Primers information
1.7 Western Blotting检测Hoxa5、BMPR1B基因蛋白质表达
首先用细胞裂解液PARI裂解提取成纤维细胞中的蛋白质,目的基因Hoxa5、BMPR1B和内参基因β-actin分别点3个胶孔,先进行2.5 h的电泳;电泳后对蛋白质进行PVDF转膜,用转膜电泳槽进行2~3 h,完全转膜后对蛋白质进行封闭2 h;封闭后用TBST进行洗膜3次;对一抗进行1∶2 000的比例稀释,在4 ℃冰箱用一抗孵育PVDF膜12 h;一抗孵育完后进行二抗的孵育,对二抗进行1∶2 000的比例稀释,孵育1.5 h;孵育完成后进行曝光,A液和B液按照1∶1的比例混合,避光进行压膜,利用AIC曝光拍照。对曝光后的蛋白条带用ImageJ 软件进行灰度值分析,得出目的基因与内参基因灰度值的比值[17]。
2 结果与分析
2.1 Hoxa5、BMPR1B目的基因的扩增
利用反转录的cDNA和上下游引物对目的基因进行PCR 扩增,以获得Hoxa5、BMPR1B目的片段。电泳结果如图1所示,其扩增出的片段明亮且无杂带,Hoxa5条带大小约为804 bp,BMPR1B条带大小约为1 509 bp,均与已知的目的片段大小相同,可用于后期的连接试验。
M.2000 Marker;1.BMPR1B基因扩增条带(1 509 bp);2.Hoxa5基因扩增条带(804 bp)。M.2000 Marker;1.BMPR1B product(1 509 bp);2.Hoxa5 product(804 bp).
2.2 TA克隆测序比对
将获得的Hoxa5、BMPR1B基因片段分别与T载体连接,转化到DH5α中,37 ℃振荡培养12 h。对菌液的序列进行测序,将目的基因的序列与测序所得的序列用DNAMAN进行比对,比对结果如图2所示,菌液中的碱基序列与已有目的序列完全一致,碱基没有发生缺失。

Query.已知序列; Sbjct.目的基因序列。图6同。Query.Known sequence; Sbjct.Target gene sequence.The same as Fig.6.
2.3 克隆载体的鉴定
利用试剂盒对连接好的T-Hoxa5、T-BMPR1B克隆载体进行提取,提取后进行琼脂糖凝胶电泳检测,结果如图3所示,Hoxa5基因大小为804 bp,T载体大小为3 489 bp,连接上目的基因后应在4 293 bp处,BMPR1B基因大小为1 509 bp,T载体大小为3 489 bp,连接上目的基因后应在4 998 bp处,条带清晰单一,结果显示克隆载体提取成功,可用于后续的酶切试验。
M.5000 Marker;1-2.BMPR1B克隆载体(4 998 bp);3-4.Hoxa5克隆载体(4 293 bp)。M.5000 Marker;1-2.BMPR1B cloning vector(4 998 bp);3-4.Hoxa5 cloning vector(4 293 bp).
2.4 克隆载体、pcDNA3.1载体双酶切
对克隆载体和pcDNA3.1载体分别进行双酶切,克隆载体的双酶切将目的基因片段切下,pcDNA3.1的双酶切把载体切开,对两者双酶切之后的片段进行切胶回收用于后续的连接。结果如图4所示,1-4酶切效果良好,1-2是对BMPR1B克隆载体的EcoRⅠ、NdeⅠ双酶切,目的基因为1 509 bp,T载体为3 489 bp,与图中条带所吻合。3-4是对Hoxa5克隆载体的EcoRⅠ、KpnⅠ双酶切,目的基因为804 bp,T载体为3 489 bp,与图中条带所吻合。5-6是对pcDNA3.1的双酶切,大小为5 428 bp,图中条带与已知大小所吻合。因此目的基因可与表达载体pcDNA3.1进行连接。
M.5000 Marker;1-2.BMPR1B克隆载体EcoR Ⅰ、NdeⅠ双酶切;3-4.Hoxa5克隆载体EcoR Ⅰ、KpnⅠ双酶切;5-6.pcDNA3.1载体双酶切。
M.5000 Marker;1-2.BMPR1Bcloning vectorEcoRⅠ,NdeⅠ double digestion;3-4.Hoxa5cloning vectorEcoRⅠ,KpnⅠ double digestion;5-6.pcDNA3.1 vector double digestion.
图4 克隆载体及pcDNA3.1载体双酶切
Fig.4 Cloning vector and pcDNA3.1 vector double digestion
2.5 表达载体pcDNA3.1构建及鉴定
将克隆载体酶切下的BMPR1B、Hoxa5目的片段与pcDNA3.1载体进行连接,连接后进一步转入DH5α感受态细胞中,37 ℃、200 r/min振荡培养10 h,对所得的菌液进行普通PCR鉴定,电泳结果条带清晰单一,大小约在804 bp处(图5),与已知的Hoxa5基因相符;另在1 059 bp处也有单一明亮的条带,与已知的BMPR1B基因相符。说明BMPR1B、Hoxa5与pcDNA3.1载体连接成功。
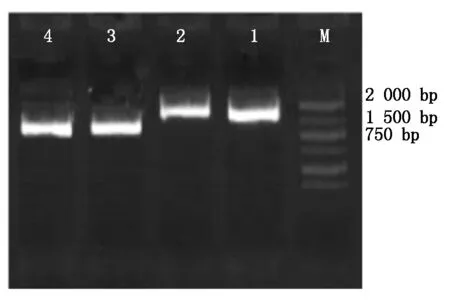
M.2000 Marker;1-2.BMPR1B;3-4.Hoxa5。
2.6 表达载体菌液测序鉴定
获得pcDNA3.1-Hoxa5、pcDNA3.1-BMPR1B表达载体的菌液,对菌液中质粒进行测序鉴定,与已知目的基因的序列进行比较匹配,碱基未发生缺失、添加现象,完全一致(图6)。结果表明,目的基因与pcDNA3.1载体连接成功,且目的基因能够稳定地存在于pcDNA3.1载体中。
2.7 细胞形态观察
2.7.1 原代培养形态观察 通过组织块法对细胞进行培养。24 h进行细胞的观察,可以观察到细胞开始慢慢贴壁,也有少数游离的组织,贴壁的细胞形状不完全是梭形,以梭形居多,还有其他形状的杂细胞(图7)。培养96 h可见培养皿的底部细胞密度约为95%,此密度可对细胞进行传代。
2.7.2 传代培养形态观察 细胞呈指数增长,细胞密度不易过大,因此需要对细胞进行传代,否则会引起抑制生长现象。一般在3 d左右细胞的密度可达90%~95%,此时即可对细胞进行传代。利用胰蛋白酶将贴壁的细胞消化成悬浮状态,分离到其他平板中,前12 h内细胞生长的速度会比较缓慢,12 h后生长将迅速增快,大多数细胞基本保持梭形,如图8所示。

图6 BMPR1B(A)、Hoxa5(B)菌液测序比对Fig.6 BMPR1B(A),Hoxa5(B) bacterial sequencing comparison
图7 原代培养24 h(×100)Fig.7 Primary culture 24 h(×100)
图8 成纤维细胞传代培养(×100)Fig.8 Fibroblasts subculture(×100)
2.8 实时荧光RT-PCR检测Hoxa5、BMPR1B基因表达
对转染后的细胞提取RNA并反转录成cDNA,应用荧光定量引物进行PCR 扩增Hoxa5、BMPR1B和GAPDH片段。电泳分析结果如图9所示,扩增出的条带明亮且单一,GAPDH扩增的条带大约在128 bp处,Hoxa5扩增的条带大约在186 bp处,BMPR1B条带大小约在198 bp处,因此可继续进行实时荧光定量PCR试验。
由图 10可知,两目的基因Hoxa5、BMPR1B和内参基因GAPDH的熔解曲线上均未出现杂乱的峰,且只有1个峰,扩增曲线比较集中统一,此图表明设计的实时荧光定量PCR引物特异性良好,因而能够获得单一特定产物[15]。对共转染的细胞和单转染的细胞mRNA表达量进行分析,Hoxa5基因共转染后mRNA表达量明显升高,BMPR1B基因共转染后mRNA表达量明显下降,Hoxa5、BMPR1B共转染与单转染比较均差异极显著(P<0.01),见图11。

图10 Hoxa5、BMPR1B、GAPDH 扩增曲线图(A)和熔解曲线峰值图(B)Fig.10 Hoxa5,BMPR1B,GAPDH amplification (A) and melting curve(B)

不同大写字母表示差异极显著(P<0.01)。图13同。The different capital letters indicate that the difference is extremely significant (P<0.01).The same as Fig.13.
2.9 Hoxa5、BMPR1B基因蛋白表达的检测
对单、共转染的成纤维细胞进行蛋白的提取,然后进行Western Blot。将Hoxa5、BMPR1B基因共转染与单转染进行比较,Hoxa5共转染的蛋白条带明显亮于单转染的对照组,BMPR1B共转染的蛋白条带明显暗于单转染对照组(图12)。利用ImageJ分析的蛋白条带的灰度值有所不同,通过SPSS分析灰度值数据差异显著性,得出细胞共转染Hoxa5基因蛋白表达量极显著高于单转染(P<0.01)(图13),共转染的BMPR1B基因蛋白表达量极显著低于单转染(P<0.01)。

图12 Hoxa5、BMPR1B基因表达蛋白条带Fig.12 Hoxa5,BMPR1B gene expression protein product
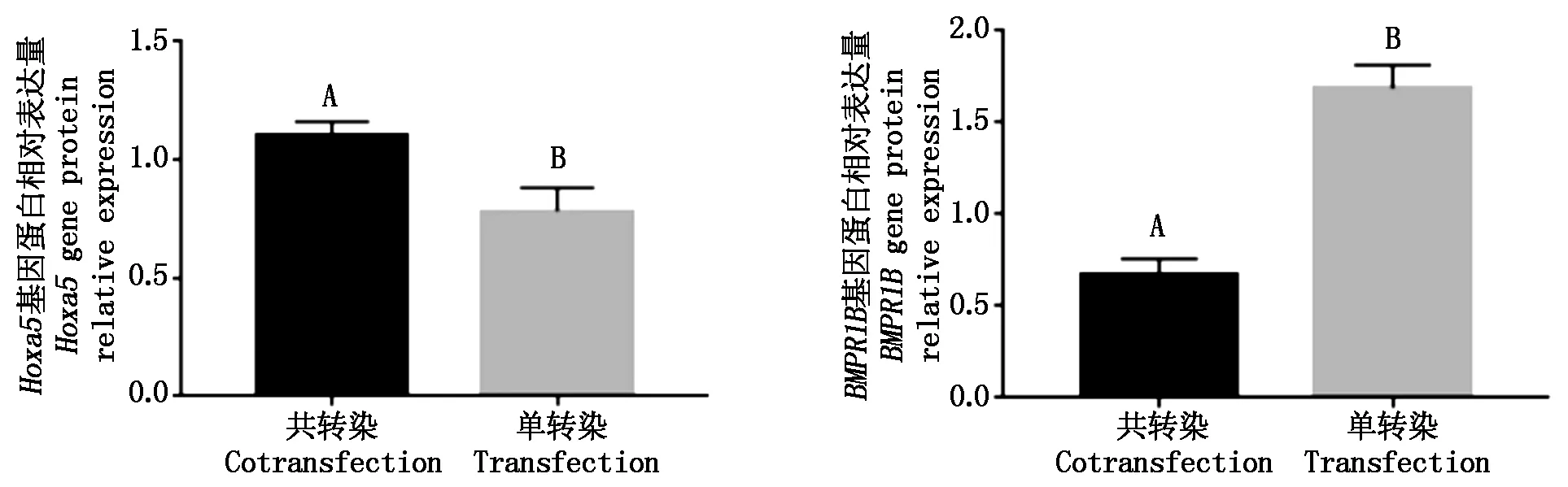
图13 Hoxa5、BMPR1B基因蛋白相对表达量Fig.13 Hoxa5,BMPR1B gene protein relative expression
3 讨论与结论
许多的信号相互传递着多个细胞群之间的信号反应,这些信号分子决定着毛囊的发育,它们使毛囊细胞进行着有序地增殖和分化,使之形成完整的毛囊结构[19]。毛囊形态发生是由真皮发出原始信号[20],在毛囊基板形成的起始阶段,必须先激活皮肤中Wnt信号[21-22]。有研究表明,部分上皮细胞的生长、增殖受Eda类因子和下游的转录因子活性的影响[23-24]。目前,调节毛囊形态发生变化的信号分子有7类,以骨形成蛋白(BMP)信号家族、Wnt通路等为主线,其他信号通路相互调和控制,在单信号通路中,也是2个及以上基因进行调节,很少出现单个基因的调控,相应的呈现抑制或促进不同的作用。BMPR1B基因属于BMP家族,是一种促进物,对毛囊的发育起到了一定的促进作用,Hoxa5基因属于TNF家族,是一种抑制物,对毛囊的发育起到了一定的抑制作用,现在对单个基因作用的研究有所存在,对2个基因以及多个基因作用的研究相对较少,通过对它们之间的相互作用来筛选良性基因,促进羊毛的生产。
也有学者对单个基因功能进行过鉴定,Hoxa5属于Hox家族,得到Hoxa5对脂肪的代谢调节作用,间接控制脂肪粒细胞中的信号因子发挥作用,也有结论得出Hoxa5基因的信号调节对胚胎的发育有重要的影响,对造血干细胞的增殖调节控制起主导作用。Hoxa5对毛囊的发育也有相应的鉴定,是否影响其他与毛囊发育相关的基因,本试验利用BMPR1B基因和它进行相互作用的研究,BMPR1B本身对毛囊的发育有一定的促进作用,Hoxa5的存在以及过表达是否会有利于BMPR1B基因的表达。通过试验结果分析两者的相互作用关系,Hoxa5基因的过表达对BMPR1B基因起到了一定的抑制作用,使得促进羊毛发育的基因受到了抑制,因此两者同时的过表达不利于羊毛的生长,以后的羊毛生产过程中尽量避开抑制性基因的过表达。
Hoxa5、BMPR1B单个基因功能的鉴定出现过,但与毛囊发育功能的鉴定较少。Hoxa5、BMPR1B基因两者之间相互作用关系的研究未曾出现过,本研究可以从mRNA水平和蛋白水平上来鉴定两者之间的作用关系。本研究通过表达载体的构建成功的构建了pcDNA3.1-Hoxa5、pcDNA3.1-BMPR1B基因表达载体,转染到敖汉细毛羊的成纤维细胞中,观察细胞的形态以及测定相应表达指标,从而进一步研究基因的作用以及两者之间的相互作用关系。转染后的细胞,Hoxa5、BMPR1B基因的mRNA和蛋白表达量均有明显的升高,初步验证了通过载体构建后基因过表达。单方面研究Hoxa5基因,得知Hoxa5基因能够抑制毛囊的发育,作为和其他基因之间是否存在促进或拮抗作用有待研究,本试验通过与BMPR1B基因的共同研究得出Hoxa5基因自身过表达的同时也将会影响其他信号通路中的基因,至于是促进还是拮抗则根据它们的表达量来判断[18]。
本研究分别对Hoxa5、BMPR1B基因表达载体进行构建,转染成纤维细胞,利用实时荧光定量PCR、Western Blot等检测mRNA和蛋白的表达,结果成功地构建了pcDNA3.1-Hoxa5、pcDNA3.1-BMPR1B,并且共转染成纤维细胞Hoxa5基因的表达量明显升高,BMPR1B的mRNA表达量和蛋白表达量均明显下降,且共转染组的表达量极显著低于单转染组(P<0.01),因而推测Hoxa5基因抑制了BMPR1B基因的表达,BMPR1B基因促进了Hoxa5基因的表达,为进一步在个体水平上研究其功能奠定基础。

