青蒿琥酯对实验性自身免疫性脑脊髓炎小鼠的神经保护作用及细胞自噬的影响
罗思维, 李作孝
(西南医科大学附属医院神经内科,四川 泸州 646000)
多发性硬化(multiple sclerosis, MS) 是一种中枢神经系统慢性炎症脱髓鞘疾病,其病因及发病机制尚未完全明确,可能与遗传、免疫、炎症、环境因素等多因素有关[1]。对MS的治疗主要以激素冲击或丙种球蛋白为主,且治疗价格昂贵,不良反应较多。但许多研究证据表明MS的病因和治疗目标并不是单一的,MS中不仅仅存在免疫系统的异常,还与自噬、凋亡、氧化应激、线粒体损伤、能量衰竭等有关[2]。青蒿琥酯是青蒿素的一种半合成衍生物, 对疟疾的治疗有显著效果,能够有效的透过血脑屏障[3]。青蒿琥酯除治疗疟疾外,对重症肌无力、系统性红斑狼疮、类风湿性关节炎、免疫性肝炎等自身免疫性疾病也有治疗作用[4-7]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)是目前研究MS最常用的动物模型。已有研究发现,青蒿琥酯能够改善EAE大鼠临床症状,抑制PGE2的表达,防止EAE发病[8]。青蒿琥酯还能抑制白细胞向中枢神经系统迁移,改善实验性自身免疫性脑脊髓炎小鼠症状[9]。但目前国内外尚未发现青蒿琥酯对EAE动物模型细胞自噬的研究报道。因此本研究旨在通过青蒿琥酯干预EAE小鼠,进一步探讨对EAE小鼠细胞自噬作用。
1 材料和方法
1.1 实验动物
选用8周龄48只雌性SPF级C57BL/6小鼠(18~20 g),均购于重庆腾鑫比尔实验动物销售有限公司[SCXK(渝)2017-0001],饲养于西南医科大学忠山动物房内[SYXK(川)2013-185],保持实验前适应性饲养1周,保持室温24℃左右的恒温环境,每12 h维持昼夜交替,保持小鼠生长环境清洁,整个实验过程符合《实验动物饲养和使用条例》,且经西南医科大学动物保护与使用机构委员会批准。
1.2 主要试剂
注射用青蒿琥酯(桂林南药股份有限公司),MOG35-55多肽(上海吉尔生化有限公司),完全弗氏佐剂(美国Sigma公司),百日咳毒素(美国Sigma公司),兔抗小鼠多克隆微管相关蛋白1轻链3B(LC2B)抗体(Abcam公司),山羊抗兔HRP(Aspen公司),luxol fast blue(LFB)染液试剂盒(Aspen公司),卡介苗冻干粉(上海嘉楚生物工程有限公司)。
1.3 实验方法
1.3.1 实验分组和EAE模型制作
将48只雌性C57BL/6小鼠随机分为空白组、模型组、青蒿琥酯低剂量组、高剂量组共4组,每组12只。参照Feng等[10]和许梦雪等[11]方法进行EAE造模,将5 mg MOG35-55溶于1 mL 生理盐水中,卡介苗溶于完全弗氏佐剂中,浓度为10 g/L。将上述2种液体1∶1混合成诱导乳化剂。用1 mL注射器分别在模型组、低剂量组、高剂量组小鼠背部皮下注射诱导乳化剂0.1 mL(左右背侧各0.05 mL)制作EAE模型,空白组注射等量生理盐水。在造模当日及2 d后,于造模小鼠分别腹腔注射0.5 mL百日咳菌稀释液增强免疫,空白组注射等量生理盐水。造模后根据小鼠的一般情况观察及神经功能评分增加判断EAE模型建立成功[12]。根据小鼠发病情况将造模成功小鼠纳入了实验[13]。
1.3.2 药物干预方法
低剂量组和高剂量组从造模当日开始分别腹腔注射剂量为10 mg/(kg·d)、50 mg/(kg·d)的青蒿琥酯,每日1次,连续10 d。空白组和模型组每日腹腔注射等剂量生理盐水。由于目前国内外在青蒿琥酯对EAE的作用机制研究较少,本实验低浓度、高浓度标准基于黄蕾等[8]和Thome等[9]研究,参照青蒿琥酯对类风湿性关节炎、自身免疫性肝炎的影响标准设立。
1.3.3 小鼠一般情况观察
造模当日起由每天早上8:00对各组小鼠进行观察,遵循双盲原则,记录小鼠发病潜伏期、进展期、高峰期、体重变化、毛发光泽及根据Weaver’s15分评分法[14]进行神经功能评分。评分细则如下:尾巴无症状计0分,尾巴张力减低或尾巴远端瘫痪计1分,尾巴全瘫计2分;四肢无症状计0分,步态不稳计1分,肢体轻瘫、行走时肢体摇曳计2分,肢体全瘫、行走时肢体外翻计3分;尾部和四肢的评分相加得总分,若出现死亡计15分。
1.3.4 动物处死及标本采集
各组于发病高峰期处死(神经功能评分连续三天无变化为高峰期)[15],空白组观察至28 d[16]。取小鼠脑组织、颈膨大、腰膨大放入-80℃冰箱保存备用。制作病理切片的小鼠,经麻醉后,固定四肢,暴露心脏,剪开右心耳,将注射器针头置于左心室中,缓慢灌注生理盐水至肝脏发白,然后灌注4%多聚甲醛进行内固定,致小鼠全身僵硬时取出脑组织置于4%多聚甲醛中24 h进行外固定。
1.3.5 LFB染色
取脑组织侧脑室周围组织常规石蜡切片,片厚6 μm,将石蜡切片脱蜡,放入95%乙醇中5 min进行醇化,然后放入LFB染液中60℃水浴24 h,分化,封片。
1.3.6 Western blot检测LC3-I、LC3-II表达情况
将脑白质、颈膨大、腰膨大加入裂解液提取总蛋白,BCA法测定蛋白浓度,经过SDS-PAGE电泳、转膜、封闭后,加入LC3、GAPDH一抗4℃过夜,回收已稀释的一抗,用TBST洗三次,每次5 min,加入山羊抗兔二抗,室温孵育30 min,用TBST在室温下摇床上洗四次,每次5 min,滴加新鲜配制的ECL混合溶液到膜的蛋白面侧,暗室中曝光,根据不同的光强度调整曝光条件,显影、定影,采用AlphaEaseFC软件处理系统分析目标带的光密度值。
1.4 统计学方法

2 结果
2.1 小鼠发病情况
2.1.1 小鼠一般情况
EAE小鼠造模成功表现为精神萎靡、饮食活动减少、毛发光泽度降低、体重减轻,此后逐渐加重出现尾部下垂、步态不稳、后肢行走无力、甚至瘫痪,神经功能评分大于0分。
空白组小鼠未见发病。模型组、青蒿琥酯低剂量组、高剂量组小鼠中出现不同严重程度的尾部下垂、步态不稳、后肢行走无力、甚至瘫痪,神经功能评分增加,发病率分别为83.3%,83.3%,75%,但差异无统计学意义(P>0.05)。各组均未出现小鼠死亡。
2.1.2 发病潜伏期、高峰期及神经功能评分比较
青蒿琥酯各剂量组发病潜伏期、高峰期较模型组均有延长(P<0.01);高剂量组小鼠潜伏期较低剂量组延长(P<0.01);高剂量组小鼠高峰期较低剂量组延长,但差异无统计学意义(P>0.05)。青蒿琥酯各剂量组发病高峰期神经功能评分均低于模型组(P<0.01),高剂量组评分低于低剂量组(P<0.05)。(如表1所示)
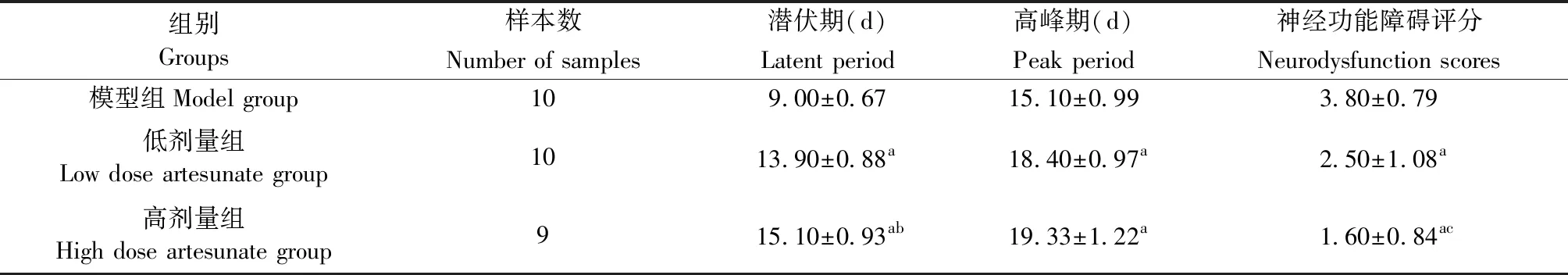
表1 模型组及各剂量组发病潜伏期、高峰期、高峰期神经功能障碍评分比较
注:与模型组比较,aP<0.01;发病潜伏期与青蒿琥酯低剂量组比较,bP<0.01;高峰期神经功能障碍评分与青蒿琥酯低剂量组比较,cP<0.05。
Note. Compared with the model group,aP< 0.01. Compared with the low-dose artesunate group in the latent period,bP< 0.01. Compared with the low-dose artesunate group in terms of neurodysfunction scores,cP< 0.05.
2.2 Luxol fast blue (LFB) 染色情况
LFB染色观察各组小鼠脑组织病理改变情况。空白组小鼠脑组织LFB染色髓鞘结构清晰,未出现脱髓鞘情况(图1A)。模型组、青蒿琥酯低剂量组、高剂量组小鼠均出现了不同程度的脱髓鞘,髓鞘结构排列稀疏、紊乱,可见不同程度低染区域及空泡状结构(图1B-D),青蒿琥酯治疗组小鼠脑组织脱髓鞘情况较模型组轻。(如图1所示)

表2 各组LC3I、LC3II、LC3II/LC3I光密度值比较(n=5)
注:与空白组比较,aP<0.01;为与模型组比较,bP<0.01;与青蒿琥酯低剂量组比较,cP<0.05。
Note. Compared with the control group,aP<0.01. Compared with the model group,bP<0.01. Compared with the low-dose artesunate group,cP<0.05.
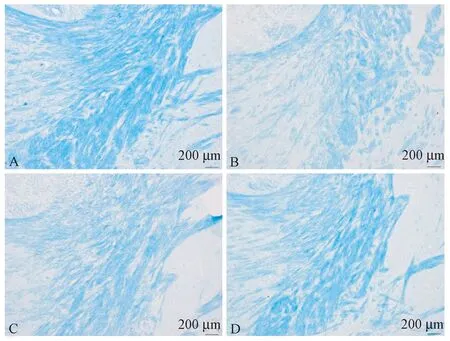
注:A为空白组;B为模型组;C为低剂量组;D为高剂量组。图1 各组小鼠脑组织LFB染色情况Note. A, Control group. B, Model group. C, Low-dose artesunate group. D, high-dose artesunate group.Figure 1 Demyelization in the brain tissues of mice in different groups(Luxol fast blue staining)
2.3 Western blot检测结果
模型组较空白组比较,LC3-I、LC3-II条带光密度值均增加,LC3-II/LC3-I比值也增加,差异具有统计学意义(P<0.01);青蒿琥酯各剂量组与模型组比较,LC3-I、LC3-II条带光密度值均减小,LC3-II/LC3-I比值也较小,差异具有统计学意义(P<0.01),高剂量组较低剂量组作用明显,差异具有统计学意义(P<0.05)。(如图2、表2所示)

图2 各组Western blot检测LC3I、LC3II表达情况Figure 2 Western blot analysis showing the expressions of LC3-I and LC3-II in the mice
3 讨论
青蒿琥酯是青蒿素的主要衍生物之一,对于临床各型疟疾的治疗效果显著,同时也有抗菌、抗病毒、抗肿瘤、抗纤维化、免疫调节等作用,其价格便宜、不良反应轻,有很多潜在的应用价值[3]。已有研究发现青蒿琥酯对多种自身免疫性疾病具有治疗作用[4-7]。但目前青蒿琥酯对EAE动物模型的研究较少,国内外各只有一篇文献报道。黄蕾等[8]研究发现青蒿琥酯能够改善EAE大鼠临床症状,抑制PGE2的表达,防止EAE发病。Thome等[9]研究发现青蒿琥酯还能抑制白细胞向中枢神经系统迁移。本实验结果显示,青蒿琥酯对EAE小鼠具有神经保护作用,能够延迟小鼠发病潜伏期、高峰期,改善神经功能评分,这与黄蕾等研究结果一致。LFB染色结果显示青蒿琥酯能够改善脑组织髓鞘脱失情况,在国内外研究中是首次发现。
同时,青蒿琥酯还具有调节细胞自噬的作用。自噬紊乱可导致多种神经系统疾病,包括多发性硬化、阿尔茨海默病、亨廷顿病、帕金森病和肌萎缩侧索硬化症[10]。自噬是将细胞内变形、衰老或损伤的蛋白质和细胞器转运到溶酶体腔中进行消化降解的一种普遍存在于真核生物的依赖溶酶体的降解过程,它实现了细胞内物质和能量的更新, 维持了蛋白质代谢平衡和细胞内环境的稳态[17-18]。Feng等[19]研究显示青蒿琥酯能通过PI3K/AKT/mTOR信号通路增强类风湿性关节炎大鼠滑膜细胞自噬水平。鲁永玲等[20]研究发现青蒿琥酯能通过活性氧途径增加小鼠巨噬细胞的自噬水平进而上调其杀菌活性。青蒿琥酯还能显著抑制Burkitt淋巴瘤Raji细胞的增殖,诱导Raji细胞凋亡和自噬[21]。Chen等[22]研究发现青蒿琥酯通过自噬诱导乳腺癌细胞G2/m细胞周期阻滞,抑制肿瘤细胞生长。微管相关蛋白1轻链3(LC3)是自噬标志物,分为胞质型(LC3I型)和自噬体膜型(LC3II型),LC3I在自噬相关基因Atg7、Atg3的调控下转化为LC3II,LC3II直接反应了自噬体的形成,LC3II/LC3I比例反映了自噬水平情况[23]。因此LC3I向LC3II生成障碍及自噬体降解受阻均会降低自噬水平。本实验Western blot检测结果与空白组相比,模型组脑脊髓组织LC3I、LC3II表达及LC3II/LC3I比值均上调,提示EAE小鼠脑脊髓组织存在细胞自噬异常。青蒿琥酯各剂量组较模型组相比,LC3I、LC3II表达及LC3II/LC3I比值均下调,高剂量组作用明显,提示青蒿琥酯通过减轻细胞自噬作用发挥对EAE小鼠的神经保护作用,在国内外研究中均是首次发现。但本实验不足之处在于未进一步研究青蒿琥酯对于EAE小鼠细胞自噬的时序变化以及信号通路的影响,希望后续研究能进一步阐明相关机制,同时未能进一步研究区分神经元及神经胶质细胞的自噬调控。且青蒿琥酯低浓度组和高浓度组发病高峰期数据差异无统计学意义,可能与青蒿琥酯浓度组设置和样本量较少有关。
综上所述,本实验发现青蒿琥酯对EAE小鼠具有神经保护作用,其作用机制与下调LC3II/LC3I表达减轻细胞自噬有关,有望为临床应用青蒿琥酯治疗MS提供实验理论基础。

