RGD多肽修饰的芬维A铵脂质体对恶性黑素瘤细胞增殖、凋亡及迁移的影响
王梦蛟 崔艾丽 金承龙 方宇辉 金哲虎
延边大学附属医院皮肤科,吉林 延吉 133000
恶性黑素瘤是一种发病率较低但恶性度高、侵袭性强、死亡率高的皮肤癌[1],始源于黑素细胞的异常增殖[2]。芬维A铵[fenretinide,N-(4-hydroxyphenyl)retinamide,4-HPR]是新一代合成的全反式维A酸类衍生物,与传统维A酸相比,4-HPR毒性小、不良反应少且耐受率高,在多种肿瘤中发挥调节分化、抗侵袭、抑制生长和诱导凋亡等作用[3],据报道也可显著抑制黑素瘤细胞的增殖[4]。但其疏水性极强,导致生物利用度。但其疏水性极强,导致生物利用度低,难以达到满意的治疗效果。脂质体是一种无毒性及免疫原性的药物载体,含有类细胞膜的脂质双分子层结构,具有降低药物毒性、减少不良反应、提高药物治疗指数等优点,并且可以使药物在肿瘤内蓄积达到被动靶向作用。药物的靶向递送是近年来的研究热点,靶向蛋白的应用被大量研究并具有良好的效果。整合素是表达于细胞表面的具有信号传递作用的跨膜受体,其中整合素αvβ3在包括人恶性黑素瘤细胞的多种肿瘤细胞中高表达,在肿瘤的发生中具有重要作用[5-7],精氨酸(R)-甘氨酸(G)-天冬氨酸(D)(RGD)序列是广泛认可的靶向整合素αvβ3的多肽序列[8]。本研究中我们将4-HPR以脂质体进行包载以提高水溶性,并且采用RGD多肽对脂质体进行修饰,通过其与黑素瘤细胞表面整合素αvβ3的特异性结合以实现药物向肿瘤细胞的靶向递送,并检测4-HPR对B16F10和A375细胞的增殖、迁移抑制及凋亡诱导作用,和cRGDfk修饰4-HPR脂质体对该作用的影响。
材料与方法
一、材料
鼠源高转移性恶性黑素瘤B16F10细胞和人黑素瘤A375细胞(来自中国医学科学院基础医学研究所细胞中心),以含10%胎牛血清的DMEM培养液于37℃5%CO2培养箱内培养。
4-HPR、胆固醇、甲醇[高效液相色谱(HPLC)级]、细胞计数试剂盒8(CCK8)均为美国Sigma-Aldrich公司产品,二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-mPEG2000)为美国Laysan Bio公司产品,蛋黄卵磷脂为上海东尚生物科技有限公司产品,巯基丙酸-cRGDfk为上海强耀生物科技有限公司产品,胎牛血清、DMEM高糖培养基为美国Hyclone公司产品,细胞凋亡检测试剂盒为北京四正柏生物科技有限公司产品,Agilent 1260型HPLC仪来自美国Agilent公司,JY92-ⅡN型超声波细胞粉碎机来自宁波新芝生物科技股份有限公司,Malvern Nano ZS型激光粒度分析仪来自英国Malvern公司,Spectra Max190型酶标仪来自美国MD公司,EPICS XL型流式细胞分析仪为美国Beckman Coulter公司产品。
二、实验方法
1.薄膜-水化法制备芬维A铵脂质体(4-HPRL)及RGD多肽修饰的4-HPRL(RGD-4-HPRL):将巯基丙酸-cRGDfk与二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-马来酰亚胺(DSPE-mPEG-mal)按摩尔比1∶1溶于去离子水,氮气保护下常温反应24 h,反应结束后以双蒸水透析48 h,冷冻干燥后得到RGD-DSPE-mPEG,以三氯甲烷为溶剂,以核磁共振氢谱(1H NMR)600 MHz鉴定其结构。称取4-HPR 9 mg,胆固醇7.5 mg,含或不含RGDDSPE-mPEG的DSPE-mPEG 9 mg(RGD-4-HPRL中RGD-DSPE-mPEG占1/10),蛋黄卵磷脂84 mg,置于250 ml圆底烧瓶内,加入3 ml三氯甲烷溶解,50℃旋蒸干燥30 min至形成均匀薄膜,加入5%葡萄糖溶液6 ml水化,探头超声(超声参数:超声2 s,停1 s,能量150 W,时间15 min)后用直径0.22 μm水膜过滤3次除去游离药物,即得4-HPRL或RGD-4-HPRL的溶液。使用马尔文粒径仪检测粒径和电位,HPLC检测4-HPR浓度,并测定包封率和载药量。
2.细胞活性检测:
(1)脂质体材料对细胞活性的影响:取对数生长期的B16F10和A375细胞,0.25%胰酶常规消化后500×g离心4 min,按5×103个/孔接种于96孔板,37℃、5%CO2培养箱中培养24 h后,分为对照组、调零组和5个实验组,每组6孔,调零组不给予任何处理,对照组加入新鲜DMEM培养液,实验组分别加入含不同浓度(同1、10、20、30、50、100 mg/L 4-HPR组)空白脂质体的DMEM培养液,继续培养24h,后以CCK8试剂进行染色[4]。酶标仪测定450nm波长处吸光度(A)值并计算细胞活性:细胞活性(%)=[(A实验组-A调零组)/(A对照组-A调零组)]×100%。
(2)4-HPR、4-HPRL和RGD-4-HPRL对B16F10和A375细胞活性的影响:细胞培养及分组方法同上,实验组分别加入含有不同浓度(4-HPR浓度均分别为10、20、30和50 mg/L)4-HPR、4-HPRL和RGD-4-HPRL的DMEM培养液,每孔200 μl。24 h后染色并采用酶标仪检测各组A450值,按上述方法计算细胞活性。
3.膜联蛋白V/碘化丙锭染色检测细胞凋亡:按1.5×105个/孔分别接种两种细胞于6孔板内,每孔加入1 ml培养液,培养24 h后,分成对照组、4-HPR组、4-HPR-L组和RGD-4-HPRL组,每组3孔,对照组加入2 ml新鲜培养液,给药组分别加入含4-HPR、4-HPRL和RGD-4-HPRL的DMEM培养液2 ml,其中4-HPR浓度均为10(B16F10细胞)或20 mg/L(A375细胞),继续培养24 h后收集细胞并染色,检测每孔细胞凋亡比例并统计分析[4]。早期凋亡细胞可以结合膜联蛋白V,细胞显示在右下象限;晚期凋亡细胞膜通透性增加,碘化丙锭可以进入细胞核与DNA结合,细胞显示在右上象限。总凋亡细胞即早期凋亡与晚期凋亡细胞之和。
4.细胞划痕实验:分别取B16F10细胞和A375细胞,以1.0×105个/孔的密度接种于12孔板,每孔加入1 ml培养液,培养24 h后分成对照组、4-HPR组、4-HPR-L组和RGD-4-HPRL组,每组3孔,对照组加入2 ml新鲜培养液,实验组分别给予4-HPR浓度为10 mg/L(B16F10细胞)或20 mg/L(A375细胞)的4-HPR、4-HPRL和RGD-4-HPRL的DMEM培养液1 ml,分别于给药后即刻、24 h和48 h倒置显微镜下观察划痕愈合情况并拍照。
5.B16F10细胞对香豆素6(C6)的摄取情况:以C6取代4-HPR制备C6L和RGD-C6L。取B16F10细胞以1.5×105/孔接种于6孔板,24 h后分为对照组、C6组、C6L组及RGD-C6L组,每组3个复孔,分别加入含有1 mg/L C6的上述制剂的无血清DMEM培养液,继续培养5 min,冷PBS漂洗3次,胰酶消化,500×g离心收集细胞,流式细胞仪检测各组细胞的荧光强度。
6.统计学分析:采用SPSS Statistics 22.0软件分析,计量数据以±s表示。多组间数据比较采用单因素方差分析,两两组间比较采用t检验。P<0.05为差异有统计学意义。
结果
一、RGD-DSPE-mPEG表征
1H NMR对DSPE-mPEG和RGD-DSPE-mPEG结构的鉴定结果显示,DSPE-mPEG在化学位移6.70×10-6处有马来酰亚胺中的α,β-不饱和双键氢的特征峰,RGD-DSPE-mPEG在6.70×10-6处α,β-不饱和双键氢的特征峰消失,与文献报道一致[9]。见图1。
二、4-HPRL与RGD-4-HPRL表征
通过薄膜-水化法制备的4-HPRL溶液中4-HPR浓度可高于1 300 mg/L。4-HPRL粒径为(85.31±1.36)nm,电位为(-23.13±0.57)mV;RGD-4-HPRL粒径为(90.76±0.55)nm,电位为(-24.43±0.50)mV。脂质体粒径分布均一,与4-HPRL相比,RGD-4-HPRL粒径稍有增大,电位稍有降低。4-HPRL包封率(95.51±1.22)%,载药量(7.27±0.11)%;RGD-4-HPRL包封率(95.82±0.81)%,载药量(7.14±0.13)%。4-HPRL与RGD-4-HPRL均具有较高的包封率和载药量,二者之间无明显差异。
三、细胞活性检测结果
当空白脂质体浓度分别为10、20、30、50、100 mg/L时,24 h后B16F10细胞活性分别为(101.8±1.8)%、(99.5±2.6)%、(97.6±1.4)%、(90.8±2.0)%、(83.7±0.9)%,A375细胞活性分别为(101.1±1.3)%、(96.7±1.4)%、(94.5±1.9)%、(88.7±0.9)%、(79.5±0.5)%。可见RGD-4-HPRL载药材料即RGD-空白脂质体浓度≤30 mg/L时在24 h内对B16F10细胞活性抑制低于5%,对A375细胞活性抑制低于7%,表明脂质体材料生物相容性良好,无明显细胞毒性。
由表1可见,4-HPR作用24 h可明显抑制B16F10和A375细胞活性,抑制率接近50%的4-HPR浓度分别10 mg/L和20 mg/L,所以后续实验分别采用以上浓度。4-HPR浓度相同时,RGD-4-HPRL组两种细胞的增殖抑制率明显高于4-HPR组(均P<0.01)和4-HPRL组(P<0.01或0.05),且4-HPRL组高于4-HPR组(均P<0.01)。表1显示细胞增殖抑制率一般随药物浓度增加而逐渐升高,但当抑制率增加到70%以上时基本保持稳定。
四、4-HPR诱导细胞凋亡研究
见图2、表2。4-HPR可明显诱导B16F10和A375细胞发生凋亡,且以晚期凋亡为主。4组间B16F10细胞(F=2 826.830,P<0.01)和A375细胞凋亡率(F=279.002,P<0.01)差异均有统计学意义,其中,4-HPRL组两种细胞凋亡率均高于4-HPR组(t值分别为25.338、6.870,均P<0.01),RGD-4-HPRL组凋亡率又高于4-HPR组(t值分别为43.152、14.016,均P<0.01)及4-HPRL组(t值分别为8.145、10.243,均P<0.01)。
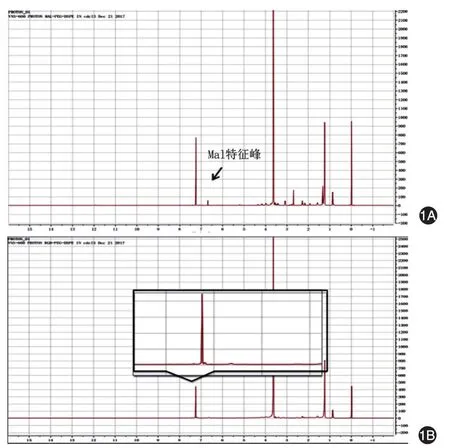
图1 DSPE-mPEG-mal与RGD-DSPE-mPEG的1H NMR鉴定图谱1A为DSPE-mPEG-mal核磁图谱,可见6.70×10-6处马来酰亚胺特征峰;1B为RGD-DSPE-mPEG核磁图谱,6.70×10-6处马来酰亚胺特征峰消失。DSPE-mPEG:二硬脂酰基磷脂酰乙醇胺-聚乙二醇;DSPE-mPEG-mal:二硬脂酰基磷脂酰乙醇胺-聚乙二醇-马来酰亚胺
表1 4-HPR、4-HPRL和RGD-4-HPRL对B16F10细胞和A375细胞增殖的抑制率比较(±s)

表1 4-HPR、4-HPRL和RGD-4-HPRL对B16F10细胞和A375细胞增殖的抑制率比较(±s)
注:n=4。相同浓度条件下,a与4-HPR组同种细胞相比,P<0.01;与4-HPRL组同种细胞相比,bP<0.01,cP<0.05。4-HPR:芬维A铵;4-HPRL:4-HPR脂质体;RGD-4-HPRL:含精氨酸-甘氨酸-天冬氨酸(RGD)序列的环形多肽cRGDfk修饰的4-HPRL
4-HPR浓度(mg/L)10 20 30 50 F值P值B16F10(%)A375(%)4-HPR组38.5±2.7 47.3±3.9 50.6±3.2 62.4±0.9 35.254<0.01 4-HPRL组55.7±0.5a 68.1±1.8a 73.0±1.4a 74.8±0.7a 155.653<0.01 RGD-4-HPRL组69.3±1.9a b 73.7±1.2a b 75.1±2.2a 73.5±1.4a 6.495<0.05 4-HPR组19.6±0.2 27.0±2.4 39.7±0.7 49.9±1.7 180.082<0.01 4-HPRL组36.8±0.8a 44.9±1.5a 51.0±2.3a 58.7±2.0a 84.322<0.01 RGD-4-HPRL组38.9±0.8a c 54.9±1.5a b 61.7±0.1a b 65.9±0.4a b 552.903<0.01
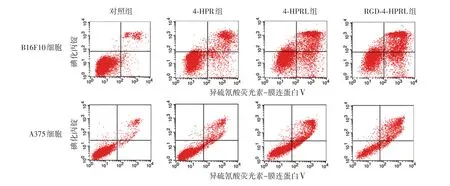
图2 4-HPR作用24 h对B16F10细胞和A375细胞凋亡的影响4-HPR:芬维A铵;4-HPRL:4-HPR脂质体;RGD-4-HPRL:含精氨酸-甘氨酸-天冬氨酸(RGD)序列的环形多肽cRGDfk修饰的4-HPRL
表2 4-HPR、4-HPRL和RGD-4-HPRL对B16F10细胞和A375细胞凋亡率的影响(±s,%)

表2 4-HPR、4-HPRL和RGD-4-HPRL对B16F10细胞和A375细胞凋亡率的影响(±s,%)
注:n=3。a与对照组相比,P<0.01;b与4-HPR组相比,P<0.01;c与4-HPRL组相比,P<0.01。4-HPR:芬维A铵;4-HPRL:4-HPR脂质体;RGD-4-HPRL:含精氨酸-甘氨酸-天冬氨酸(RGD)序列的环形多肽cRGDfk修饰的4-HPRL
分组对照组4-HPR组4-HPRL组RGD-4-HPRL组B16F10细胞4.44±0.35 28.33±0.66a 46.43±0.77a b 51.33±0.37a b c A375细胞4.97±0.62 16.68±3.81a 32.62±1.24a b 44.85±4.92a b c
五、4-HPR抑制细胞迁移
见图3。给药后24 h,对照组已有愈合倾向,而实验组愈合不明显;48 h后对照组划痕基本愈合,4-HPR组划痕变窄但仍清晰可见,而4-HPRL组和RGD-4-HPRL组划痕愈合明显减慢。
六、B16F10细胞对C6的摄取情况
孵育5 min后,细胞内C6的荧光强度在对照组为2.15±0.28,C6组为8.56±0.36,C6L组为20.48±0.13,RGD-C6L组为22.55±0.07,各组间平均荧光强度差异有统计学意义(F=67 194.186,P<0.01)。与C6组相比,C6L组与RGD-C6L组摄取量明显增加(t值分别为44.097和54.065,P<0.01),且RGD-C6L组又多于C6L组(t值为19.611,P<0.01)。
讨论
4-HPR作为新一代全反式维A酸衍生物,可抑制多种肿瘤细胞的增殖[4,10],具有毒性小、不良反应发生率低等优点。本研究中,我们通过CCK8实验、划痕实验及细胞凋亡实验证实4-HPR可抑制B16F10和A375细胞增殖、迁移并诱导凋亡。但是,4-HPR水溶性极低,在使用时通常以聚氧乙烯蓖麻油和乙醇作为溶剂,但聚氧乙烯蓖麻油可引起人体组胺释放从而导致严重的过敏反应。脂质体作为新型药物载体,无毒性及免疫原性、适合体内降解,具有降低药物毒性、减少不良反应、提高药物治疗指数、减少药物剂量等优点,并且能够通过EPR效应使药物在肿瘤内蓄积。在本实验中采用薄膜-水化法制备的脂质体制剂对4-HPR进行包载,明显提高了4-HPR的水溶性,且粒径大小均一,并且具有较高的包封率和载药量。
整合素αvβ3是细胞黏附受体整合蛋白家族成员,不仅参与细胞黏附,还参与细胞跨膜信号的双向传导[11],在多种肿瘤细胞包括黑素瘤和肿瘤血管内皮细胞表面高表达[12-13],而在正常细胞表达极低或不表达,且促进肿瘤的增殖、迁移和血管生成。因此,整合素αvβ3成为肿瘤治疗的重要靶标,RGD是整合素αvβ3的特异性配体,Kang等[14]发现RGD修饰的蛇毒提取物可通过阻断整合素αvβ3抑制黑素瘤B16F10细胞的黏附和迁移。本实验中我们以cRGDfk作为靶蛋白对4-HPRL进行修饰,通过对肿瘤细胞表面的整合素αvβ3特异性结合使药物高度识别并进入肿瘤细胞,证实通过脂质体或RGD靶向蛋白修饰的脂质体对4-HPR进行包裹可显著提高4-HPR对细胞增殖、迁移和凋亡的影响。C6摄取实验发现,脂质体明显增加细胞对药物的摄取速度,而对脂质体采用cRGDfk修饰后,细胞对药物的摄取进一步增多,且大量研究表明直径在100 nm左右的脂质体可以通过实体瘤的高通透性和滞留效应在肿瘤内蓄积,使其更好更快地发挥细胞杀伤作用。通过细胞对RGD-C6L的摄取和反应可以看出通过RGD序列向黑素瘤细胞主动递送药物是有效的。

图3 芬维A铵(4-HPR)对B16F10和A375细胞划痕愈合的影响4A:B6F10细胞;4B:A375细胞。4-HPRL:4-HPR脂质体;RGD-4-HPRL:含精氨酸-甘氨酸-天冬氨酸(RGD)序列的环形多肽cRGDfk修饰的4-HPRL
将药物靶向递送到肿瘤细胞一直是我们致力研究的重点,对B16F10和A375细胞的体外研究显示,4-HPR具有明显抑制黑素瘤细胞增殖、迁移并诱导凋亡的作用,有望成为治疗黑素瘤的新型药物,而脂质体及RGD靶向脂质体可显著提高4-HPR的作用,但RGD修饰的4-HPRL对黑素瘤的体内治疗效果及优势有待进一步研究。

