叶酸-蒜酶缀合物的合成及联合蒜氨酸原位抑制肿瘤细胞增殖作用
罗春霞,朱 丽,李心雨,木塔力甫·艾买提,伊力亚尔·尼加提,李新霞*,关 明
(1新疆师范大学化学化工学院,乌鲁木齐 830054;2新疆医科大学药学院,乌鲁木齐 830011;3新疆医科大学中心实验室,乌鲁木齐 830011)
大蒜是百合科葱属植物蒜的地下鳞茎,是一种药食两用植物[1]。蒜氨酸(alliin)是大蒜中的标志性成分[2],化学名为S-烯丙基-L-半胱氨酸亚砜,存在于无损大蒜细胞的细胞质中。蒜酶(alliinase)又称蒜氨酸裂解酶,存在于大蒜细胞的液泡里。当新鲜大蒜研碎时,蒜氨酸与蒜酶相遇,蒜氨酸在蒜酶催化裂解作用下产生大蒜辣素(allicin,图1)[3]。大蒜辣素化学名为二烯丙基硫代亚磺酸酯,其性质不稳定,可降解成多种含硫化合物。大量研究表明,大蒜辣素及其降解的含硫化合物有抑制肿瘤生长作用[4-5]。由于大蒜辣素的不稳定性,进入体内被快速代谢,生物利用度低[6]。根据这一特性,2003年以色列Weizmann课题组提出一种新的类前药研究思路,将蒜酶与特异性识别肿瘤细胞表面抗原的单克隆抗体偶联,使蒜酶靶向于肿瘤细胞表面,再给予蒜氨酸,在肿瘤细胞原位产生大蒜辣素以便于更好地发挥其抗肿瘤活性[7-10]。
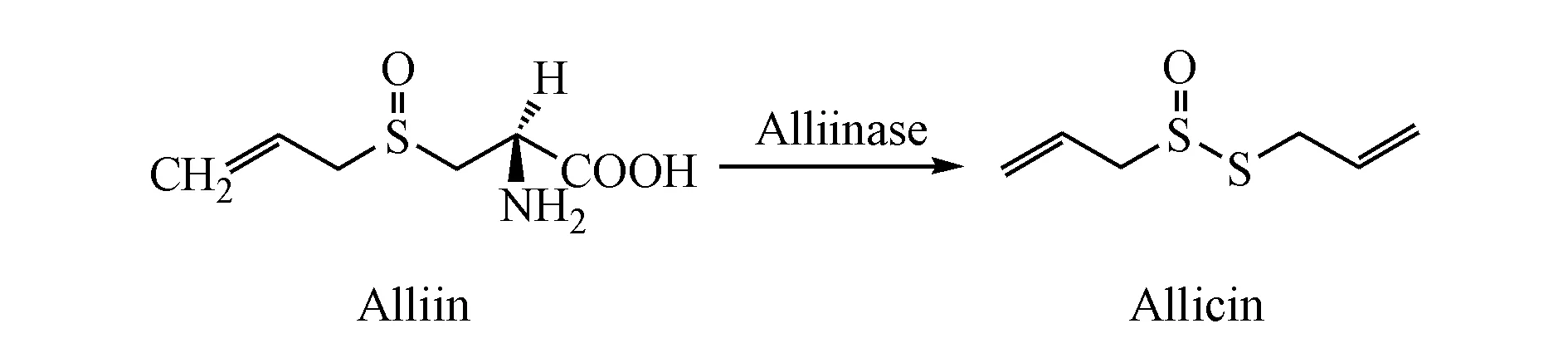
Figure 1 Reaction of alliinase on alliin
叶酸受体(folate receptor,FR)是一种糖基化磷脂酰基醇连接的膜糖蛋白,在乳腺癌、卵巢癌、肺癌、宫颈癌等癌细胞高度表达[11],而在正常细胞中的表达高度保守。叶酸(folic acid,FA)相对分子质量为441.4,能与肿瘤细胞表面高表达的叶酸受体特异性结合[12]。同时叶酸具有高亲和力,低免疫原性,易于修饰、体积小、低成本等优点[11],因此常用于将药物靶向到肿瘤细胞。本研究借鉴Weizmann课题组的思路,选择具有肿瘤靶向性的小分子叶酸,与蒜酶进行键合。
传统研究方法是先合成、纯化、结构表征后,再以肿瘤细胞测定其靶向性和肿瘤细胞的抑制增殖作用。本研究采用两种方法合成叶酸-蒜酶缀合物,经简单透析后,即以HeLa细胞为靶细胞,考察缀合物的靶向性,缀合物与肿瘤细胞靶向结合后再给予蒜氨酸,以肿瘤细胞生长情况来评价缀合物的酶活性,为优化叶酸-蒜酶缀合物合成方法提供一种最直接的路径。
1 材 料
1.1 试 剂
叶酸(FA)、甲醇(美国Sigma公司);碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)(北京西亚试剂有限公司)异硫氰酸荧光素(FITC,北京索莱宝科技有限公司);Hoechst 33342(美国Thermo Fisher Scientific公司);PBS磷酸缓冲盐溶液、双抗/青链霉素合剂、DMEM高糖培养液、0.25%胰酶-EDTA消化液(美国Hyclone公司);胎牛血清(浙江天杭生物科技股份有限公司);噻唑蓝(MTT,中国Biosharp生物科技公司);二甲基亚砜(北京索莱宝科技有限公司);人宫颈癌细胞HeLa(新疆医科大学中心实验室);蒜酶、蒜氨酸(新疆埃乐欣药业有限公司)。
1.2 仪 器
UV2550紫外分光光度计、IRPerstige-21傅里叶变换红外光谱仪(日本岛津公司);垂直电泳仪(Gel DocXR)、凝胶扫描仪、BenchmarkPLUS全波长酶标仪(美国Bio-Rad公司);CO2培养箱(美国Thermo Electron公司);C2激光共聚焦荧光显微镜(日本Nikon公司);BD流式细胞仪(美国BD LSR II公司);LC-20AB高效液相色谱仪(美国Agilent公司)。
2 方 法
2.1 叶酸-蒜酶缀合物(FA-Alliinase)的合成及表征
2.1.1 FA-AlliinaseⅠ的合成及表征 合成过程如路线1所示。将蒜酶150 mg溶于pH 7.4的PBS溶液10 mL,得蒜酶溶液。将叶酸30 mg溶于pH 7.4的PBS溶液3 mL,加入EDC 74 mg,磁力搅拌反应30 min,然后加入上述蒜酶溶液,搅拌反应2 h,反应结束后转移至透析袋中,用蒸馏水做透析液透析3 d,每4小时更换1次透析液。透析结束后冻干,得FA-AlliinaseⅠ。
2.1.2 FA-AlliinaseⅡ的合成及表征 将蒜酶150 mg溶于pH 7.4的PBS溶液10 mL,得蒜酶溶液。将叶酸30 mg溶于pH 7.4的PBS溶液3 mL,依次加入EDC 74 mg和NHS 74 mg,磁力搅拌反应30 min,然后加入上述蒜酶溶液,搅拌反应2 h,反应结束后转移至透析袋中,用蒸馏水做透析液透析3 d,每4小时更换1次透析液。透析结束后冻干,得FA-AlliinaseⅡ。
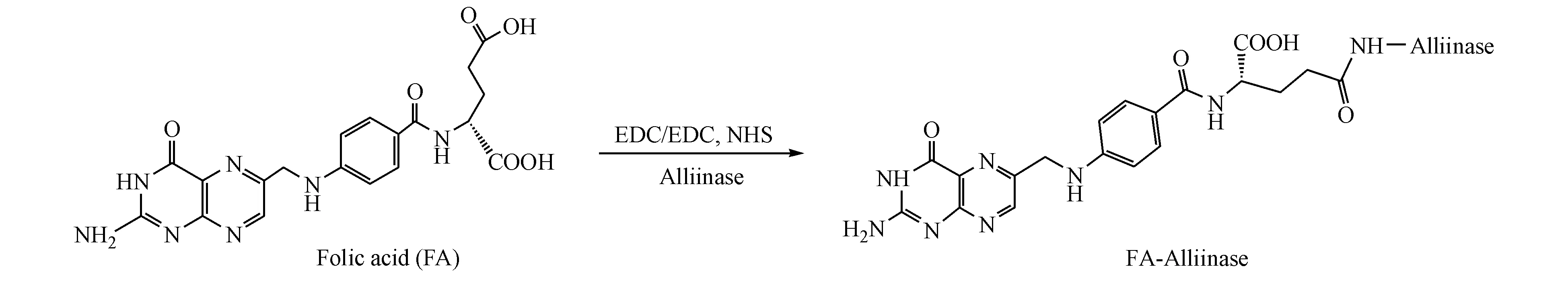
Scheme 1 Synthetic route of FA-Alliinase
2.2 偶联比测定
配制质量浓度为0.012和0.06 mg/mL的叶酸及蒜酶溶液,分别于紫外分光光度计测定280和265 nm处的吸收度;另取FA-AlliinaseⅠ、FA-AlliinaseⅡ缀合物,配制成适宜浓度,同法测定280和265 nm处的吸收度。
2.3 高效液相色谱法测FA-AlliinaseⅡ的酶活力
以4.00 mg/mL蒜氨酸溶液,作为底物,加入上述FA-AlliinaseⅡ透析液,35 ℃水浴反应5 min,按照课题组方法[13],测定大蒜辣素生成量,计算缀合物的酶活力。
2.4 流式细胞检测FA-AlliinaseⅡ对HeLa细胞的靶向性
取FA-AlliinaseⅡ加1 mg/mL FITC溶液,于4 ℃,避光磁力搅拌反应12 h,得FITC标记的FA-AlliinaseⅡ。取对数生长期的HeLa细胞制成每毫升1×105个细胞的悬液,以1.5 mL接种于培养皿中培养24 h。弃去培养液,用PBS洗涤3次。加入培养液后滴加荧光标记的FA-AlliinaseⅡ溶液,于培养箱中孵育5 h后,弃去培养液,再用PBS洗涤3次。用0.25%胰酶消化收集细胞,离心弃去上清液收集细胞,加入PBS 1 mL重悬,流式细胞仪检测荧光强度。
2.5 激光共聚焦检测FA-AlliinaseⅡ对HeLa细胞的靶向性
取上述用FITC标记的FA-AlliinaseⅡ的细胞分别于细胞培养箱中共培养1和5 h后,弃去培养液,PBS洗涤3次,用浓度为4%的甲醛固定细胞(15 min),PBS洗涤3次,加入Hoechst 33342试剂复染色细胞核(5 min),PBS洗涤3次,于激光共聚焦显微镜下观察。
2.6 抗肿瘤活性实验
采用MTT实验研究FA-AlliinaseⅡ联合蒜氨酸对HeLa细胞生长抑制的作用。将HeLa细胞制成每毫升5×104个的细胞悬液,接种到96孔板,毎孔200 μL,培养24 h,至HeLa细胞长到80%左右,吸掉培养液并用PBS洗涤,加入FA-AlliinaseⅡ培养5 h后,弃去培养液,PBS轻洗3次,每孔加入系列浓度蒜氨酸80,140,260,320,380,440 μmol/L溶液200 μL,继续培养24 h。避光条件下,向每个细胞孔中加入5 mg/mL MTT溶液20 μL,于培养箱中继续培养4 h后,吸出每孔的药液,加入DMSO 150 μL,酶标仪490 nm处测吸收度。计算其对HeLa细胞的增殖抑制率,采用SPSS 17.0 软件处理数据。
3 结 果
3.1 FA-AlliinaseⅠ紫外光谱法表征
FA在214、280、344 nm有紫外吸收,最大吸收峰280 nm。EDC在214 nm有特征吸收,蒜酶在265 nm有紫外吸收(图2)。FA、EDC、Alliinase混合物在280与344 nm处的吸收度比值(A280/A344)为3.54,FA-AlliinaseⅠ的A280/A344为1.89。由此可知FA-AlliinaseⅠ是键合产物而非混合物叠加,344nm处的吸收来源于缀合物结构中FA片段,推断FA与Alliinase键合成功。
3.2 FA-AlliinaseⅡ紫外光谱法表征
FA在214、280、344 nm有紫外吸收峰,蒜酶在265 nm有最大吸收峰。EDC和NHS分别在214和265 nm处有紫外吸收(图3)。合成产物FA-AlliinaseⅡ在280 nm有吸收,但较叶酸低,并不是合成原料的简单叠加。FA-AlliinaseⅡ在344 nm的吸收度为0.16,A280/A344为3.06;FA-AlliinaseⅡ在344 nm处的吸收来源于缀合物结构中FA片段,推断FA与Alliinase键合成功。
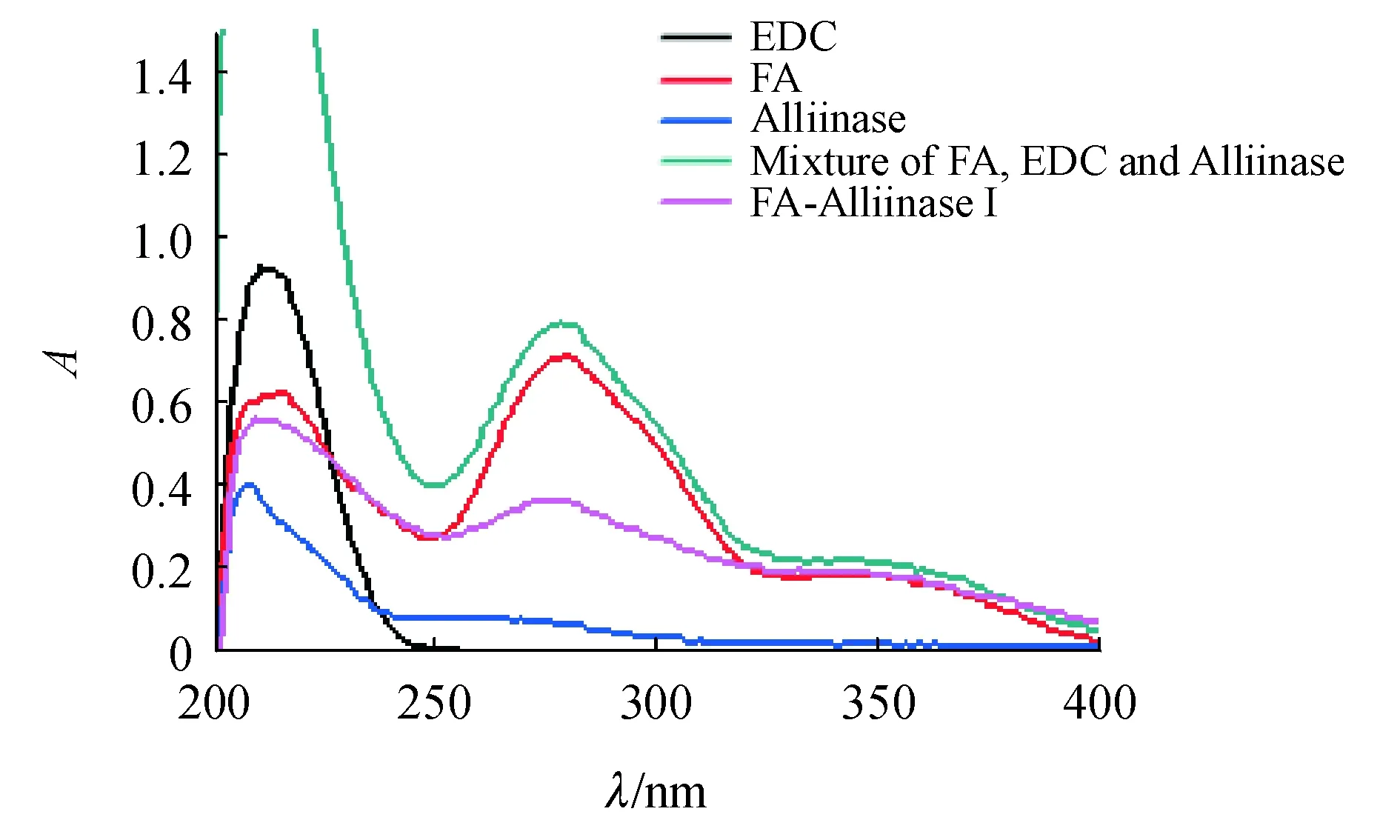
Figure 2 Compared the UV absorption spectra of FA-Alliinase I with raw materials
EDC:1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride
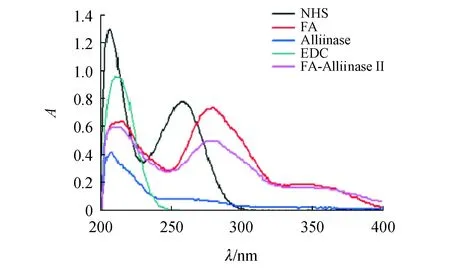
Figure 3 Compared the UV absorption spectra of FA-Alliinase II with raw materials
3.3 偶联比计算
根据文献[14-15],可以通过公式(1)计算FA-Alliinase的偶联比n:
(1)
其中M为相对分子质量(MAlliinase为104 000;MFA为441.4);C为浓度;AFA-Alliinase,280为FA-Alliinase在280 nm的吸收度;AAlliinase,265为Alliinase在265 nm的吸收度;AAlliinase,280为Alliinase在280 nm的吸收度;AFA-Alliinase,265为FA-Alliinase在265 nm的吸收度;AFA,280为FA在280 nm的吸收度;AFA,265为FA在265 nm的吸收度。
将表1中的吸收度数据带入上述公式计算,得FA-AlliinaseⅠ偶联比为12,即1分子蒜酶上键合了12分子叶酸。FA-AlliinaseⅡ的偶联比为31,偶联比大于FA-AlliinaseⅠ,故确定选用FA-AlliinaseⅡ合成路径,并对其进行进一步表征及性能测试。
3.4 FA-AlliinaseⅡ红外光谱法表征
FA的红外图谱数据显示在3 549 cm-1处有-NH2的伸缩振动,1 693 cm-1为-NH(伯酰胺)的伸缩振动,1 604 cm-1为苯环骨架和-C=N的伸缩振动(图4-A);从FA-AlliinaseⅡ图谱可知,FA-AlliinaseⅡ谱带在3 400~1 800 cm-1之间吸收峰与蒜酶相似(图4),且与蒜酶均在3 300 cm-1左右有一个宽吸收峰,2 800~1 800 cm-1没有吸收峰。FA-AlliinaseⅡ谱带在1 636 cm-1出现-NH(伯酰胺)的伸缩振动;1 600~1 500 cm-1出现苯环骨架的C==C 的吸收峰以及C=N双键的吸收峰,由此可知叶酸已与蒜酶键合。
Table 1 UV absorbance of FA,alliinase,FA-Alliinase I and FA-Alliinase II
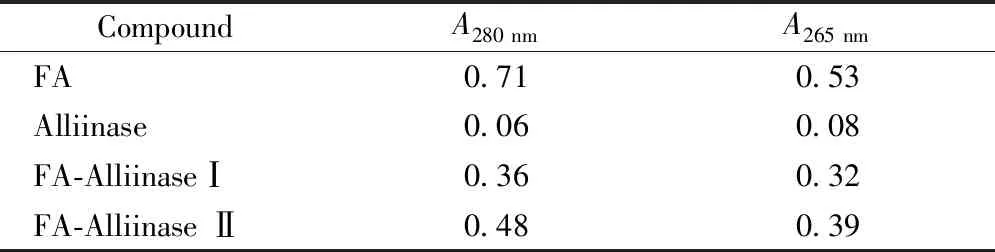
CompoundA280 nmA265 nmFA0.710.53Alliinase0.060.08FA-AlliinaseⅠ0.360.32FA-Alliinase Ⅱ0.480.39

Figure 4 Infrared absorption spectra of FA (A),Alliinase (B) and FA-Alliinase II (C)
3.5 SDS-PAGE凝胶电泳法鉴定 FA-AlliinaseⅡ
将电泳图(图5)导入Gel-pro Analyzer 软件,设置彩色预染蛋白Marker为标准,测得FA-AlliinaseⅡ条带到原点的相对距离为0.338,蒜酶条带到原点的相对距离为0.395。说明蒜酶已与叶酸键合,键合后FA-AlliinaseⅡ相对分子质量增加,所以迁移速度比蒜酶慢,条带略为滞后。
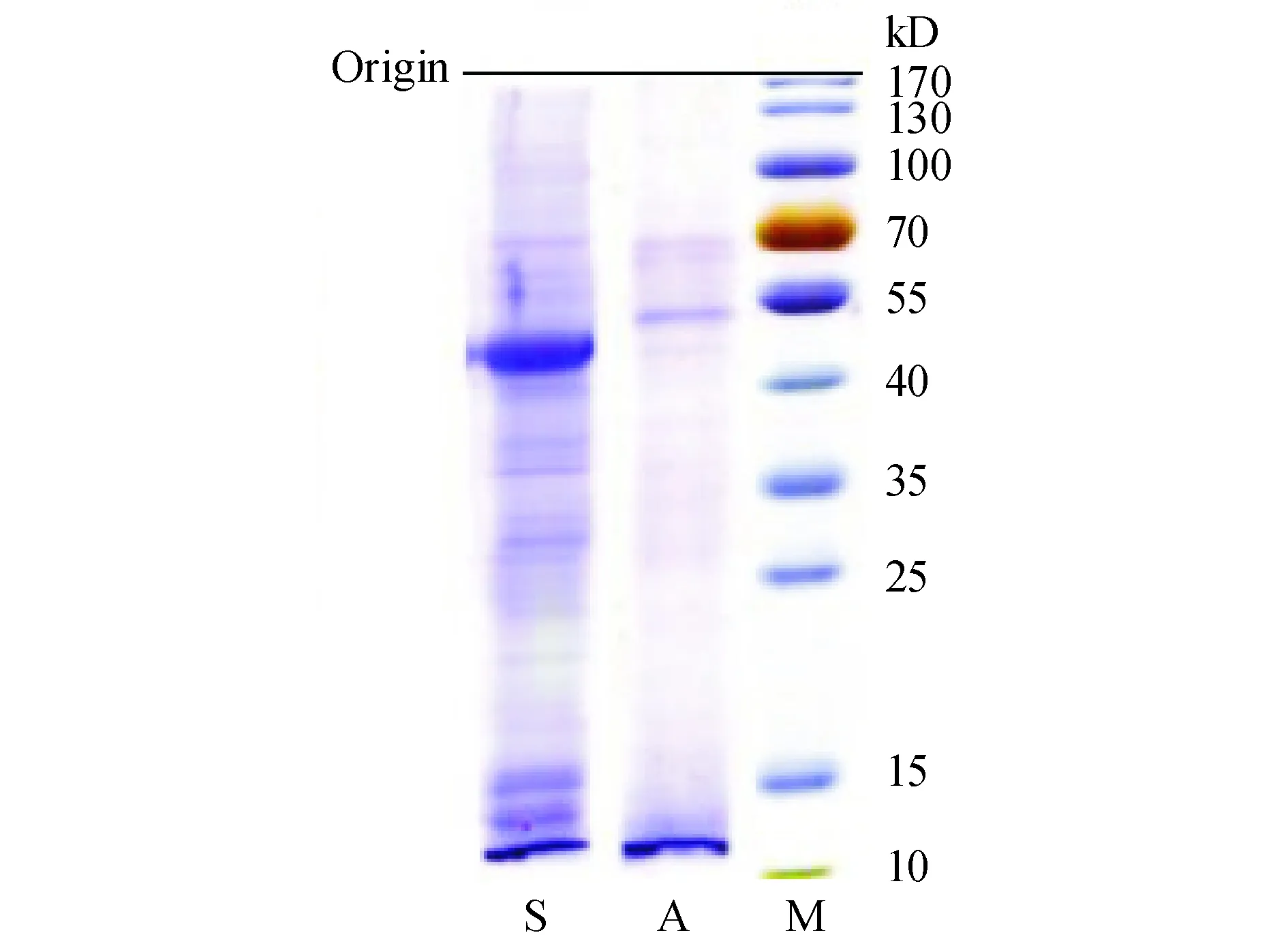
Figure 5 PAGE map of alliinase,FA-Alliinase II
M:Marker;A:FA-Alliinase II;S:Alliinase
3.6 FA-AlliinaseⅡ活力测定
将蒜氨酸加入FA-AlliinaseⅡ反应,HPLC测定的大蒜辣素生成量为2.14 mg,说明FA-AlliinaseⅡ具有酶活性,可与底物蒜氨酸反应生成大蒜辣素,因此可以进一步探讨其在细胞水平上的靶向性及抗肿瘤活性(图6)。
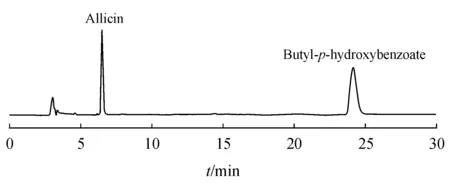
Figure 6 HPLC chromatogram of FA-Alliinase II sample solution
3.7 流式细胞术检测结果
采用流式细胞仪测定荧光标记的FA-AlliinaseⅡ对叶酸受体的识别功能。从流式细胞测定结果图中可以看出,与空白对照相比,FA-AlliinaseⅡ作用后的HeLa细胞出现了较为明显的荧光峰偏移(图7),说明FA-AlliinaseⅡ识别并结合到HeLa细胞表面的叶酸受体上,使HeLa细胞表面带有荧光,出现了荧光峰偏移。
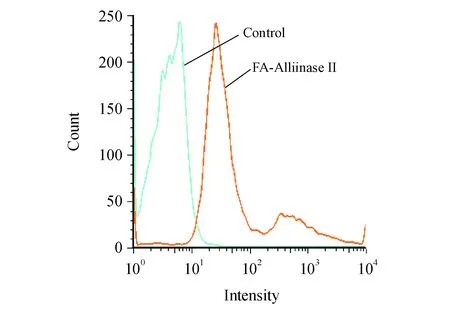
Figure 7 Flow cytometry of FA-Alliinase II
3.8 激光共聚焦显微镜检测结果
采用激光共聚焦观察荧光标记的FA-AlliinaseⅡ对于HeLa细胞的作用过程。图中蓝色荧光显示是荧光染色的细胞核;绿色荧光是荧光标记的FA-AlliinaseⅡ。当作用时间为1 h时(图8-A)可以观察到FITC标记的富集在细胞膜的表面,少量进入到细胞内。当作用时间延长至5 h时(图8-B),细胞膜上结合的FA-AlliinaseⅡ数量增加,有更多的分子进入细胞内部,分布在细胞浆及细胞核表面。
3.9 MTT测定体外抗肿瘤活性结果
单独加蒜氨酸时未观察到HeLa细胞的凋亡,单独加FA-AlliinaseⅡ时对HeLa细胞抑制率为7.7%。FA-AlliinaseⅡ联合蒜氨酸的结果显示,蒜氨酸浓度依赖性抑制细胞增殖(图9);当蒜氨酸浓度为440 μmol/L,细胞抑制率达到90.67%,以蒜氨酸计IC50为(127.6±2.3)μmol/L。说明蒜氨酸与FA-AlliinaseⅡ反应产生了大蒜辣素,而大蒜辣素对肿瘤细胞的增殖是有抑制作用的。其在一定范围内,随着蒜氨酸浓度增大,产生大蒜辣素的量增加,肿瘤细胞的生长抑制率增加。
4 讨 论
近年来,关于大蒜辣素抑制肿瘤生长的文献报道较多,引起了国内外学者的广泛关注[5-6]。但是大蒜辣素不稳定,特别是进入到体内后迅速消失,检测不到原型,因此,大蒜辣素的抗肿瘤作用的研究多见于体外研究,而动物药效学实验鲜见报道[7,16]。本研究参考文献,设计将蒜酶偶联叶酸,使其靶向于肿瘤细胞后,给予蒜氨酸,在肿瘤细胞原位产生大蒜辣素,从而提高大蒜辣素的抗肿瘤效率。蒜酶为二聚体糖蛋白,最适宜催化反应温度为35 ℃,因此在合成过程中需选择合适的温度和pH,尽量保留一定的蒜酶活力。因此,本研究的主要目标是化学键合,并采用肿瘤细胞直接测试其肿瘤靶向性和能否产生大蒜辣素。
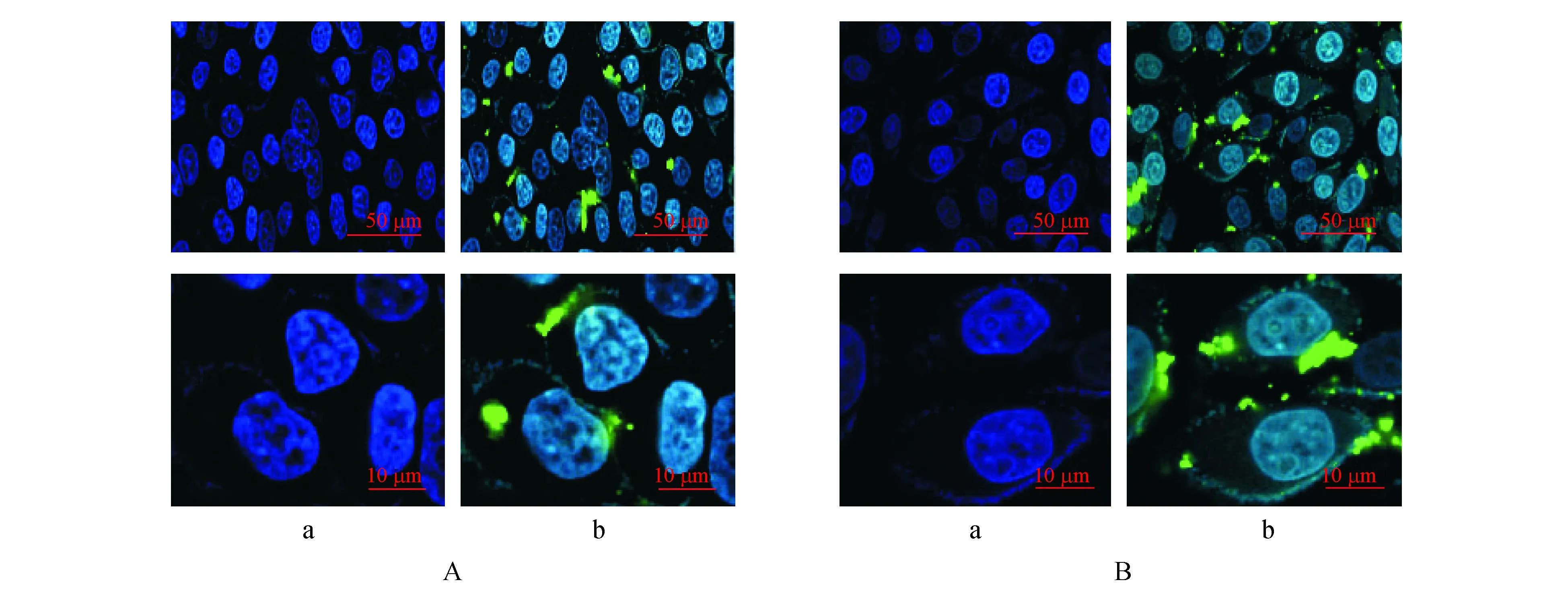
Figure 8 Confocal micrograohs of HeLa cells treated with FA-Alliinase II for 1 h (A) and 5 h (B) .Cell nuclei were stained blue with Hoechst 33342 (a) and FA-Alliinase II was shown as green fluorescence (b)
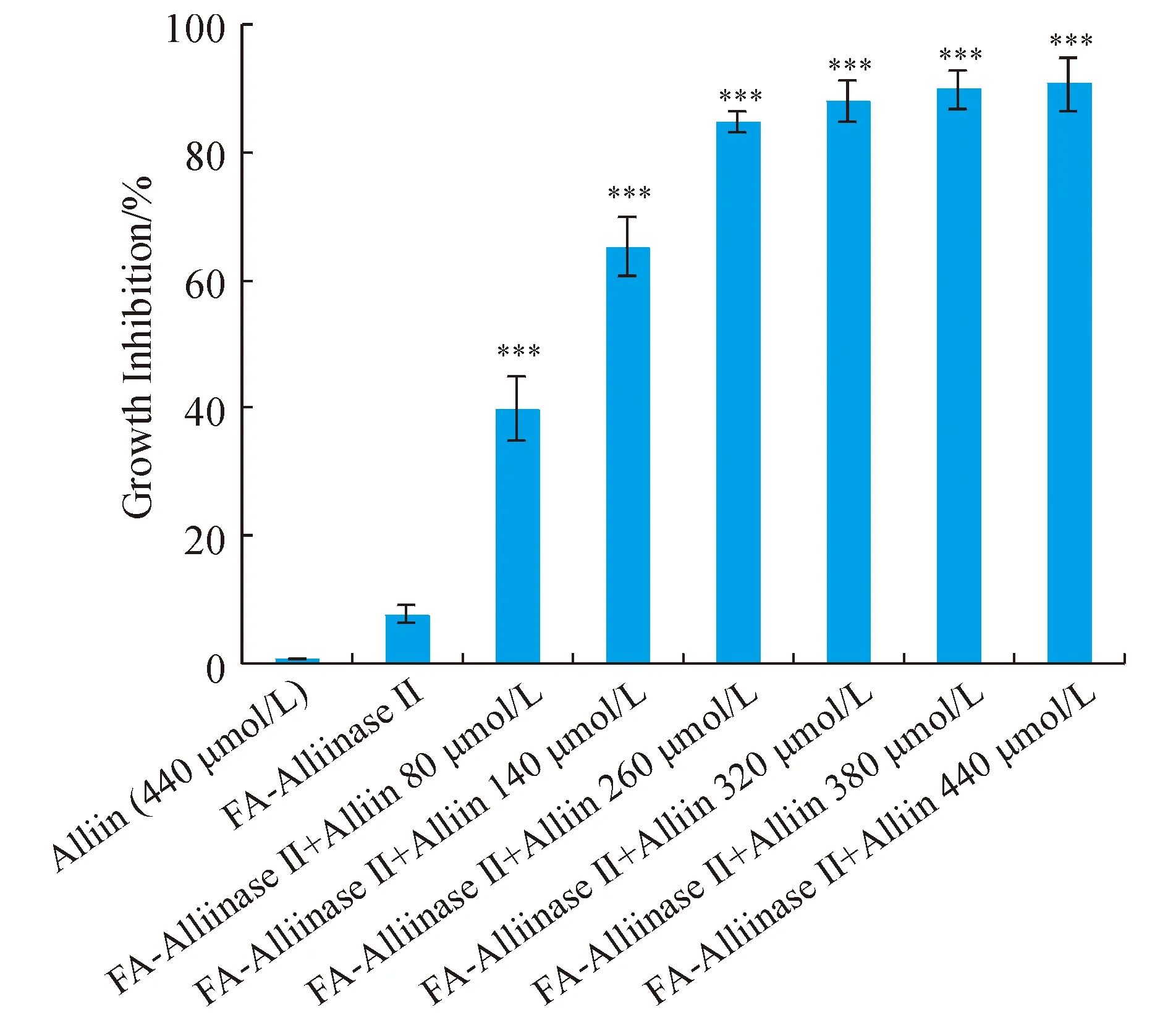
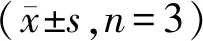
***P< 0.001vsFA-Alliinse II group
合成路线选择以EDC脱水生成酰胺键将叶酸与蒜酶直接键合,该条件较为温和,可以尽量多的保留蒜酶活性。HPLC测定FA-AlliinaseⅡ与蒜氨酸反应大蒜辣素生成量为2.14 mg,与理论反应生成的大蒜辣素4.53 mg相比,约保留了50%的蒜酶活性。在后续还可以筛选一些更温和的反应方法以提高键合产物的酶活力。
本研究直接采用HeLa细胞来考察键合产物对肿瘤细胞的靶向性及加入蒜氨酸后细胞生长的抑制作用来验证其产生大蒜辣素的能力。激光共聚焦显微镜和流式细胞的结果表明,FA-AlliinaseⅡ对HeLa细胞有一定的靶向性,激光共聚焦得出靶向的缀合物的量跟时间有相关性。MTT结果显示,对HeLa细胞的增殖起到抑制作用的是FA-AlliinaseⅡ与蒜氨酸的反应产物-大蒜辣素,且抑制细胞生长作用与加入的蒜氨酸浓度有依赖关系。据报道,大蒜含硫化合物可进入红细胞,与红细胞内的谷胱甘肽(GSH)发生亲核取代产生H2S[17]。大蒜辣素结构中含有亚砜基,如果蒜酶缀合物在细胞表面,加入蒜氨酸后,产生的大蒜辣素易穿透细胞膜进入细胞发挥作用[7];如果蒜酶缀合物经细胞内吞进入细胞,因蒜氨酸结构中也含有亚砜基,也易于进入细胞与膜内的蒜酶缀合物反应产生大蒜辣素发挥活性作用,两种可能的机制,在膜内和膜表面均可产生大蒜辣素,提高抑制肿瘤生长的效率。
本研究工作合成了FA-Alliinase缀合物,较为直接地采用HeLa评价其对肿瘤细胞的靶向性和抑制作用,对后续进一步的优化和筛选合成方法,提高大蒜辣素的转化率,不失为一个最直接和简便的方法。在获得优选的合成方法后,再考虑进一步的纯化及采用经典手段对结构进行全面表征。在获得一定量的纯化产物后将建立宫颈癌HeLa细胞移植瘤模型,根据前期课题组完成蒜氨酸口服和注射给药代谢动力学和组织分布[18],先持续静脉给予蒜氨酸,中间腹腔注射叶酸-蒜酶缀合物,考察该组合模式的抗肿瘤作用。

