人子宫内膜异位症的可示踪裸鼠模型构建*
关绮蕙,史文静,周龙书,李 露
(广州医科大学附属第二医院妇产科,广州 510260)
子宫内膜异位症(以下简称“内异症”)是指子宫内膜组织出现在子宫体以外的部位,其治疗方式主要有手术及药物治疗,其中药物治疗只能对症治疗而不能去除异位的内膜细胞,而手术治疗有较高的复发率[1]。因此,如何提高内异症的临床治疗效果是迫切需要解决的问题。目前国内外已建立的内异症动物模型都存在一定的缺陷[2],限制了基础研究成果向临床转化的可能性。本文将内异症患者的在位子宫内膜制成组织悬液,应用慢病毒载体将荧光素酶和红色荧光蛋白基因转入子宫内膜组织,并注射到裸鼠腹腔内,以构建可示踪的内异症裸鼠模型,为内异症的发病机制和新治疗药物的筛选及药理药效学研究提供坚实的实验基础。
1 材料与方法
1.1实验材料 子宫内膜组织均来自本院因卵巢巧克力囊肿合并子宫肌瘤行全子宫切除术的在位子宫内膜,所有患者术前3个月内均未接受激素类药物治疗,既往未合并其他内、外科疾病、免疫性及其他恶性疾病;36只无特殊病原体(SPF)级6~8周龄BALB/C雌性裸鼠购自中山大学动物实验中心,体质量(16±4)g;LV-RFP-Luc购自上海汉恒生物有限公司,D-Luciferin购自美国Goldbio公司;小鼠抗人波形蛋白单克隆抗体-7(V-7)、小鼠抗人细胞角蛋白单克隆抗体-18(CK-18)均购自美国Santa Cruz公司;小鼠抗人单克隆抗体-CD34(CD34)购自广州创科伟生物科技有限公司。
1.2方法
1.2.1子宫内膜组织采集及体外病毒转染 用磷酸盐缓冲液(PBS)漂洗新鲜收集的内膜组织并将其剪碎为糊状悬液。将其分为等体积的A、B两组,分别接种于无菌六孔板内,每孔加入含有20%胎牛血清和0.002 5 μg/mL 17β-雌二醇(E2)的DMEM/F12培养基2 mL,A组每孔加入含有终浓度5 μg/mL Polybrene滴度为1×108IU/mL的LV-RFP-Luc,并于体外转染24 h;B组加入等体积的培养基。两组均置入37 ℃ 5% CO2培养箱培养,24 h后将两组子宫内膜组织培养液均换成含有20%胎牛血清和0.002 5 μg /mL E2的DMEM/F12培养基2 mL,培养48 h后在荧光显微镜下观察子宫内膜组织块的荧光表达情况。
1.2.2构建动物模型 将裸鼠等数量分为A、B、C 3组,每组12只。3组中每只裸鼠分别于腹腔内一次性注射等体积的已转染的组织块悬液、未转染的组织块悬液和DMEM/F12培养基。注射后参考文献[3]肌内注射E2(0.02 μg/d)。种植后每隔7天1次在活体成像仪下监测异位病灶的发展情况。
1.2.3异位病灶的采集及形态和来源鉴定 于建模后第28天颈椎脱臼处死裸鼠,剖腹观察异位病灶的生长情况并分离异位病灶。异位病灶分离后分别放入装有4%多聚甲醛溶液的离心管中固定,并分别按试剂盒操作说明行苏木素-伊红(HE)染色及免疫组织化学鉴定。若HE染色病灶中有子宫内膜腺体组织、间质细胞及新生血管形成,且免疫组织化学鉴定子宫内膜腺体组织和间质细胞均来源于人类,则提示裸鼠内异症模型建模成功[4]。
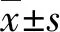
2 结 果
2.1体外LV-RFP-Luc转染情况及鉴定 (1)A组子宫内膜组织体外培养至48 h在荧光显微镜下观察示:子宫内膜组织块红色荧光蛋白表达明亮,细胞阳性数率多(图1C);其快速冰冻切片可见典型的腺体结构(图1D)。(2)HE染色结果显示:A组和B组的子宫内膜组织块均保持着完整的子宫内膜腺体结构 (图1A、B)。

A: A组组织;B:B组组织;C:A组组织块;D:A组快速冰冻切片
图1 子宫内膜组织转染情况(HE,×200)
2.2活体成像仪监测异位病灶
2.2.1活体成像仪下异位病灶的荧光信号ROI表达 各组裸鼠在整个生长周期中,生长状况良好,实验中未发现裸鼠感染和(或)死亡等情况。A组11只裸鼠在活体成像下均能检测到腹腔异位病灶发出的荧光信号;其中1只裸鼠于造模后第21、28天均未检测到异位病灶的荧光信号。动态检测到异位病灶发出荧光信号ROI值由第7天至第14天先变小,由第14天至第28天逐渐增大。而B组和C组均未检测到异位病灶荧光信号(图2)。

图2 活体成像仪下异位病灶荧光信号ROI表达
2.2.2腹腔内异位病灶发出荧光信号ROI值 异位病灶发出荧光信号的ROI值先减小后增大:第7、14、21、28天分别为(7.008±1.024)×106、(4.363±0.731)×106、(5.113±0.696)×106、(6.34±0.713)×106,第7天至第14天,荧光信号ROI值先减小,差异有统计学意义(P<0.01);第14天至第28天,ROI值增大,差异有统计学意义(P<0.05),见图3、4。

图3 异位病灶ROI值趋势的曲线图

*:P<0.05;#:P<0.01;n=13
图4 异位病灶ROI值的比较
2.2.3剖腹后裸鼠腹腔内异位病灶形成情况 (1)A组中腹腔内连续检测到荧光信号的裸鼠剖腹后肉眼均可见透明紫色囊肿或白色硬结(图5A白色单箭头所指),未见其他游离病灶。异位病灶周围可见丰富血管形成或点状出血,囊内积聚暗红黏稠液体(图5B白色双箭头所指)。大部分异位病灶黏附于肠系膜、膀胱旁脂肪垫等处,且与周围组织存在轻度粘连。另外1只于第21、28天均未能检测到荧光信号的裸鼠剖腹后未见任何异位病灶,提示该个体造模失败。(2)B组中所有裸鼠腹腔内均可见透明紫色囊肿或白色硬结(图5C白色单箭头所指),未见游离病灶。异位病灶周围可见丰富血管形成,囊内积聚清亮液体。大部分异位病灶黏附于肠系膜、膀胱旁脂肪垫等处,且与周围组织存在轻度粘连(图5D白色双箭头所指),C组未见明显异位病灶。
2.2.4异位病灶HE染色及免疫组织化学鉴定结果 (1)A、B两组裸鼠的每个异位病灶均可见典型的内膜腺体结构,血管增殖丰富,未侵入腺泡腔。其组织学形态特征和人原发内异症的表现极为相似,无明显病理学改变,且两组的形态学结构未见明显异常(图6A、B)。(2)A组和B组裸鼠腹腔中种植成功的异位病灶,间质细胞质、腺上皮细胞质、血管内皮细胞质分别被V-7、CK-18、CD34染成棕黑色(见图6C~H)。证明了移植的子宫内膜组织并未改变子宫内膜组织细胞的特异性蛋白表达,确定异位病灶组织与人类的子宫内膜组织同源,提示了可示踪内异症动物模型建模成功。

A、B:A组裸鼠;C、D:B组裸鼠
图5 A组和B组异位病灶
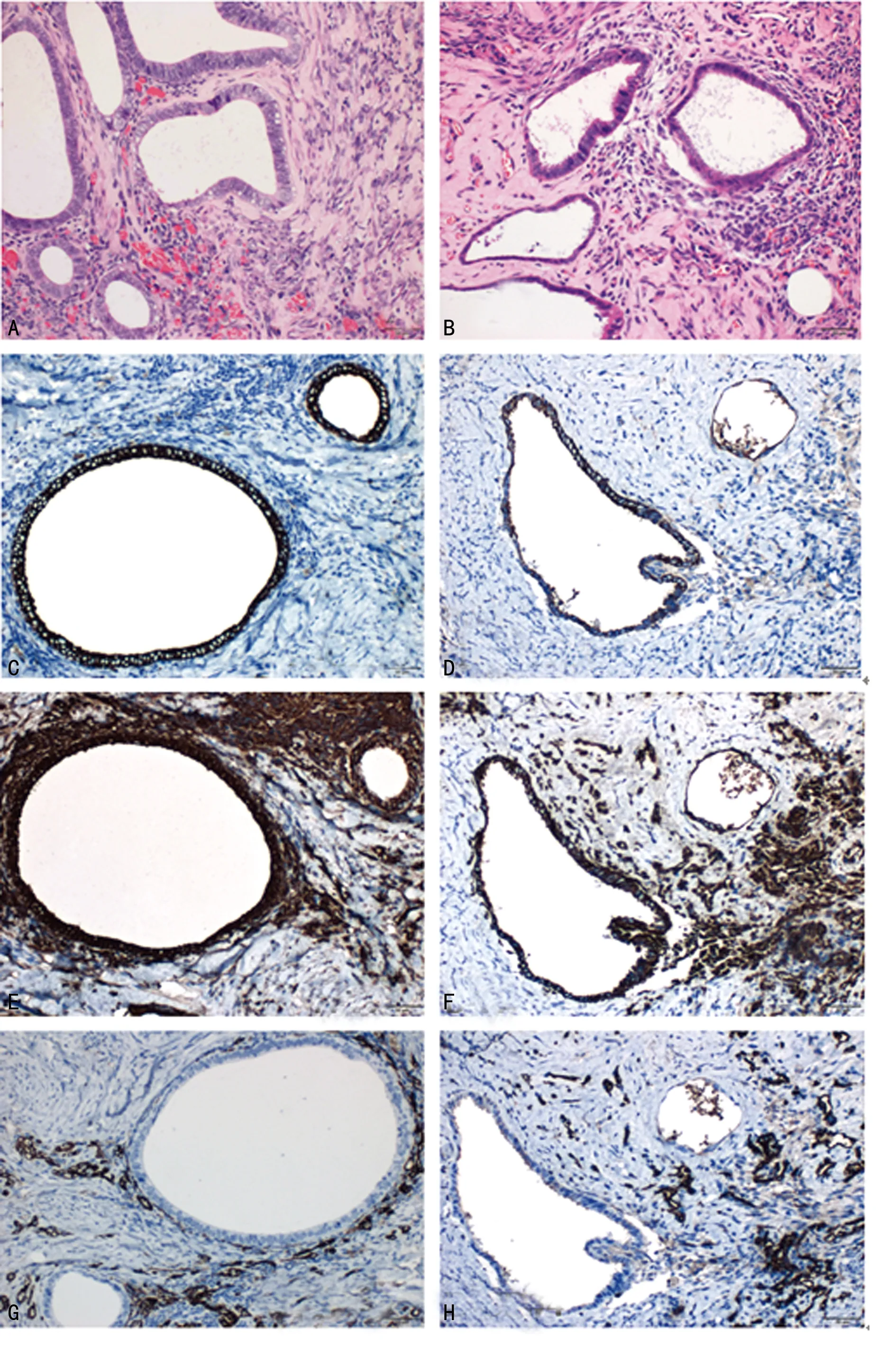
A、B:裸鼠的异位病灶组织形态(HE);C、D:CK-18表达水平(免疫组织化学);E、F:V-7表达水平(免疫组织化学);G、H:CD34表达水平(免疫组织化学)
图6 A、B两组异位病灶HE染色及免疫组织化学鉴定(×200)
2.2.5各组异位病灶成模率 A组异位病灶成模率为91.67%,B组异位病灶成模率为100.00%,C组未见任何异位病灶。
3 讨 论
内异症可引起痛经、性交痛、不孕等症状[5],迄今为止其发病机制仍不明确。由于伦理学方面的约束,动物模型已成为研究发病机制和治疗方法的主要途径。动物模型可分为灵长类和啮齿类动物,其中灵长类动物具有成模率低、费用昂贵等问题,限制其在研究中的应用。而啮齿类动物具有费用低廉、易于繁殖等优点,因此可用于内异症的发病机制及治疗等方面的研究[6]。
目前应用的啮齿类内异症动物模型有大鼠自体移植模型和免疫缺陷小鼠异体移植模型。大鼠自体移植模型虽然存在很多优点如易于生长、移植物无自身免疫抵抗等[7-8],但移植物本身来源于实验动物,与人类的种属差异性较大,实验结果不能直接应用于人类。在免疫缺陷小鼠异体移植模型中,人子宫内膜被直接种植于小鼠腹腔内,移植的内膜组织保留原来的组织形态和生化特性,可以在动物体内研究人子宫内膜的侵袭演变过程。GREAVES等[9]和 YAMAGATA等[10]将人子宫内膜组织碎片或子宫内膜细胞悬液,注射到裸鼠的腹腔中成功构建内异症病灶。AGOSTINIS等[11]通过把卵巢巧克力囊肿患者的囊内组织和在位内膜的组织碎片,注射到SCID小鼠的腹腔内,成功构建内异症病灶。HE等[12]将人子宫内膜细胞注射到裸鼠身上,成功构建内异症病灶,成模率高达80%。
以往在内异症病灶发展的研究中,常根据在特定时间进行开腹探查后所得的异位病灶体积、大小等来评价病灶发展情况[13-14]。该方法缺乏对同一病灶准确、实时的监控,不能明确区分病灶与周围组织,需在不同的时间点牺牲实验动物[15]。近年来,活体无创观察方法备受关注。其原理是应用病毒载体将荧光素酶或荧光蛋白基因转入子宫内膜细胞或组织,把已转染的细胞或组织种植于实验动物身上,运用活体成像仪即可监测异位病灶的位置及其大小[16]。FERRERO等[17]成功建立了内异症小鼠模型,通过无创监测来研究内异症病灶早期的生长和进展情况。WANG等[18]将含有红色荧光蛋白基因的腺病毒转染内膜细胞,然后将其注射于裸鼠皮下或腹腔内,通过荧光扫描成像系统监测病灶的生长情况。本实验方法灵敏度高、特异性强,能实时监测活体动物病灶的动态变化,避免了处死动物带来的实验损耗,以及只能单次对同一个体进行病灶生长情况评估等缺点,具有不可比拟的优越性[19]。
本实验中HE染色及免疫组织化学结果证明了移植的内膜组织并未改变其特异性蛋白表达,确定异位病灶组织与人子宫内膜组织同源,与ZHAO等[20]报道相符。而通过活体成像系统监测到的异位病灶荧光信号ROI值先减小后增大,与SOHNGEN等[21]和GROOTHUIS等[22]报道相符。可示踪的内异症裸鼠模型造模成功。
与以往的大鼠自体移植法建模及有创测量法相比,本方法采取人的子宫内膜组织建立模型,减少了因物种差异带来的结果偏差;使用无创的监测手段,减少实验动物损耗,可连续、实时、准确地观察病灶的生长情况。本研究通过建立可靠、重复性强、可示踪的内异症动物模型,为研究内异症提供坚实的研究平台,可广泛应用于临床前内异症新药疗效测试及内异症的发生机制研究。

